土壤提供了植物的营养及水分供应、有机物和有毒化合物的分解及转化、水体净化、病虫害防治和温室气体排放等基本生态系统功能[1]。而土壤结构是土壤维持基本生态系统功能和质量的关键因素[2]。对于土壤结构功能的量化可从两个不同的角度进行,一个关注固相的聚集,另一个关注孔隙空间,这两种角度至今仍存在巨大分歧[3]。土壤筛分提供了一种快速低价的土壤结构体量化工具,几十年来一直是土壤结构研究的主流,因此本文将从土壤团聚的角度量化结构功能。
作为土壤结构基本单元的团聚体在维持农作物生产力、促进土壤碳固存、为土壤生物提供栖息地以及调节土壤水分动态等多方面发挥着重要作用[4]。土壤学家对团聚体的形成过程进行了大量的研究,目前人们普遍认可1982年Tisdall和Oades[5]提出的团聚体分级理论模型,即土壤大团聚体是在有机无机胶结物质作用下由小到大逐级形成的;该模型认为土壤矿物颗粒(< 0.2 μm)首先通过多价金属阳离子和腐殖质等持久性胶结物质作用下由小颗粒微团聚体(< 20 μm)逐渐形成微团聚体(20~250 μm),之后在真菌菌丝、植物根系和多糖等瞬时性胶结物质作用下形成大团聚体(> 250 μm)。良好的土壤结构取决于土壤团聚体的稳定性和粒径分布,因此促进团聚体形成和增强团聚体稳定性对提升土壤质量具有重要意义。
农业土壤中的团聚体结构受到多种因素的影响,包括土壤生物群(微生物和动物)、植物根系、成土矿物类型、有机质、无机黏合剂和环境条件等[6]。其中,植物根际受当地适宜种植农作物的种类限制,成土矿物类型由成土母质决定,无机黏合剂的施用效果持久性不强且易引起土壤板结,而环境条件往往也难以改变。因此,在农业生产中添加有机物质和提升生物群落丰度及活性是促进土壤团聚体形成和稳定的有效途径。近年来许多研究表明,作为“生态系统工程师”的土壤微生物和动物在土壤团聚体形成及稳定过程中发挥着关键作用[7-10]。尽管团聚体的形成过程和稳定机制存在地域差异,但从土壤生物的角度出发有助于更好地认识其中的共性机制,这对于优化土壤管理策略和提高农业生产效益具有重要的理论及应用价值(图 1)。
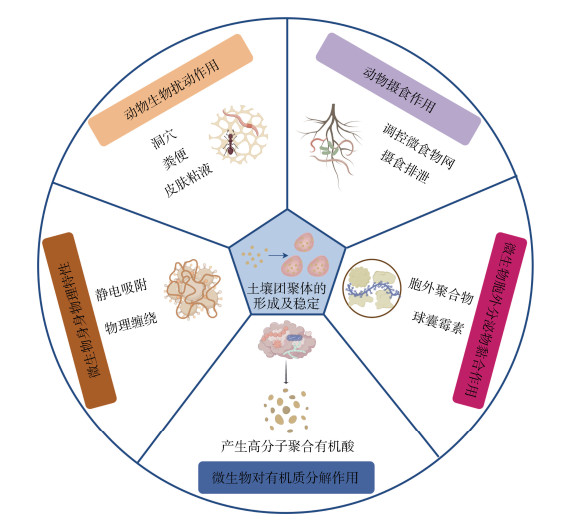
|
图 1 土壤生物驱动的土壤团聚体形成及稳定主要机制框架(本图使用Figdraw绘制) Fig. 1 Main mechanism framework of soil aggregates formation and stability driven by soil organisms (drew by Figdraw) |
本文基于Web of Science数据库,采用“Soil aggregate”“Soil aggregate and microorganism”“Soil aggregate and animal”和“Soil aggregate and microorganism and animal”关键词检索2014年至2023年发表的相关文献。从图 2看出,与土壤团聚体有关的论文发表量逐年上升,并在2021年之后稳定在年发文量2 400篇左右。“土壤团聚体+微生物”和“土壤团聚体+动物”主题的论文年发表量在2015年至2019年之间进入快速增长阶段,并在2019年后稳定在400篇左右,分别占“土壤团聚体”主题年发文量的约16%。由此可见,微生物及动物在土壤团聚体研究中的热度和重要性。但是,“土壤团聚体+微生物+动物”主题的论文发表量在2023年仅占“土壤团聚体”主题的4.52%,说明大多数研究分别关注微生物或动物对土壤团聚体形成及稳定的影响,而没有探究微生物和动物的联合作用对土壤团聚体的具体影响,土壤生物(微生物和动物)与团聚体研究领域尚有较大研究空间。与此同时,“土壤团聚体+微生物+动物”主题的论文发表量逐年上升,2020年至2023年的发文量增加了28.92%,这也说明土壤生物与团聚体相关研究正在受到科研人员的重视。
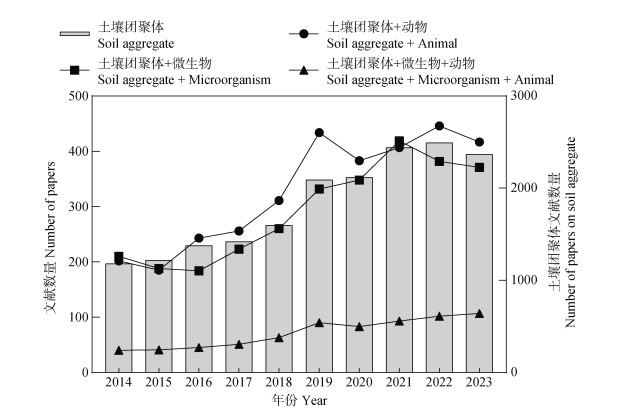
|
图 2 2014年至2023年土壤团聚体相关论文发表量 Fig. 2 The number of papers published on soil aggregates from year 2014 to 2023 |
团聚体的稳定性直接影响土壤多界面过程,其在评价土壤质量和抗侵蚀能力方面具有重要意义。土壤团聚体的形成和稳定过程较为复杂,涉及物理、化学和生物学的共同作用,受到自然条件和人类活动的影响,充分认识其机制对于全面了解团聚体形成演变规律和促进土壤与农业可持续发展具有重要价值。由于土壤不同组分之间存在的复杂相互作用力,不同大小团聚体的形成和稳定机制仍有待深入系统研究。
作为土壤生态系统不可分割的一部分,微生物主导着土壤生命,其通过调节养分循环、分解有机质、塑造土壤结构、支持植物生产力和抑制土传植物病害来执行一系列重要的土壤功能[11]。团聚体作为土壤结构的组成部分是土壤肥力最重要的特征之一,其组成及分布影响着微生物群落活动和生长,而微生物群落组成和活动也会影响土壤团聚体的形成及稳定。微生物是土壤团聚体形成过程中最活跃的生物因素[12]。1945年,Martin[13]研究发现微生物会促使土壤粉粒和黏粒之间显著团聚,首次提出真菌和细菌在土壤团聚体的形成过程中起着黏合剂的作用。自此之后,人们开始意识到土壤微生物在团聚体形成及稳定中的重要作用,并开展了大量相关研究工作。
为评估土壤生物群对土壤团聚的贡献,Lehmann等[14]对全球279个土壤生物群物种进行荟萃分析,研究发现土壤生物群对土壤团聚有显著积极影响,细菌和真菌通常较土壤动物对土壤团聚体的形成及稳定更重要;细菌对大团聚体和微团聚体的形成均有很强的影响,而真菌对大团聚体有很强的影响。细菌分泌的胞外聚合物(Extracellular polymeric substances,EPS)作为微米尺度的土壤黏合剂促进了微团聚体的形成及稳定,而真菌通过菌丝的缠绕和交联作用在微米到毫米尺度将微团聚体和土壤微粒聚集在一起形成大团聚体[15]。因此,通常认为真菌在大团聚体的形成及稳定中占主导地位,而细菌更有利于微团聚体的形成及稳定。深入理解微生物与土壤团聚体形成及稳定之间的关系,对阐明土壤质量变化过程及机制具有重要的理论意义。
2.1 微生物自身的物理特性 2.1.1 微生物通过自身静电相互作用连接土壤颗粒微生物细胞自身作为带有负电荷的胶体物质,可通过静电引力与土壤矿物颗粒相互连接。经典的胶体理论(Derjaguin-Landau-Verwey-Overbeek,DLVO)认为微生物的黏附过程是微生物与矿物颗粒间范德华作用力和静电作用力相互制约平衡的结果,即:GTOT(d)=GLW(d)+GEL(d),式中GTOT、GLW、GEL分别表示相互作用总能、范德华力能和静电力作用能,d为微生物与矿物颗粒的距离[16]。当微生物与矿物颗粒间的距离相近时,范德华力是控制微生物黏附的主导力;当两者距离较远时,范德华力迅速下降,此时静电力是促进微生物黏附的主导力。土壤黏粒矿物表面为大表面积的非晶形或晶形不好的硅、铝、铁氧化物或氢氧化物胶膜所覆盖,这些胶膜分布很多正电荷,因此带负电荷的微生物可通过静电作用与氧化物结合[17]。Huysman和Verstraete[18]的研究发现细菌对黏壤土的黏附力高于对砂土的黏附力,并且在二价离子存在时增加,这表明静电相互作用促进了细菌对黏土颗粒的黏附。附着在微团聚体或黏土颗粒上的微生物既可作为复合结构单元,也可作为形成团聚体的核[19]。具有静电引力的微生物细胞壁能够抵抗生物降解,即使菌体死亡后静电引力仍然存在,Miltner等[20]证明了微生物细胞壁残留物是形成微团聚体的核心物质之一。
2.1.2 菌丝网络的缠绕作用促使大团聚体形成及稳定除了微生物自身的静电吸附作用,真菌和放线菌的菌丝可以通过将土壤原生颗粒、有机质和微团聚体机械地缠绕起来形成大团聚体[21]。随着菌丝的伸长,小颗粒(尤其是黏土大小的颗粒)可以沿着生长的菌丝排列[22]。菌丝类似“掘进机”,随着其不断伸长会对相邻的土壤颗粒施加巨大压力,从而增强黏土颗粒和有机质之间的联系,并逐渐聚集成团[23]。Ji等[24]研究表明,无论在水分充足或干旱胁迫条件下,更大的菌丝长度均有助于土壤水稳定大团聚体的形成和稳定性。为揭示哪些性质或特征决定了真菌对土壤团聚的整体积极影响,Lehmann等[25]对31个真菌菌株(包括子囊菌门、担子菌门和毛霉菌门)的15个性状分别进行研究,研究结果确定菌丝生长的密度(积极影响)、亮氨酸氨肽酶活性(消极影响)和系统发育是解释真菌菌株之间造成土壤团聚体形成及稳定差异的重要因素。Fan等[26]总结了盆栽试验中菌根真菌种类与土壤团聚体稳定性存在的相关性,发现无论宿主植物和土壤质地如何,菌丝性状、长度和密度与土壤团聚体的稳定性均呈正相关,尤其是丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)的菌丝。因此,菌丝的性状、长度和密度与大团聚体的形成及稳定密切相关。
2.2 微生物胞外分泌物的黏合作用微生物可以通过分泌胞外物质(EPS、球囊霉素等)作为土壤颗粒之间重要的生物胶黏剂来促进团聚体的形成及稳定。一般而言,微生物胞外代谢活动被认为是土壤团聚体形成及稳定的主要驱动力[27]。
2.2.1 EPS驱动的土壤团聚体形成及稳定由多糖主导EPS是微生物在生长代谢过程中分泌到细胞外环境的高分子聚合物,主要由多糖、蛋白质、腐殖质和DNA等组成[28]。微生物分泌的EPS通过促进土壤颗粒黏附、菌群建立和细胞-颗粒结合对土壤团聚体的形成及稳定产生积极影响。菌株类型、底物可利用性、环境条件、生长阶段等均会影响微生物EPS的产生和化学组成[29]。不同菌株促进土壤团聚的能力差异主要取决于其产生的EPS组成成分。多糖是EPS中研究最多的基质组分,其可以促进土壤水稳性大团聚体的形成及稳定,常见的微生物胞外多糖组成如表 1所示。作为瞬时结合剂,多糖较其他任何有机物质都更容易被矿物颗粒所接近,这可能有利于团聚体的形成[31]。多糖含有多种有机官能团(羟基、羧基、氨基等),不仅能通过氢键或离子键吸附到黏土矿物表面,充当结合土壤颗粒的“桥梁”,还可以作为黏合剂将土壤颗粒结合成团聚体[23]。Tisdall和Oades[5]在1982年即发现EPS-多糖是土壤中最重要的瞬时结合剂。Puget等[32]的研究结果表明,EPS-多糖对微团聚体(< 50 μm)的形成及稳定十分重要。Ghasemzadeh等[33]研究表明慢生根瘤菌菌株(Bradyrhizobium strain)分泌的EPS-多糖提高了土壤团聚体稳定性。Sher等[34]研究发现柳枝稷(Panicum virgatum)的栽培可以通过促进微生物分泌EPS-多糖来增强土壤团聚体的形成及稳定。
EPS-蛋白主要由位于细胞膜中的水解酶、氧化酶、异构酶或功能性蛋白组成,其中的水解酶可以加速土壤有机碳的水解或矿化,同时由于EPS-蛋白本身具有黏附特性,因此其对土壤团聚的影响是不确定的。EPS-腐殖质主要是指一些具有复杂结构的顽固次级代谢产物(抗生素、生物碱、黑色素等),一方面这些物质不利于微生物之间的相互合作,另一方面也可以作为胶黏剂促进团聚,因此其对土壤团聚的影响也是不确定的[35]。Li等[36]研究了两种腐生真菌(Mortierella和Chaetomium)对土壤团聚的作用,结果发现两种真菌均能有效促进大团聚体的形成,其分泌产生的糖醛酸(EPS-多糖组分)对土壤团聚有显著的积极作用,而EPS-蛋白和EPS-腐殖质对土壤团聚的影响是不确定的。Jiang等[37]研究发现草酸青霉(Penicillium oxalicum)分泌的EPS可以促进土壤团聚体的形成及稳定。Cheng等[38]分离纯化出两株高产EPS细菌(Pseudomonas chlororaphis A20和Bacillus proteolyticus A27)并研究其对土壤团聚体形成的影响,结果发现这两株细菌可显著提高土壤水稳性大团聚体占比128%~169%。因此,分泌EPS的微生物对土壤团聚体的形成及稳定具有重要意义。
2.2.2 AMF分泌的球囊霉素具有类似“全能胶水”的胶黏能力由AMF分泌的球囊霉素被认为同样具有与EPS类似的土壤颗粒黏合作用。球囊霉素是一种具有特殊结构的良好热稳性糖蛋白,拥有类似于“全能胶水”的胶黏能力,其在土壤团聚体的形成及稳定、土壤固碳以及植物抗逆中发挥重要作用[39-40]。球囊霉素促进土壤团聚体形成及稳定的机制可以概括为:(1)胶结土壤矿物颗粒及微团聚体并填充其内部;(2)刺激微生物产生EPS-多糖进一步形成和稳定微团聚体[41]。由于缺少直接提取球囊霉素的技术方法,因此在相关研究中人们使用球囊霉素相关土壤蛋白(Glomalin-related soil protein,GRSP)来指代土壤中的球囊霉素。Wright和Upadhyaya[42]提出的柠檬酸钠高温提取法是目前应用最广泛的GRSP提取方法,进一步按照提取方法的不同,可以分为易提取GRSP(EE-GRSP)、难提取GRSP(DE-GRSP)和总GRSP(T-GRSP)。气候、生物和土壤因素均会影响AMF的GRSP生产与释放(图 3)。维持土壤团聚体稳定是GRSP最关键的功能之一[43]。在AMF介导1~2 mm大小土壤团聚体形成及稳定的过程中,GRSP的黏合作用较菌丝的直接作用更强[44]。Ji等[24]研究发现EE-GRSP和T-GRSP浓度均对水稳性大团聚体及平均重量直径(Mean weight diameter,MWD)呈现显著正相关。Liu等[45]的研究结果表明GRSP的快速积累过程与大团聚体的形成、微团聚体的减少和MWD的快速增加同时发生。Zhou等[46]研究表明MWD和几何平均直径(Geometric mean diameter,GMD)与EE-GRSP和T-GRSP呈正相关,并发现T-GRSP是城市森林土壤团聚体稳定性最重要的驱动因素,尤其是小团聚体(0.25~2 mm)中的T-GRSP。Lu等[47]研究发现EE-GRSP是影响玉米根际土壤团聚体稳定性和大团聚体形成的主要因素。总体而言,关于GRSP在土壤团聚体形成及稳定中起重要作用的结论是一致的,但对于每种团聚体大小的确切影响取决于许多影响因素,如AMF种类、寄主植物和环境因素等[48]。
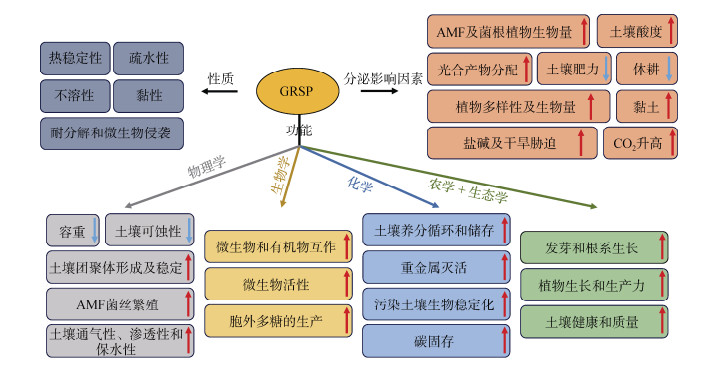
|
图 3 球囊霉素相关土壤蛋白(GRSP)的功能、性质及其分泌影响因素概述(据Agnihotri等[40]修改) Fig. 3 An overview of glomalin-related soil proteins(GRSP)functions, properties and factors affecting its secretion(modified from Agnihotri et al.[40]) |
分泌EPS及GRSP的土壤微生物具有巨大应用前景,提高微生物胞外分泌物产量和优化分泌物结构是增加土壤团聚及改善土壤结构的重要手段之一。
2.3 微生物对土壤有机质的分解作用土壤有机质增强了矿物结构性及微团聚体的胶结作用,同时团聚体的形成及稳定也为土壤有机质提供了物理保护,进而有助于土壤碳固存。颗粒和可溶性有机质进入土壤后的转化过程离不开微生物的分解代谢作用,经微生物分解作用后形成的高腐殖化初级颗粒是促进土壤团聚体形成及稳定的重要因素[49]。因此微生物的碳利用效率越高,越有利于土壤团聚体的形成及稳定[50]。Rabbi等[51]的研究结果证明有机质的微生物分解推动了土壤团聚体的形成及稳定。最近,Rabbi等[52]通过比较葡萄糖(快速分解)或纤维素(缓慢分解)处理的土壤中微生物、细胞外代谢物浓度和团聚体组成的变化,发现葡萄糖处理的土壤大团聚体中海藻糖、龙胆二糖、果糖、柠檬酸、半乳糖酸、甘露醇和半乳糖醇的浓度显著高于纤维素处理的土壤(P < 0.0001),纤维素处理的大团聚体中仅约17%的碳来源于微生物,而葡萄糖处理大团聚体中有57%的微生物源碳,葡萄糖处理的大团聚体占比高于纤维素处理,这些结果证明了微生物对有机物的快速分解促进了团聚体形成及稳定。总体而言,在微生物的分解代谢作用下,有机质分解产生的稳定高分子聚合有机酸促使有机无机复合体的形成,进一步与其他土壤颗粒结合形成微团聚体和大团聚体,从而促进了团聚体的形成及稳定(图 4)。
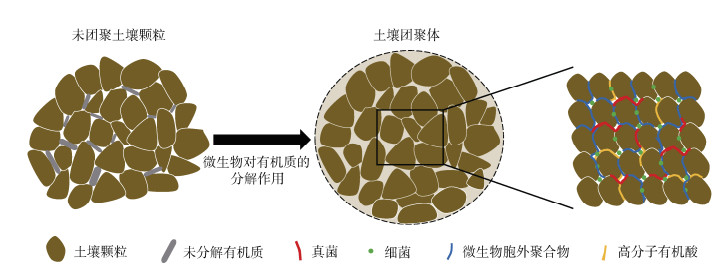
|
图 4 土壤团聚的生物物理机制 Fig. 4 Biophysical mechanisms of aggregation in soil |
土壤承载了约50%的全球动物生物量,在生物地球化学模型中土壤微生物被认为是生态系统功能的重要驱动因素,而土壤动物的作用往往被忽视[53]。土壤动物的存在、多样性和活动是团聚体形成及稳定的重要因素之一[6]。土壤动物群可通过自身生物扰动作用和摄食作用来驱动团聚体的形成及稳定。由于试验取样和分析手段的局限性,探究土壤动物如何驱动团聚体的形成及稳定仍然是土壤科学中的一个较大的挑战。
3.1 动物生物扰动作用生物扰动被定义为生物对土壤或沉积物的生物改造,其核心是土壤生物产生土壤生物结构(生物团聚体及孔隙)的能力,进而影响关键的生态系统功能[54-55]。目前大多数相关研究文献聚焦在土壤大型动物蚯蚓上,蚯蚓的生物扰动有助于土壤调节和演变,尤其是在温带生态系统中[56-58]。蚯蚓一直被认为是土壤团聚和有机质稳定的重要参与者和评估土壤质量的重要指标。根据生境类型和取食行为的差异,可将蚯蚓划分为以下三类:(1)表栖类蚯蚓(Epigeic),其作为觅食者生活在土壤表层,以枯枝落叶或动物粪便为食,很少钻入深层土壤,因此对矿质土壤结构影响不大;(2)内栖类蚯蚓(Endogeic),其主要生活在距离土壤表层10~15 cm处,通过摄入土壤和有机物的混合物来获得营养,对土壤结构有重要影响;(3)深栖类蚯蚓(Anecic),其生活在土壤深处的永久性或半永久性垂直洞穴中,通过将土壤表层的腐烂有机残留物拖入深层洞穴后取食,对土壤结构及养分循环均有重要作用[59]。崔莹莹等[60]研究了不同生态类型蚯蚓对土壤结构的影响,结果发现内栖类的南美岸蚓(Pontoscolex corethrurus)和壮伟远盲蚓(Amynthas robustus)以及深栖类的参状远盲蚓(Amynthas aspergillum)的添加均显著增加了2种土壤(赤红壤和红壤)中的大团聚体(d > 2 mm)比例(P < 0.05)。张香凝等[61]将介于表栖类和内栖类之间的威廉腔环蚓(Metaphire guillelmi)接种于信阳有机茶园土壤中,发现蚯蚓活动能提升大团聚体比例,促进土壤的黏砂粒向微团聚体转变。
蚯蚓生物扰动会产生两种土壤生物结构,即洞穴和粪便。洞穴是蚯蚓通过蠕动挖掘将土壤推至一边而产生的,洞穴结构的垂直及分支程度取决于蚯蚓的种类;粪便则是蚯蚓通过摄入土壤和有机物后排泄而产生的,其为卵圆形或球形颗粒;这两种生物结构对土壤团聚、孔隙度和水力特性均有影响[56]。产生的蚯蚓洞穴可通过增强土壤气体交换、水分渗透和植物根系生长等来促进土壤团聚体的形成及稳定[62]。蚯蚓粪便是一种天然水稳性团聚体,其有机质含量高于一般土壤且富含多糖,因此可以促进微团聚体到大团聚体的过程[63]。此外,当蚯蚓在土壤中挖掘洞穴时,会分泌皮肤黏液作为润滑剂。这些富含营养(碳水化合物、蛋白质、多糖、脂类)的黏液一方面被土壤微生物分解代谢,另一方面其中的有机聚合物质与土壤矿物颗粒结合形成团聚体[9]。黏液中存在的大量疏水性聚合物有助于在固体表面的高保留率,同时它们能够结合颗粒并黏贴表面,因此显著稳定了蚯蚓形成的土壤团聚体[64]。Guhra等[65]研究发现在团聚体的形成过程中,蚯蚓皮肤黏液作为桥接剂通过表面修饰和吸引力促进团聚,或作为黏合剂在外力引起土壤颗粒接近后介导团聚体的形成及稳定。
Guhra等[9]研究表明蚯蚓皮肤黏液成分对土壤矿物质的特异性吸附导致了黏液-矿物结合的形成,蚯蚓皮肤黏液的化学组成、吸附行为和形成有机无机复合体的能力与早期稳定期分泌的微生物EPS相似。微生物EPS的产量和组成取决于菌株生长阶段和各种环境条件[28]。相比之下,蚯蚓皮肤黏液组成更加均匀稳定,并且由于蚯蚓活跃的土壤处理作用,其是土壤中更容易获得和广泛分布的生物有机质来源。因此这可能表明蚯蚓黏液在有机无机复合体甚至更大团聚体的形成及稳定中起到比微生物EPS更加重要的作用。
在许多热带环境中,土壤生物扰动主要是由白蚁进行的[55]。白蚁生物扰动也会产生两种土壤生物结构,即巢穴和“土壤薄片(Soil sheeting)”。由于其体积大、结构复杂以及具有特定土壤物理、化学和生物特性,白蚁巢穴是热带生态系统最显著的特征之一[66]。此外,白蚁还可以产生所谓的“土壤薄片”结构,与蚯蚓粪便类似,也是一种天然水稳性团聚体。在一些热带生态系统中,土壤薄片每年每公顷产量可达数吨,这与温带和热带地区的蚯蚓粪便产量相当[67,58]。白蚁和蚂蚁等群居土壤动物只会改变局部土壤结构,而非群居蚯蚓的土壤生物扰动更加广泛和不受束缚。总体而言,目前对于土壤中大型动物通过生物扰动作用驱动团聚体形成及稳定的相关研究仅集中于部分典型土壤生物(蚯蚓、白蚁和蚂蚁等),而其他种类动物的生物扰动作用机制仍然缺乏系统研究。
3.2 动物摄食作用除了中大型土壤动物的生物扰动作用外,中小型土壤动物的摄食作用对土壤团聚体的形成及稳定同样起着关键的作用[68]。土壤中小型动物通过摄食植物根系和微生物,一方面排泄或分泌黏液,另一方面调控微食物网,以此来促进团聚体的形成及稳定(图 5)。作为土壤食物网的重要组成部分,线虫在所有土壤过程和生态系统功能中均具有重要作用[69]。食细菌性、食真菌性、杂食性和掠食性线虫构成了土壤微食物网的中心枢纽,它们可以通过向土壤排泄有机物来直接促进,也可以通过改变微生物群落多样性和结构来间接促进团聚体的形成。Jiang等[70]研究表明土壤线虫和原生动物通过摄食对特定细菌种群产生了积极影响,增加了群落多样性和稳定性,调控改善了碳和氮代谢相关基因,从而间接驱动了土壤团聚体的形成及稳定。动物不同摄食习性会对土壤结构产生不同影响,目前相关研究仍然较少,未来应重点关注土壤动物不同摄食习性促进团聚体形成的作用机制。
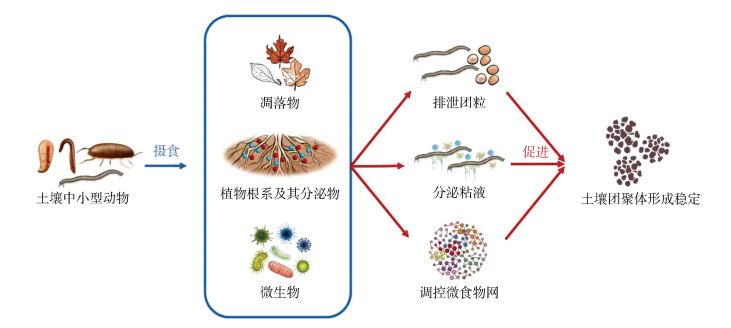
|
图 5 动物摄食促进土壤团聚体形成及稳定机制 Fig. 5 Mechanisms of soil aggregates formation and stability promoted by animal feeding |
鉴于土壤生物群在驱动团聚体形成及稳定过程中的重要作用,利用土壤生物及其产物来增加团聚体稳定性和改善土壤结构的手段正在引起科研人员的浓厚兴趣。
4.1 促团功能生物研发应用将有益生物接种至土壤中可以提高肥力和植物生产力并修复污染,从而减少合成化学品的施用,是未来实现农业和生态可持续发展的重要手段[71-72]。通过直接接种生物促进土壤团聚体形成及稳定的研究汇总见表 2所示,相关研究工作主要集中于我国。总体而言,在不同类型、酸碱度和养分的土壤中接种促团功能生物均可有效改善土壤结构,微生物各种类作结构改良剂的研究结果相对全面,但对于动物而言仅有蚯蚓被接种于土壤的研究案例。因此,未来应进一步探索其他土壤动物类群作结构改良剂的潜力。此外,目前的研究均为室内土培或盆栽试验,对于田间改良效果的评估及优化将是未来工作重点。尽管通过直接接种生物促进土壤团聚体形成及稳定已初具应用前景,但仍有许多困难与挑战。应用的生物接种剂必须与本土生物竞争,使其无法达到预期改良效果,同时也可能对本土生物群及其发挥的生态系统功能造成负面影响[77]。相较于接种单一生物,合成群落(SynComs)可以提供更强的抗胁迫能力,并提高自身在与本土生物竞争中的生存能力,使其能持续存在并发挥预期改良效果。微生态学和合成生物学的发展与应用将会在未来助力生物土壤结构改良剂的研发。
|
|
表 2 直接接种生物促进土壤团聚试验总结 Table 2 Summary of experiments on promoting soil aggregation by direct inoculation of organisms |
与直接接种促团功能生物相比,添加生物促团功能代谢产物来改良土壤是一种更稳定、高效且环保的方法。EPS作为微生物的重要产物已被广泛应用于原水处理、废水处理、渗滤液处理和污泥管理中[78],但其在土壤中的应用研究仍然十分有限。有研究表明,添加黄原胶可以稳定土壤结构,使其免受干湿循环的破坏作用[79]。Rosenzweig等[80]通过添加黄原胶以改良两种砂质土壤的持水能力,结果表明添加 > 1%的黄原胶可显著增加土壤的持水能力以及土壤孔隙度。总体而言,通过在土壤中添加EPS来促进团聚体的形成及稳定具有巨大的应用潜力。EPS有限的产量仍然是其被广泛应用的主要限制因素,目前提高EPS产量的策略包括非生物胁迫诱导、培养优化和代谢工程[81-82]。因此,未来需要对EPS的化学特性、成分、功能特性以及生产和回收的最佳条件等方面进行深入的研究。
蚯蚓粪便作为一种无污染、可持续和高效的有机肥料,在农业生产中得到了广泛的应用[83]。蚓粪中含有丰富的腐殖质,有利于土壤团聚体的形成[84]。Li等[85]研究施用蚓粪对黄土高原典型土壤团聚体的影响,发现蚓粪的添加可显著增加 > 0.25 mm的土壤团聚体比例,且使得MWD增加20.8%~56.6%,显著提高了土壤团聚体的水稳定性。除蚓粪之外,目前还未有其他土壤动物产物作土壤结构改良剂的报道研究出现,未来也应进一步探究更多土壤动物产物的应用潜力。
4.3 本土有益生物活性的生物刺激剂研发应用本地生物较外源培养生物更能适应自然环境,因此本地有益生物在促进团聚体形成及稳定方面具有巨大开发潜力。生物刺激是对原生土壤环境的改变,通过添加合适的营养物质改良增强本地生物的代谢活性[86]。利用生物刺激法的微生物诱导碳酸盐沉淀(Microbially induced carbonate precipitation,MICP)技术在岩土工程领域得到了广泛的研究与应用[87-89],但在农业土壤中施用生物刺激剂提高本地生物活性的相关研究仍然十分缺乏。因此,未来有必要开展利用生物刺激剂促进团聚体形成及稳定的应用研究。选择何种适宜的生物刺激剂将是研究的重点,常见的生物刺激剂有:酵母提取物、甘蔗糖蜜、醋酸钠和葡萄糖等[87]。本课题组前期研究发现与葡萄糖相比,厨余好氧水解液提高了不同生物过程的污水处理效率[90-91];进一步通过土壤培养试验发现,厨余好氧水解液可在短期内快速提升土壤微生物总量和团聚体的稳定性,这初步证明了其作为土壤生物刺激剂的可行性。施用本土有益生物活性的生物刺激剂有望成为未来改良土壤结构的重要手段之一。
5 结论与展望土壤团聚体是土壤肥力最重要特征之一,改善土壤结构可以提高养分循环、水的有效性和生物多样性,同时减少水和风的侵蚀。土壤生物群被认为是生态系统的工程师,其在土壤渗透、物质转移及有机质供应过程中主动和被动地影响土壤结构。本文综述了微生物通过自身物理特性、分泌物黏合作用和对有机质分解作用以及动物通过生物扰动作用和摄食作用来介导土壤团聚体的形成及稳定。尽管在土壤生物(微生物和动物)驱动的土壤团聚体形成过程和稳定机制方面已取得了丰硕成果,为改善提升土壤结构提供了理论参考,但由于土壤系统的复杂多相性以及试验取样和分析手段的局限性,现有研究在多尺度界面过程上对土壤生物驱动的团聚体形成及稳定机制仍然缺乏深入研究。因此,未来相关研究应重点关注以下几个方面:
1)多尺度界面过程上土壤生物驱动的土壤团聚体形成过程及稳定机制。综合土壤学和生物学最新的研究技术与方法(如同步辐射X射线吸收谱、近红外光谱、纳米二次离子质谱、微流控芯片、稳定同位素探针、基因组学、转录组学、蛋白质组学、代谢组学和机器学习模型等),监测分析多界面上生物介导的矿物颗粒和有机质耦合团聚过程,明确土壤生物群在调控土壤结构中的贡献及其作用机理,从而进一步理解和揭示多尺度(宏观、介观和微观)上土壤团聚体的形成及稳定机制。
2)微生物EPS和GRSP组成结构与遗传调控机制。EPS和GRSP作为重要的土壤生物胶黏剂,对其组成结构和遗传调控机制的研究还不够深入,因此需要进一步阐明其生物合成和调控相关分子机制。此外,EPS和GRSP传统的提取方法需要重新审视并进行优化,对其特异性提取与精准分析可以更好的理解在团聚体形成及稳定过程中的作用机制。
3)土壤古菌和病毒对团聚体形成及稳定的影响机制。土壤古菌在促进植物生长、缓解非生物胁迫和修复污染等方面拥有巨大潜力,土壤病毒在调控微生物群落组成、生物进化和养分循环等过程中起关键作用。近年来,对土壤细菌和真菌驱动的团聚体形成机制研究已较为普遍,但对于同为微生物的土壤古菌和病毒在团聚体形成及稳定过程中的影响机制研究仍然十分有限。
4)土壤食物网介导的团聚体形成过程及稳定机制。土壤微生物与土壤动物多样化的生存策略、摄食行为和生态功能,构成了多种捕食、竞争及协同等相互作用关系,进而形成了复杂的土壤食物网。以往的研究大多仅单一关注微生物或动物在土壤团聚体形成及稳定中的作用,而复杂且高度结构化的土壤食物网对团聚体形成及稳定的作用机制仍缺乏深入的研究。此外,目前对大型动物(如蚯蚓)驱动的团聚体形成过程研究已较为充分,但中小型动物作用机制仍不明确。
5)生物土壤结构改良剂的开发与应用。一方面可通过添加合适有机物料刺激本地生物群的丰度及活性,从而促进团聚体的形成及稳定;另一方面,通过直接添加高效促团的微生物和动物制剂达到改良土壤结构的效果。基于生态学和合成生物学理论,定向构建高产EPS的合成生物群落,可实现土壤结构及肥力的精准调控。
| [1] |
Pereira P, Bogunovic I, Muñoz-Rojas M, et al. Soil ecosystem services, sustainability, valuation and management[J]. Current Opinion in Environmental Science & Health, 2018, 5: 7-13.
(  0) 0) |
| [2] |
Rabot E, Wiesmeier M, Schlüter S, et al. Soil structure as an indicator of soil functions: A review[J]. Geoderma, 2018, 314: 122-137. DOI:10.1016/j.geoderma.2017.11.009
(  0) 0) |
| [3] |
Vogel H J, Balseiro-Romero M, Kravchenko A, et al. A holistic perspective on soil architecture is needed as a key to soil functions[J]. European Journal of Soil Science, 2022, 73(1): e13152. DOI:10.1111/ejss.13152
(  0) 0) |
| [4] |
Wang D Y, Lin J Y, Sayre J M, et al. Compost amendment maintains soil structure and carbon storage by increasing available carbon and microbial biomass in agricultural soil–A six-year field study[J]. Geoderma, 2022, 427: 116117. DOI:10.1016/j.geoderma.2022.116117
(  0) 0) |
| [5] |
Tisdall J M, Oades J M. Organic matter and water-stable aggregates in soils[J]. European Journal of Soil Science, 1982, 33(2): 141-163. DOI:10.1111/j.1365-2389.1982.tb01755.x
(  0) 0) |
| [6] |
Six J, Bossuyt H, Degryze S, et al. A history of research on the link between (micro) aggregates, soil biota, and soil organic matter dynamics[J]. Soil & Tillage Research, 2004, 79(1): 7-31.
(  0) 0) |
| [7] |
Hartmann M, Six J. Soil structure and microbiome functions in agroecosystems[J]. Nature Reviews Earth & Environment, 2023, 4: 4-18.
(  0) 0) |
| [8] |
Philippot L, Chenu C, Kappler A, et al. The interplay between microbial communities and soil properties[J]. Nature Reviews Microbiology, 2024, 22(4): 226-239. DOI:10.1038/s41579-023-00980-5
(  0) 0) |
| [9] |
Guhra T, Stolze K, Schweizer S, et al. Earthworm mucus contributes to the formation of organo-mineral associations in soil[J]. Soil Biology & Biochemistry, 2020, 145: 107785.
(  0) 0) |
| [10] |
Lavelle P, Spain A, Fonte S, et al. Soil aggregation, ecosystem engineers and the C cycle[J]. Acta Oecologica, 2020, 105: 103561. DOI:10.1016/j.actao.2020.103561
(  0) 0) |
| [11] |
Coban O, de Deyn G B, van der Ploeg M. Soil microbiota as game-changers in restoration of degraded lands[J]. Science, 2022, 375(6584): abe0725. DOI:10.1126/science.abe0725
(  0) 0) |
| [12] |
Guggenberger G, Elliott E T, Frey S D, et al. Microbial contributions to the aggregation of a cultivated grassland soil amended with starch[J]. Soil Biology & Biochemistry, 1999, 31(3): 407-419.
(  0) 0) |
| [13] |
Martin J P. Microorganisms and soil aggregation: Ⅰ. Origin and nature of some of the aggregating substances[J]. Soil Science, 1945, 59(2): 163-174. DOI:10.1097/00010694-194502000-00006
(  0) 0) |
| [14] |
Lehmann A, Zheng W S, Rillig M C. Soil biota contributions to soil aggregation[J]. Nature Ecology & Evolution, 2017, 1(12): 1828-1835.
(  0) 0) |
| [15] |
Olagoke F K, Bettermann A, Nguyen P T B, et al. Importance of substrate quality and clay content on microbial extracellular polymeric substances production and aggregate stability in soils[J]. Biology and Fertility of Soils, 2022, 58(4): 435-457. DOI:10.1007/s00374-022-01632-1
(  0) 0) |
| [16] |
Hermansson M. The DLVO theory in microbial adhesion[J]. Colloids and Surfaces B: Biointerfaces, 1999, 14(1/2/3/4): 105-119.
(  0) 0) |
| [17] |
Wei C F, Xie D T, Li B G. Progress in resaerch on soil organo-mineral complexes (In Chinese)[J]. Advance in Earth Sciences, 2003, 18(2): 221-227. [魏朝富, 谢德体, 李保国. 土壤有机无机复合体的研究进展[J]. 地球科学进展, 2003, 18(2): 221-227.]
(  0) 0) |
| [18] |
Huysman F, Verstraete W. Effect of cell surface characteristics on the adhesion of bacteria to soil particles[J]. Biology and Fertility of Soils, 1993, 16(1): 21-26. DOI:10.1007/BF00336510
(  0) 0) |
| [19] |
Liu Y L, Wang P, Wang J K. Formation and stability mechanism of soil aggregates: Progress and prospect (In Chinese)[J]. Acta Pedologica Sinica, 2023, 60(3): 627-643. DOI:10.11766/trxb202112180686 [刘亚龙, 王萍, 汪景宽. 土壤团聚体的形成和稳定机制: 研究进展与展望[J]. 土壤学报, 2023, 60(3): 627-643.]
(  0) 0) |
| [20] |
Miltner A, Bombach P, Schmidt-Brücken B, et al. SOM genesis: Microbial biomass as a significant source[J]. Biogeochemistry, 2012, 111(1): 41-55.
(  0) 0) |
| [21] |
Wang F, Zhang L, Zhou J C, et al. Exploring the secrets of hyphosphere of arbuscular mycorrhizal fungi: Processes and ecological functions[J]. Plant and Soil, 2022, 481(1): 1-22.
(  0) 0) |
| [22] |
Yang Y, Zhang Y E, Yu X X, et al. Soil microorganism regulated aggregate stability and rill erosion resistance under different land uses[J]. Catena, 2023, 228: 107176. DOI:10.1016/j.catena.2023.107176
(  0) 0) |
| [23] |
Xue S G, Qin X F, Jiang Y F, et al. Advances in microbe-driven ecological restoration on bauxite residue disposal areas[J]. Reviews of Environmental Contamination and Toxicology, 2024, 262(1): 3. DOI:10.1007/s44169-023-00056-8
(  0) 0) |
| [24] |
Ji L L, Tan W F, Chen X H. Arbuscular mycorrhizal mycelial networks and glomalin-related soil protein increase soil aggregation in Calcaric Regosol under well-watered and drought stress conditions[J]. Soil & Tillage Research, 2019, 185: 1-8.
(  0) 0) |
| [25] |
Lehmann A, Zheng W S, Ryo M, et al. Fungal traits important for soil aggregation[J]. Frontiers in Microbiology, 2020, 10: 2904. DOI:10.3389/fmicb.2019.02904
(  0) 0) |
| [26] |
Fan X X, Pan H Y, Ping Y, et al. The underlying mechanism of soil aggregate stability by fungi and related multiple factor: A review[J]. Eurasian Soil Science, 2022, 55(2): 242-250. DOI:10.1134/S1064229322020065
(  0) 0) |
| [27] |
Martinović T, Odriozola I, Mašínová T, et al. Temporal turnover of the soil microbiome composition is guild-specific[J]. Ecology Letters, 2021, 24(12): 2726-2738. DOI:10.1111/ele.13896
(  0) 0) |
| [28] |
Costa O Y A, Raaijmakers J M, Kuramae E E. Microbial extracellular polymeric substances: Ecological function and impact on soil aggregation[J]. Frontiers in Microbiology, 2018, 9: 1636. DOI:10.3389/fmicb.2018.01636
(  0) 0) |
| [29] |
Zhang M, Cai P, Wu Y C, et al. Bacterial extracellular polymeric substances: From the perspective of soil ecological functions (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(2): 308-323. DOI:10.11766/trxb202107310271 [张铭, 蔡鹏, 吴一超, 等. 细菌胞外聚合物: 基于土壤生态功能的视角[J]. 土壤学报, 2022, 59(2): 308-323.]
(  0) 0) |
| [30] |
Vandana, Das S. Genetic regulation, biosynthesis and applications of extracellular polysaccharides of the biofilm matrix of bacteria[J]. Carbohydrate Polymers, 2022, 291: 119536. DOI:10.1016/j.carbpol.2022.119536
(  0) 0) |
| [31] |
Kunmala P, Jindaluang W, Darunsontaya T. Distribution of organic carbon fractions in soil aggregates and their contribution to soil aggregate formation of paddy soils[J]. Communications in Soil Science and Plant Analysis, 2023, 54(10): 1350-1367. DOI:10.1080/00103624.2022.2144875
(  0) 0) |
| [32] |
Puget P, Angers D A, Chenu C. Nature of carbohydrates associated with water-stable aggregates of two cultivated soils[J]. Soil Biology & Biochemistry, 1998, 31(1): 55-63.
(  0) 0) |
| [33] |
Ghasemzadeh Z, Parhizkar M, Zomorodian M, et al. The role of extracellular polysaccharide produced by Bradyrhizobium strain in root growth, improvement of soil aggregate stability and reduction of soil detachment capacity[J]. Rhizosphere, 2023, 27: 100771. DOI:10.1016/j.rhisph.2023.100771
(  0) 0) |
| [34] |
Sher Y, Baker N R, Herman D, et al. Microbial extracellular polysaccharide production and aggregate stability controlled by switchgrass (Panicum virgatum) root biomass and soil water potential[J]. Soil Biology & Biochemistry, 2020, 143: 107742.
(  0) 0) |
| [35] |
Torres-Mendoza D, Ortega H E, Cubilla-Rios L. Patents on endophytic fungi related to secondary metabolites and biotransformation applications[J]. Journal of Fungi, 2020, 6(2): 58. DOI:10.3390/jof6020058
(  0) 0) |
| [36] |
Li F, Niu Y X, Zhang J B, et al. The grape string theory is inspired by Mortierella and Trichocladium species that promote soil aggregation more than indigenous microorganisms[J]. Geoderma, 2023, 435: 116524. DOI:10.1016/j.geoderma.2023.116524
(  0) 0) |
| [37] |
Jiang Y F, Chen L, Zhu F, et al. Stable aggregate formation and microbial diversity resilience in soil formation of bauxite residue: Roles of extracellular polymeric substances secreted by Penicillium oxalicum[J]. ACS ES&T Engineering, 2023, 3(11): 1758-1769.
(  0) 0) |
| [38] |
Cheng C, Shang-Guan W L, He L Y, et al. Effect of exopolysaccharide-producing bacteria on water-stable macro-aggregate formation in soil[J]. Geomicrobiology Journal, 2020, 37(8): 738-745. DOI:10.1080/01490451.2020.1764677
(  0) 0) |
| [39] |
Tan W F, Xu Y, Shi Z H, et al. The formation process and stabilization mechanism of soil aggregates driven by binding materials (In Chinese)[J]. Acta Pedologica Sinica, 2023, 60(5): 1297-1308. DOI:10.11766/trxb202308060312 [谭文峰, 许运, 史志华, 等. 胶结物质驱动的土壤团聚体形成过程与稳定机制[J]. 土壤学报, 2023, 60(5): 1297-1308.]
(  0) 0) |
| [40] |
Agnihotri R, Sharma M P, Prakash A, et al. Glycoproteins of arbuscular mycorrhiza for soil carbon sequestration: Review of mechanisms and controls[J]. Science of the Total Environment, 2022, 806: 150571. DOI:10.1016/j.scitotenv.2021.150571
(  0) 0) |
| [41] |
Wang G X, Wang P, Liu Y L, et al. Distribution characteristics and influencing factors of glomalin in soil aggregates: A meta-analysis (In Chinese)[J]. Acta Pedologica Sinica, 2024, 61(4): 1147-1155. DOI:10.11766/trxb202301170024 [王国禧, 王萍, 刘亚龙, 等. 球囊霉素在土壤团聚体中的分布特征及影响因素的Meta分析[J]. 土壤学报, 2024, 61(4): 1147-1155.]
(  0) 0) |
| [42] |
Wright S F, Upadhyaya A. A survey of soils for aggregate stability and glomalin, a glycoprotein produced by hyphae of arbuscular mycorrhizal fungi[J]. Plant and Soil, 1998, 198: 97-107. DOI:10.1023/A:1004347701584
(  0) 0) |
| [43] |
Holátko J, Brtnický M, Kučerík J, et al. Glomalin– Truths, myths, and the future of this elusive soil glycoprotein[J]. Soil Biology & Biochemistry, 2021, 153: 108116.
(  0) 0) |
| [44] |
Rillig M C, Wright S F, Eviner V T. The role of arbuscular mycorrhizal fungi and glomalin in soil aggregation: Comparing effects of five plant species[J]. Plant and Soil, 2002, 238(2): 325-333. DOI:10.1023/A:1014483303813
(  0) 0) |
| [45] |
Liu H F, Wang X K, Liang C T, et al. Glomalin-related soil protein affects soil aggregation and recovery of soil nutrient following natural revegetation on the Loess Plateau[J]. Geoderma, 2020, 357: 113921. DOI:10.1016/j.geoderma.2019.113921
(  0) 0) |
| [46] |
Zhou W, Sun X Y, Li S Y, et al. Effects of organic mulching on soil aggregate stability and aggregate binding agents in an urban forest in Beijing, China[J]. Journal of Forestry Research, 2022, 33(3): 1083-1094. DOI:10.1007/s11676-021-01402-z
(  0) 0) |
| [47] |
Lu M, Zhao J X, Lu Z R, et al. Maize–soybean intercropping increases soil nutrient availability and aggregate stability[J]. Plant and Soil, 2023. DOI:10.1007/s11104-023-06282-2
(  0) 0) |
| [48] |
Wang Q, Wang W J, Zhong Z L, et al. Variation in glomalin in soil profiles and its association with climatic conditions, shelterbelt characteristics, and soil properties in poplar shelterbelts of Northeast China[J]. Journal of Forestry Research, 2020, 31(1): 279-290. DOI:10.1007/s11676-019-00909-w
(  0) 0) |
| [49] |
Li F, Chen L, Li Y, et al. Research progress in the effect of fungi on soil aggregate formation (In Chinese)[J]. Journal of Henan Agricultural University, 2021, 55(5): 800—806, 905. [李芳, 陈林, 李月, 等. 真菌对土壤团聚体形成的影响研究进展[J]. 河南农业大学学报, 2021, 55(5): 800—806, 905.]
(  0) 0) |
| [50] |
Jiang M B, Wang X H, Liusui Y H, et al. Variation of soil aggregation and intra-aggregate carbon by long-term fertilization with aggregate formation in a grey desert soil[J]. Catena, 2017, 149: 437-445. DOI:10.1016/j.catena.2016.10.021
(  0) 0) |
| [51] |
Rabbi S M F, Minasny B, McBratney A B, et al. Microbial processing of organic matter drives stability and pore geometry of soil aggregates[J]. Geoderma, 2020, 360: 114033. DOI:10.1016/j.geoderma.2019.114033
(  0) 0) |
| [52] |
Rabbi S M F, Warren C R, Swarbrick B, et al. Microbial decomposition of organic matter and wetting–drying promotes aggregation in artificial soil but porosity increases only in wet-dry condition[J]. Geoderma, 2024, 447: 116924. DOI:10.1016/j.geoderma.2024.116924
(  0) 0) |
| [53] |
Flores O, Deckmyn G, Curiel Yuste J, et al. KEYLINK: Towards a more integrative soil representation for inclusion in ecosystem scale models-Ⅱ: Model description, implementation and testing[J]. PeerJ, 2021, 9: e10707. DOI:10.7717/peerj.10707
(  0) 0) |
| [54] |
Meysman F J R, Middelburg J J, Heip C H R. Bioturbation: A fresh look at Darwin's last idea[J]. Trends in Ecology & Evolution, 2006, 21(12): 688-695.
(  0) 0) |
| [55] |
Jouquet P, Harit A, Bottinelli N, et al. Termite bioturbation: Fungal versus non-fungal building strategies lead to different soil sheeting stability[J]. Soil Biology & Biochemistry, 2023, 176: 108868.
(  0) 0) |
| [56] |
Piron D, Boizard H, Heddadj D, et al. Indicators of earthworm bioturbation to improve visual assessment of soil structure[J]. Soil & Tillage Research, 2017, 173: 53-63.
(  0) 0) |
| [57] |
Le Mer G, Jouquet P, Capowiez Y, et al. Age matters: Dynamics of earthworm casts and burrows produced by the anecic Amynthas khami and their effects on soil water infiltration[J]. Geoderma, 2021, 382: 114709. DOI:10.1016/j.geoderma.2020.114709
(  0) 0) |
| [58] |
Bottinelli N, Maeght J L, Pham R D, et al. Anecic earthworms generate more topsoil than they contribute to erosion–Evidence at catchment scale in northern Vietnam[J]. Catena, 2021, 201: 105186. DOI:10.1016/j.catena.2021.105186
(  0) 0) |
| [59] |
Garcia-Franco N, Walter R, Wiesmeier M, et al. Biotic and abiotic controls on carbon storage in aggregates in calcareous alpine and prealpine grassland soils[J]. Biology and Fertility of Soils, 2021, 57(2): 203-218. DOI:10.1007/s00374-020-01518-0
(  0) 0) |
| [60] |
Cui Y Y, Wu J L, Zhang C, et al. Impacts of different ecological types of earthworm on aggregate distribution and stability in typical latosolic red and red soils (In Chinese)[J]. Journal of South China Agricultural University, 2020, 41(1): 83-90. [崔莹莹, 吴家龙, 张池, 等. 不同生态类型蚯蚓对赤红壤和红壤团聚体分布和稳定性的影响[J]. 华南农业大学学报, 2020, 41(1): 83-90.]
(  0) 0) |
| [61] |
Zhang X N, Shi F G, Li T K, et al. Soil structure and soil organic carbon distribution in organic tea plantation following earthworm inoculation (In Chinese)[J]. Acta Ecologica Sinica, 2024, 44(4): 1747-1754. [张香凝, 史福刚, 李太魁, 等. 接种蚯蚓对有机茶园土壤结构及有机碳库的影响[J]. 生态学报, 2024, 44(4): 1747-1754.]
(  0) 0) |
| [62] |
Schon N L, MacKay A D, Gray R A, et al. Influence of earthworm abundance and diversity on soil structure and the implications for soil services throughout the season[J]. Pedobiologia, 2017, 62: 41-47. DOI:10.1016/j.pedobi.2017.05.001
(  0) 0) |
| [63] |
Li Y P, Shao M A, Wang J. Effects of earthworm cast application rate on soil aggregates and aggregate-associated organic carbon distribution in typical soils from the loess areas (In Chinese)[J]. Transactions of the Chinese Society of Agricultural Engineering, 2021, 37(3): 90-98. [李彦霈, 邵明安, 王娇. 蚯蚓粪施用量对黄土区典型土壤团聚体及其有机碳分布的影响[J]. 农业工程学报, 2021, 37(3): 90-98.]
(  0) 0) |
| [64] |
Guhra T, Stolze K, Totsche K U. Pathways of biogenically excreted organic matter into soil aggregates[J]. Soil Biology & Biochemistry, 2022, 164: 108483.
(  0) 0) |
| [65] |
Guhra T, Wonneberger A, Stolze K, et al. The functional role of earthworm mucus during aggregation[J]. Journal of Plant Nutrition and Soil Science, 2024, 187(1): 63-76. DOI:10.1002/jpln.202300100
(  0) 0) |
| [66] |
Fagundes T M, Ordonez J C, Yaghoobian N. The role of mound functions and local environment in the diversity of termite mound structures[J]. Journal of Theoretical Biology, 2021, 527: 110823. DOI:10.1016/j.jtbi.2021.110823
(  0) 0) |
| [67] |
Rouland C, Lepage M, Chotte J L, et al. Experimental manipulation of termites (Isoptera, Macrotermitinae) foraging patterns in a Sahelo-Sudanese savanna: Effect of litter quality[J]. Insectes Sociaux, 2003, 50(4): 309-316. DOI:10.1007/s00040-003-0680-6
(  0) 0) |
| [68] |
Potapov A M, Beaulieu F, Birkhofer K, et al. Feeding habits and multifunctional classification of soil-associated consumers from protists to vertebrates[J]. Biological Reviews, 2022, 97(3): 1057-1117. DOI:10.1111/brv.12832
(  0) 0) |
| [69] |
Lazarova S, Coyne D, Rodríguez M G G, et al. Functional diversity of soil nematodes in relation to the impact of agriculture—A review[J]. Diversity, 2021, 13(2): 64. DOI:10.3390/d13020064
(  0) 0) |
| [70] |
Jiang Y J, Li S Z, Barnes A D, et al. Unraveling the importance of top-down predation on bacterial diversity at the soil aggregate level[J]. Geoderma, 2023, 439: 116658. DOI:10.1016/j.geoderma.2023.116658
(  0) 0) |
| [71] |
Poppeliers S W, Sánchez-Gil J J, de Jonge R. Microbes to support plant health: Understanding bioinoculant success in complex conditions[J]. Current Opinion in Microbiology, 2023, 73: 102286. DOI:10.1016/j.mib.2023.102286
(  0) 0) |
| [72] |
Jansson J K, McClure R, Egbert R G. Soil microbiome engineering for sustainability in a changing environment[J]. Nature Biotechnology, 2023, 41: 1716-1728. DOI:10.1038/s41587-023-01932-3
(  0) 0) |
| [73] |
Dar A, Ahmad Zahir Z, Iqbal M, et al. Efficacy of rhizobacterial exopolysaccharides in improving plant growth, physiology, and soil properties[J]. Environmental Monitoring and Assessment, 2021, 193(8): 515. DOI:10.1007/s10661-021-09286-6
(  0) 0) |
| [74] |
Wang X J, Li M Y, Wang W L, et al. Effect of single cell and filamentous microorganisms on formation of soil aggregates (In Chinese)[J]. Chinese Journal of Soil Science, 2021, 52(2): 355-360. [王小姣, 李梦雅, 王文丽, 等. 接种单细胞微生物对土壤团聚体形成及其稳定性的影响[J]. 土壤通报, 2021, 52(2): 355-360.]
(  0) 0) |
| [75] |
Zhang J X, Su L, Yan K, et al. An arbuscular mycorrhizal fungus increased the macroaggregate proportion and reduced cadmium leaching from polluted soil[J]. International Journal of Phytoremediation, 2021, 23(7): 684-692.
(  0) 0) |
| [76] |
Zhang Z C, Yang J Y, Hao B H, et al. Potential of arbuscular mycorrhizal fungi, biochar, and combined amendment on sandy soil improvement driven by microbial community (In Chinese)[J]. Environmental Science, 2021, 42(4): 2066-2079. [张哲超, 杨久扬, 郝百惠, 等. 微生物群落驱动AM真菌、生物炭及联合改良沙化土壤作用潜力[J]. 环境科学, 2021, 42(4): 2066-2079.]
(  0) 0) |
| [77] |
Mawarda P C, Le Roux X, van Elsas J D, et al. Deliberate introduction of invisible invaders: A critical appraisal of the impact of microbial inoculants on soil microbial communities[J]. Soil Biology & Biochemistry, 2020, 148: 107874.
(  0) 0) |
| [78] |
Siddharth T, Sridhar P, Vinila V, et al. Environmental applications of microbial extracellular polymeric substance (EPS): A review[J]. Journal of Environmental Management, 2021, 287: 112307. DOI:10.1016/j.jenvman.2021.112307
(  0) 0) |
| [79] |
Czarnes S, Hallett P D, Bengough A G, et al. Root- and microbial-derived mucilages affect soil structure and water transport[J]. European Journal of Soil Science, 2000, 51(3): 435-443. DOI:10.1046/j.1365-2389.2000.00327.x
(  0) 0) |
| [80] |
Rosenzweig R, Shavit U, Furman A. Water retention curves of biofilm-affected soils using xanthan as an analogue[J]. Soil Science Society of America Journal, 2012, 76(1): 61-69. DOI:10.2136/sssaj2011.0155
(  0) 0) |
| [81] |
Wei Z, Niu S, Wei Y, et al. The role of extracellular polymeric substances (EPS) in chemical-degradation of persistent organic pollutants in soil: A review[J]. Science of the Total Environment, 2024, 912: 168877. DOI:10.1016/j.scitotenv.2023.168877
(  0) 0) |
| [82] |
Garza-Rodríguez Z B, Hernández-Pérez J, Santacruz A, et al. Prospective on the application of abiotic stresses to enhance the industrial production of exopolysaccharides from microalgae[J]. Current Research in Biotechnology, 2022, 4: 439-444. DOI:10.1016/j.crbiot.2022.09.007
(  0) 0) |
| [83] |
Raza S T, Wu J P, Rene E R, et al. Reuse of agricultural wastes, manure, and biochar as an organic amendment: A review on its implications for vermicomposting technology[J]. Journal of Cleaner Production, 2022, 360: 132200. DOI:10.1016/j.jclepro.2022.132200
(  0) 0) |
| [84] |
Molina M J, Soriano M D, Ingelmo F, et al. Stabilisation of sewage sludge and vinasse bio-wastes by vermicomposting with rabbit manure using Eisenia fetida[J]. Bioresource Technology, 2013, 137: 88-97. DOI:10.1016/j.biortech.2013.03.029
(  0) 0) |
| [85] |
Li Y P, Wang J, Shao M A. Application of earthworm cast improves soil aggregation and aggregate-associated carbon stability in typical soils from Loess Plateau[J]. Journal of Environmental Management, 2021, 278: 111504. DOI:10.1016/j.jenvman.2020.111504
(  0) 0) |
| [86] |
Liu S Y, Sui Y J, Dong B W. Reinforcement of reclaimed sand by stimulating native microorganisms for biomineralization[J]. Frontiers in Bioengineering and Biotechnology, 2022, 10: 1050694. DOI:10.3389/fbioe.2022.1050694
(  0) 0) |
| [87] |
Amini Kiasari M, Pakbaz M S, Ghezelbash G R. Comparison of effects of different nutrients on stimulating indigenous soil bacteria for biocementation[J]. Journal of Materials in Civil Engineering, 2019, 31(6): 04019067. DOI:10.1061/(ASCE)MT.1943-5533.0002693
(  0) 0) |
| [88] |
Raveh-Amit H, Tsesarsky M. Biostimulation in desert soils for microbial-induced calcite precipitation[J]. Applied Sciences, 2020, 10(8): 2905. DOI:10.3390/app10082905
(  0) 0) |
| [89] |
Graddy C M R, Gomez M G, DeJong J T, et al. Native bacterial community convergence in augmented and stimulated ureolytic MICP biocementation[J]. Environmental Science & Technology, 2021, 55(15): 10784-10793.
(  0) 0) |
| [90] |
Gui X W, Li Z L, Wang Z J. Kitchen waste hydrolysate enhances sewage treatment efficiency with different biological process compared with glucose[J]. Bioresource Technology, 2021, 341: 125904. DOI:10.1016/j.biortech.2021.125904
(  0) 0) |
| [91] |
Gui X W, Wang Z J, Li K L, et al. Enhanced nitrogen removal in sewage treatment is achieved by using kitchen waste hydrolysate without a significant increase in nitrous oxide emissions[J]. Science of the Total Environment, 2024, 906: 167108. DOI:10.1016/j.scitotenv.2023.167108
(  0) 0) |
 2026, Vol. 63
2026, Vol. 63


