黄花菜(Hemerocallis citrina Baroni)属阿福花科,是中国重要的经济作物,其多种营养成分的含量高于常见种类的蔬菜,属于高蛋白、低热量并且富含维生素及矿物质的绿色保健蔬菜[1],目前已成为山西省大同市云州区的支柱产业。
植物生长延缓剂通过影响植物分生组织的分裂和伸长来调控作物生长发育,按照抑制赤霉素生物合成中的化学特性和作用阶段不同可分为三类:(1)鎓类化合物,如缩节胺和矮壮素等[2];(2)含碳杂环化合物,如多效唑和烯效唑等[3-4];(3)酰基环乙烷衍生物,如丁酰肼等[5]。使用植物生长延缓剂推迟作物花期是常规的农艺措施,其成本低且效果明显。研究表明,使用烯效唑(S3307)可增加叶片厚度和光合作用,提高抗旱性,还可提高可溶性糖和脯氨酸含量,缓解盐胁迫[6-7]。喷施多效唑(PP333)可降低植物株高,促进茎粗增长,增加产量[8-9]。烯效唑还可使水仙初花期延迟,花期延长,花朵直径增大[10]。喷施多效唑会延长芍药花瓣原基分化期[11],推进柠檬秋花的花芽分化进程[12]。本团队在前期研究中已证明植物生长延缓剂对黄花菜花期推迟效果明显[13],但延缓剂的施用可能影响根际微生物群落,进而改变土壤生态功能,如养分传递和能量循环、病害抑制和植物健康等[14-15],最终导致黄花菜品质和产量下降。
土壤微生物是维持土壤肥力的关键,是衡量土壤健康的重要指标[16],其新陈代谢活动会直接影响土壤的物质和能量循环。根际微生物主要通过影响植物根系形态、抗逆性等对植物的生长发育产生影响[17-18]。根际细菌可产生和降解吲哚乙酸(IAA),有利于根系的生长及土壤养分和水分的吸收[19]。不同作物主要通过根系分泌物、植物残渣和共生体控制土壤养分、碳元素输入及土壤结构,进而直接或间接地调控根际微生物群落结构[20]。土壤微生物的群落结构和组成是评价植物生长调节剂对土壤生态安全性的重要指标[14-15]。王超群[21]研究发现施用矮壮素会降低党参的土壤微生物多样性,影响物种组成结构。还有研究证明多效唑施用会降低土壤微生物的生物量,对土壤微生物的活性造成不利影响[15],土壤细菌的数量还会随多效唑浓度的增加呈线性降低趋势[22]。长期使用多效唑不仅会影响土壤微生物多样性,使土壤中细菌、真菌和放线菌数量降低,同时对土壤中脱氢酶活性和活菌丝长度产生负面影响[23]。虽已有部分研究,但关于植物生长延缓剂对黄花菜土壤中微生物影响的报道仍然存在不足,仍不清楚延缓剂对黄花菜种植土壤中微生物多样性的影响及延缓剂的使用安全性。
因此,本研究利用16S rRNA和内部转录间隔区(ITS)扩增子的建库测序技术,分析多效唑和烯效唑施用对黄花菜根际土壤微生物群落结构和多样性特征的影响,为评价植物生长延缓剂的使用安全性、建立科学高效的应用体系以及使用后期土壤的可持续发展提供科学依据,为农业生产过程中植物生长延缓剂的合理施用提供理论支撑。
1 材料与方法 1.1 田间试验本研究于2023年在山西省大同市云州区吉家庄乡(39°03′N,112°34′E)进行,选用两种植物生长延缓剂——烯效唑(S3307)和多效唑(PP333),试验共设3个处理:500 mg·L–1烯效唑和500 mg·L–1多效唑,以清水为对照,每处理3个重复。采用随机区组设计,每个地块与相邻地块之间隔开50 cm。从黄花菜抽薹(2023年6月20日)开始,每7天对黄花菜叶片喷施1次植物生长延缓剂,共施用4次。在黄花菜盛蕾期(2023年7月25日)通过五点取样法采集土壤:挖取黄花菜根系及土壤后通过抖落法收集根际土壤,过10目筛后液氮速冻并保存在–80 ℃下。土壤质地为黏壤土,pH 8.3,有机质15.0 g·kg–1,全氮1.15 g·kg–1,碱解氮29.4 mg·kg–1,有效磷10.77 mg·kg–1,速效钾178.4 mg·kg–1。
1.2 DNA提取按照文献[24]的方法对黄花菜土壤样本DNA进行提取:使用E.Z.N.A. Soil DNA Kit(Omega Bio-tek,Inc.,美国)试剂盒提取土壤样本基因组DNA后检测DNA质量和浓度并储存。
1.3 16 s rRNA和ITS基因扩增和测序按照文献[24]的方法对16s rRNA和ITS基因进行扩增和测序:真菌测序区为ITS1,PCR扩增引物为ITS1(5′-CTTGGTCATTTAGAGGAAGTAA-3’)/ITS2(5′-TGCGTTCTTCATCGATGC3′);扩增细菌16S rRNA基因的V3~V4区使用通用引物338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)。PCR产物使用NEB Next Ultra Ⅱ DNA Library PrepKit(New England Biolabs,Inc.,美国)建库试剂盒进行文库构建,在Illumina Miseq/Nextseq 2000/Novaseq 6000(Illumina,Inc.,美国)平台测序。
1.4 数据预处理和生物信息学分析按照参考文献[25]的方法对数据进行预处理和生物信息学分析,使用Vsearch v2.13.3软件uparse算法对优质序列进行可操作分类单元(OTU)聚类,将OTU代表序列与Silva138和Unite 8.2数据库进行比对,得到每个OTU对应的物种分类信息。再使用Mothur v1.48.0软件计算微生物α多样性(Chao1和香农Shannon指数),使用R(v3.6.0)的eshape2、ggplot2包进行分析和作图。方差分析采用SPSS Statistics 22.0软件调用邓肯(DUNCAN)新复极差法进行多重比较(P < 0.05)。
2 结果 2.1 不同植物生长延缓剂处理的土壤微生物α多样性指数表 1为不同植物生长延缓剂处理下黄花菜根际土壤的微生物α多样性指数。整体而言,植物生长延缓剂不影响黄花菜根际微生物的α多样性。土壤微生物群落的物种多样性和均匀性可通过香农指数和辛普森指数来反映,清水对照和延缓剂处理后的香农指数、辛普森指数无显著差异,说明延缓剂处理对土壤微生物群落的均匀性和多样性影响较小。
|
|
表 1 黄花菜土壤细菌和真菌群落多样性指数 Table 1 Diversity index of soil bacterial and fungal communities of Hemerocallis citrina |
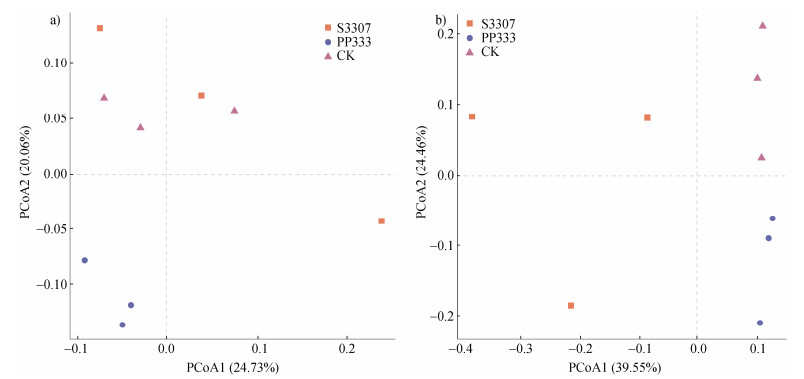
基于Bray-Curtis距离来进行主坐标分析(PCoA)。在细菌的PCoA图中,PCoA1解释了24.73%的方差,PCoA2解释了20.06%的方差(图 1a),各处理间距离较远且置换多元方差分析(PERMANOVA)P < 0.05(P=0.013),CK在PCoA2轴上为正值,与多效唑相反,表明3个处理间土壤细菌群落结构差异较大。在真菌的PCoA图中PERMANOVA的P < 0.05(P=0.001),PCoA1解释了39.55%的方差,PCoA2解释了24.46%的方差(图 1b)。
|
图 1 不同处理下黄花菜根际土壤细菌(a)、真菌(b)微生物群落主坐标分析(PCoA)(操作分类单元,OTU) Fig. 1 Principal coordinate analysis(PCoA)of bacterial(a)and fungal(b)microbial communities in the rhizosphere soil of Hemerocallis citrina under different treatments(operational taxonomic units level, OTU) |
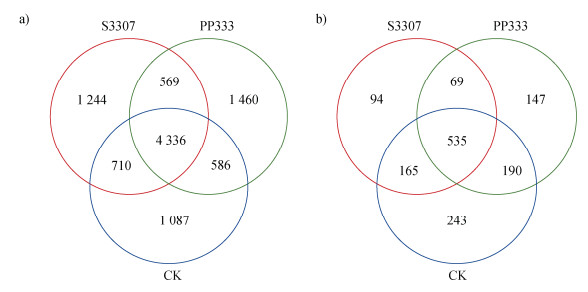
土壤细菌高通量测序共获得9 992个OTUs,其中清水对照、烯效唑和多效唑分别有6 719个、6 859个和6 951个OTUs(图 2a),3个处理共有的OTUs 4 336个(43.39%),特有OTUs比例分别为10.88%、12.45%和14.61%。土壤真菌高通量测序共获得1 443个OTUs,其中清水对照、烯效唑和多效唑分别有1 133个、863个和941个OTUs(图 2b),3个处理共有的OTUs535个(37.07%),特有OTUs比例分别为16.84%、6.51%和10.19%。在延缓剂处理后黄花菜根际特定微生物表现出一定差异。清水对照特有细菌种类最少(1 087种),但真菌种类最多(243种)。与对照相比,多效唑和烯效唑处理增加了细菌多样性,降低了真菌多样性。
|
图 2 不同处理下黄花菜根际土壤细菌(a)和真菌(b)OTUs韦恩图 Fig. 2 Venn diagrams of bacterial OTUs(a)and fungal OTUs(b)in the rhizosphere soil of Hemerocallis citrina under different treatments |
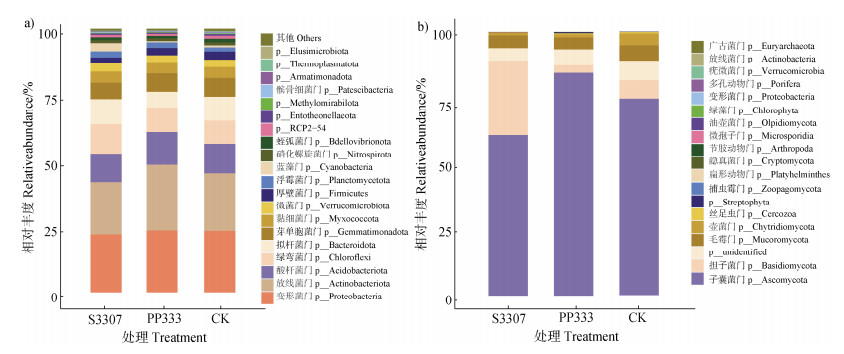
黄花菜根际土壤微生物群落结构层次明显,优势细菌门有变形菌门(Proteobacteria,CK:23.38%;S3307:22.03%;PP333:23.56%)、放线菌门(Actinobacteria,CK:21.79%;S3307:19.81%;PP333:24.87%)、酸杆菌门(Acidobacteria,CK:11.25%;S3307:10.78%;PP333:12.49%),共占约52.64%~60.93%(图 3a),多效唑处理能增加变形菌门、放线菌门和酸杆菌门的相对丰度。除了优势细菌门之外,还有绿弯菌门(Chloroflexi,CK:8.75%;S3307:11.21%;PP333:9.28%)、拟杆菌门(Bacteroidota)、浮霉菌门(Planctomycetota)、厚壁菌门(Firmicutes)、微菌门(Verrucomicrobia)和芽单胞菌门(Gemmatimonadetes)也对延缓剂处理有一定程度的响应。
|
图 3 不同处理下黄花菜根际土壤细菌(a)和真菌(b)门水平群落组成 Fig. 3 Bacterial community composition(a)and fungal community composition(b)in the rhizosphere soil phylum of Hemerocallis citrina under different treatments |
黄花菜根际土壤的优势真菌门有子囊菌门(Ascomycota,CK:74.60%;S3307:61.02%;PP333:84.57%)和担子菌门(Basidiomycota,CK:7.00%;S3307:28.19%;PP333:2.90%),共占81.60%~89.21%(图 3b)。多效唑处理增加了子囊菌门的相对丰度,减少了担子菌门的相对丰度。而烯效唑处理结果与多效唑相反,烯效唑处理减少了子囊菌门的相对丰度,增加了担子菌门的相对丰度。
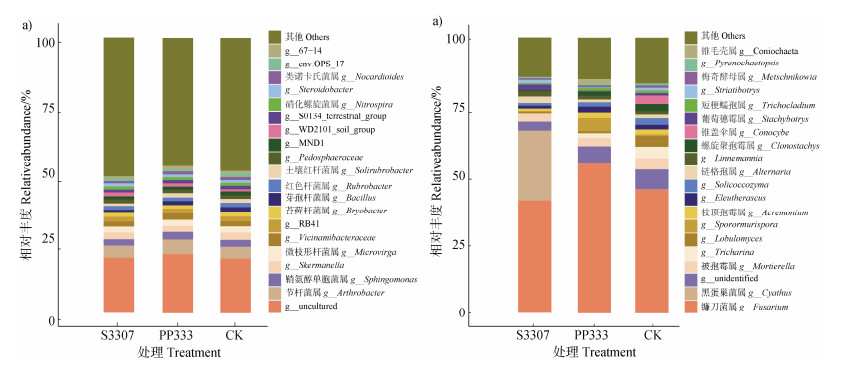
如图 4所示,在属水平上,各处理相对丰度排名前8位的细菌优势菌属主要有节杆菌属(Arthrobacter)、鞘氨醇单胞菌属(Sphingomonas)、Skermanella、微枝形杆菌属(Microvirga)、Vicinamibacteraceae、RB41、苔藓杆菌属(Bryobacter)、芽孢杆菌属(Bacillus)。各处理相对丰度排名较前的优势真菌菌属主要为镰刀菌属(Fusarium)、黑蛋巢菌属(Cyathus)、被孢霉属(Mortierella)、Tricharina、Lobulomyces、Sporormurispora等,多效唑处理后土壤黑蛋巢菌属的相对丰度增加明显,较对照显著增加25.13%。
|
图 4 不同处理下黄花菜根际土壤细菌(a)和真菌(b)属群落组成 Fig. 4 Bacterial community composition(a)and fungal community composition(b)in the rhizosphere soil genus of Hemerocallis citrina under different treatments |
利用线性判别分析(LEfSe)成功筛选到了显著性差异菌群(图 5),用于解释延缓剂引起的差异。土壤真菌共发现5个分类单元发生显著性改变,包括2个目(Microascales和Thelephorales)和3个科(Loboceae、Bionectriaceae和Microascaceae)。土壤细菌共有14个分类单元发生显著性改变,包括3个纲(Acidimicrobiia、Bdellovibrionia和Bacilli)、4个目(Propionibacteriales、Bacillales、Haliangiales和Tistrellales)、7个科(Nocardioidaceae、Bacillaceae和Haliangiaceae等)。
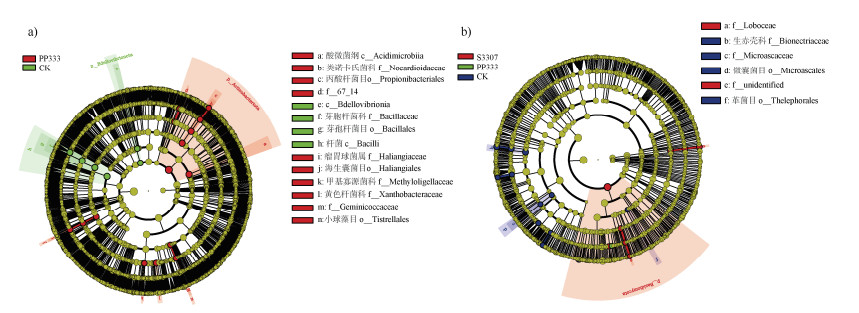
|
图 5 不同处理下细菌(a)和真菌(b)差异物种的分支 Fig. 5 Branches of bacterial differential species(a)and fungal differential species(b)under different treatments |
前人研究结果表明,植物生长延缓剂——多效唑可减少土壤微生物的生物量,对土壤微生物的活性造成负面影响[15]。不同剂量多效唑处理后的土壤微生物多样性会发生改变,细菌的数量随多效唑浓度的增加呈线性降低,微生物多样性指数则呈现先增加后降低的趋势[22]。长期使用多效唑会使芒果园土壤中的细菌(包括放线菌)、真菌数量降低,对土壤中脱氢酶活性和活菌丝长度也会产生负面影响[23]。本文研究结果发现,多效唑和烯效唑处理均增加了黄花菜根际土壤细菌数量,提高了黄花菜根际土壤细菌的总OTUs和特有OTUs数量,其中清水对照、烯效唑和多效唑分别有6 719个、6 859个和6 951个OTUs(图 2)。本研究结果与前人研究略有差异,这可能与延缓剂浓度和使用时间及方法有关,本研究中延缓剂喷施在植物叶片上且仅在一年中喷施了4次,并未形成长期效应。同时延缓剂处理降低了土壤真菌数量(图 2),任海英等[26]的研究也得到了相似的结果,高浓度多效唑处理杨梅后,根表土的细菌多样性和丰富度明显升高,真菌多样性和丰富度明显降低。
本研究在对细菌和真菌门水平分析发现,多效唑处理可增加变形菌门、放线菌门、酸杆菌门和子囊菌门的相对丰度(图 3),这与前人研究结果[26]一致;而烯效唑处理可增加担子菌门的相对丰度(图 3)。有报道指出变形菌门与土壤抗病性密切相关,可促进植物生长、固氮和提高土壤肥力,其丰度的提高有利于促进土壤养分循环[27-29],而酸杆菌门具有嗜酸性,在土壤中可驱动物质循环和生态环境的构建,均有改善土壤根际环境的作用。子囊菌门有较快的生长速度和利用营养物质的能力,在养分高的土壤中丰度高,有利于土壤营养物质循环,增加土壤中有机质含量[30-31]。担子菌门在土壤中具有分解木质纤维素、促进有机质的分解和转化的作用[32]。
对细菌属水平结构组成分析发现,多效唑处理下节杆菌属、鞘氨醇单胞菌属的相对丰度较清水对照分别增加了1.1%和0.2%(图 4)。陈舒婷等[33]研究表明,鞘氨醇单胞菌属可促进植物生长和抵御病菌侵染植物,其丰度提高可为促进植物生长发育提供有利环境,提高土壤中全磷的含量[34],增强植物抗逆能力。本研究中多效唑处理下土壤镰刀菌属的相对丰度较对照增加9.68%(图 4),镰刀菌属为致病菌,会引起萎蔫病和根腐病[35],说明多效唑处理下有提高镰刀菌属等病原菌相对丰度的风险。烯效唑处理后的镰刀菌属相对丰度略有降低,而黑蛋巢菌属的相对丰度增加明显,较对照增加25.13%(图 4)。多效唑和烯效唑的使用改变了黄花菜根际微生物群落结构,但对黄花菜抗病功能的影响尚需进一步深入研究。
4 结论本研究结果显示了植物生长延缓剂对黄花菜根际微生物群落的影响。多效唑和烯效唑处理可增加黄花菜根际土壤细菌的总OTUs和特有OTUs数量,但降低了真菌多样性。多效唑处理增加了变形菌门、放线菌门和酸杆菌门的相对丰度,同时也增加了真菌子囊菌门的相对丰度,而烯效唑处理则减少了子囊菌门的相对丰度,增加了担子菌门的相对丰度。研究结果为植物生长延缓剂的安全使用及土壤微生态调控提供了依据。
| [1] |
Li O, Sha Z W, Xu J. Advances in pharmacological effects of Hemerocallis fulva (In Chinese)[J]. Shanghai Journal of Traditional Chinese Medicine, 2018, 52(6): 99-101. [李欧, 沙中玮, 徐建. 萱草花药理作用研究进展[J]. 上海中医药杂志, 2018, 52(6): 99-101.]
(  0) 0) |
| [2] |
Wittwer S H, Tolbert N E. 2-chloroethyl trimethylammonium chloride and related compounds as plant growth substances. V. Growth, flowering, and fruiting responses as related to those induced by auxin and gibberellin[J]. Plant Physiology, 1960, 35(6): 871-877. DOI:10.1104/pp.35.6.871
(  0) 0) |
| [3] |
Izumi K, Kamiya Y, Sakurai A, et al. Studies of sites of action of a new plant growth retardant(E)-1-(4-chlorophenyl)-4, 4-dimethyl-2-(1, 2, 4-triazol-1-yl)-1-penten-3-ol(S-3307)and comparative effects of its stereoisomers in a cell-free system from Cucurbita maxima[J]. Plant and Cell Physiology, 1985, 26(5): 821-827.
(  0) 0) |
| [4] |
Lever B G. PP333 a new broad spectrum growth retardant[C]. British Crop Protection Conference-Weeds. British Cropr Potection Council, 1982, 1: 3—10.
(  0) 0) |
| [5] |
Zhang J. Study on effects and mechanism of PGRs on the growth of several flowers[D]. Taian, Shandong: Shandong Agricultural University, 2005.[张剑. 植物生长延缓剂对几种花卉生长的控制作用及机理研究[D]. 山东泰安: 山东农业大学, 2005.]
(  0) 0) |
| [6] |
Li N Y, Han X F, Song Y. Effect of the different concentrations of S3307 on photosynthesis and chlorophyll fluorescence parameters of Zinnia elegant seedling under high temperature stress (In Chinese)[J]. Journal of Jilin Agricultural University, 2012, 34(1): 5-10. [李宁毅, 韩晓芳, 宋妍. 高温胁迫下不同浓度烯效唑对百日草幼苗光合作用和叶绿素荧光参数的影响[J]. 吉林农业大学学报, 2012, 34(1): 5-10.]
(  0) 0) |
| [7] |
Wang Y J, Yu J H, Yong S Y, et al. Effects of seed soaking with S3307 on physiology of cucumber seedling under salt-stress (In Chinese)[J]. Journal of Shanxi Agricultural University(Natural Science Edition), 2007, 51(2): 139-142. [王玉洁, 郁继华, 雍山玉, 等. 烯效唑(S-3307)浸种对盐胁迫下黄瓜幼苗生理的影响[J]. 山西农业大学学报(自然科学版), 2007, 51(2): 139-142.]
(  0) 0) |
| [8] |
Li Z H, Mu T T, Yang J H, et al. Effects of PP333 and CCC on lodging resistance and yield of prosomillet (In Chinese)[J]. Journal of Shanxi Agricultural Sciences, 2023, 51(10): 1219-1225. [李志华, 穆婷婷, 杨金慧, 等. 多效唑和矮壮素对糜子抗倒伏性及产量的影响[J]. 山西农业科学, 2023, 51(10): 1219-1225.]
(  0) 0) |
| [9] |
Gen X L, Wu H J, Fu P, et al. Effects of paclobutrazol, chlormequat chloride, and mepiquat chloride on lodging resistance and seed yield in oats (In Chinese)[J]. Pratacultural Science, 2023, 40(9): 2340-2347. [耿小丽, 武慧娟, 付萍, 等. 叶面喷施多效唑、矮壮素、缩节胺对燕麦抗倒伏性和种子产量的调节作用[J]. 草业科学, 2023, 40(9): 2340-2347.]
(  0) 0) |
| [10] |
Kou F X, Fan X H, Qi Q L, et al. Effects of plant-growth retardants S3307 and B9 on dwarfing and blooming of narcissus plants (In Chinese)[J]. Journal of Hebei Agricultural Sciences, 2004(3): 70-73. [寇凤仙, 樊新华, 齐巧丽, 等. S3307、B9对水仙矮化和开花的影响[J]. 河北农业科学, 2004(3): 70-73.]
(  0) 0) |
| [11] |
Lv M W, Xu J G, Du J, et al. Effects of exogenous gibberellin A3 and paclobutrazol on development of herbaceous peony(Paeonia lactiflora)bulbils (In Chinese)[J]. Plant Physiology Journal, 2018, 54(5): 790-802. [吕梦雯, 徐金光, 杜杰, 等. 外源赤霉素和多效唑对芍药冬季鳞芽发育的影响[J]. 植物生理学报, 2018, 54(5): 790-802.]
(  0) 0) |
| [12] |
Fan Y H. Effects of drought stress and paclobutrazol treatment of lemon autumn flower bud differentiation[D]. Wuhan: Huazhong Agricultural University, 2017.[范玉花. 干旱胁迫与多效唑处理对柠檬秋花花芽分化的影响研究[D]. 武汉: 华中农业大学, 2017.]
(  0) 0) |
| [13] |
Meng L, Ma T, Yue X L, et al. Effects of plant growth retardants on the flowering period of Hemerocallis citrina and its metabolites (In Chinese)[J]. Acta Horticulturae Sinica, 2025, 52(4): 997-1006. [孟璐, 马涛, 岳新丽, 等. 植物生长延缓剂延迟黄花菜花期及对代谢产物的影响[J]. 园艺学报, 2025, 52(4): 997-1006.]
(  0) 0) |
| [14] |
Shang S M, Liu L P. Residual presence of DDT organochlorine pesticides in agricultural soils and their impact on crop ecological environment (In Chinese)[J]. Chemical Engineer, 2024, 38(12): 42-45, 66. [尚胜美, 刘丽萍. 农田土壤中DDT类有机氯农药残留及其对作物生态环境的影响[J]. 化学工程师, 2024, 38(12): 42-45, 66.]
(  0) 0) |
| [15] |
[15] Gonçalves I C R, Araújo A S F, Carvalho E M S, et al. Effect of paclobutrazol on microbial biomass, respiration and cellulose decomposition in soil[J]. European Journal of Soil Biology, 2009, 45(3): 235-238. DOI:10.1016/j.ejsobi.2009.01.002
(  0) 0) |
| [16] |
[16] Bhardwaj L, Reddy B, Jyoti N A, et al. Influence of herbicide on rhizospheric microbial communities and soil properties in irrigated tropical rice field[J]. Ecological Indicators, 2024, 158: 111534. DOI:10.1016/j.ecolind.2023.111534
(  0) 0) |
| [17] |
Jiao S, Qi J J, Liu J A, et al. Soil microbiome and soil health assessment in arid regions (In Chinese)[J]. Acta Pedologica Sinica, 2023, 60(5): 1350-1362. DOI:10.11766/trxb202307210285 [焦硕, 戚杰军, 刘纪爱, 等. 旱区土壤微生物组与土壤健康评价[J]. 土壤学报, 2023, 60(5): 1350-1362.]
(  0) 0) |
| [18] |
Mishra S, Zhang X X, Yang X D. Plant communication with rhizosphere microbes can be revealed by understanding microbial functional gene composition[J]. Microbiological Research, 2024, 284: 127726. DOI:10.1016/j.micres.2024.127726
(  0) 0) |
| [19] |
Spaepen S, Dobbelaere S, Croonenborghs A, et al. Effects of Azospirillum brasilense indole-3-acetic acid production on inoculated wheat plants[J]. Plant and Soil, 2008, 312(1/2): 15-23.
(  0) 0) |
| [20] |
Li Y Z, Wang Z T, Li T, et al. Wheat rhizosphere fungal community is affected by tillage and plant growth[J]. Agriculture, Ecosystems & Environment, 2021, 317: 107475.
(  0) 0) |
| [21] |
Wang C Q. Effects of chlormequat chloride on metabolites of Codonopsis pilosula and soil microecology[D]. Lanzhou: Lanzhou University, 2021.[王超群. 矮壮素对党参代谢产物及其土壤微生态的影响[D]. 兰州: 兰州大学, 2021.]
(  0) 0) |
| [22] |
Yuan Z, Cheng B, Chang Y, et al. Influence of paclobutrazol on microbial diversity in soil[J]. Journal of Agro-Environment Science, 2008, 5: 1848-1852.
(  0) 0) |
| [23] |
Silva C M M S, Vieira R F, Nicolella G. Paclobutrazol effects on soil microorganisms[J]. Applied Soil Ecology, 2003, 22(1): 79-86. DOI:10.1016/S0929-1393(02)00110-5
(  0) 0) |
| [24] |
Song L, Liu G Z, Zhang H, et al. Effects of drip fertigation with dense planting on yield and soil bacterial community of summer maize in Southwest China (In Chinese)[J]. Acta Agronomica Sinica, 2025, 51(4): 992-1004. [宋利, 刘广周, 张华, 等. 密植滴灌水肥一体化对西南夏玉米产量及土壤细菌群落的影响[J]. 作物学报, 2025, 51(4): 992-1004.]
(  0) 0) |
| [25] |
Wu Q. Study on the application technology of bio-organic fertilizer from farming manure source based on rice fields in Taizhou area to replace chemical fertilizer[D]. Nanjing: Nanjing Agricultural University, 2021.[吴琦. 基于泰州地区稻田的养殖粪污源生物有机肥替代化肥的施用技术研究[D]. 南京: 南京农业大学, 2021.]
(  0) 0) |
| [26] |
Ren H Y, Zhou H M, Qi X J, et al. Effects of paclobutrazol on soil and endophytic microbial community structure of bayberry (In Chinese)[J]. Scientia Agricultura Sinica, 2021, 54(17): 3752-3765. [任海英, 周慧敏, 戚行江, 等. 多效唑对杨梅土壤微生物及内生群落结构的影响[J]. 中国农业科学, 2021, 54(17): 3752-3765.]
(  0) 0) |
| [27] |
Tian C L, Yao L J, Lu X M, et al. Analysis of soil microbial community structure of strawberry in greenhouse with different continuous cropping years (In Chinese)[J]. Soil and Fertilizer Sciences in China, 2024(8): 102-110. [田春丽, 姚丽娟, 鲁晓民, 等. 不同连作年限设施草莓土壤微生物群落结构分析[J]. 中国土壤与肥料, 2024(8): 102-110.]
(  0) 0) |
| [28] |
Ding C X, Liu Y W, Liu H Y, et al. Dry-wet alternation regulate soil active bacterial communities and potential functions in paddy fields (In Chinese)[J]. Acta Pedologica Sinica, 2024, 61(5): 1421-1431. DOI:10.11766/trxb202302180065 [丁晨晓, 刘耀威, 刘亥扬, 等. 干湿变化调控稻田土壤活性细菌群落与潜在功能[J]. 土壤学报, 2024, 61(5): 1421-1431.]
(  0) 0) |
| [29] |
Zhou X Y, Yang S D. Progress on changing characteristics and reconstruction of microbial communities in soil under tomato continuous cropping (In Chinese)[J]. Journal of Huazhong Agricultural University, 2024, 43(1): 1-8. [周信雁, 杨尚东. 番茄连作土壤中微生物群落的变化特征及其重塑研究进展[J]. 华中农业大学学报, 2024, 43(1): 1-8.]
(  0) 0) |
| [30] |
Gong Y Y, Wang R H, Zhang B, et al. Effects of thinning on soil nutrients and rhizosphere microbial communities of a Cryptomeria fortunei plantation in western Sichuan, China (In Chinese)[J]. Chinese Journal of Applied and Environmental Biology, 2024, 30(1): 9-17. [龚映匀, 王瑞辉, 张斌, 等. 抚育间伐对川西柳杉人工林土壤养分和根际微生物群落的影响[J]. 应用与环境生物学报, 2024, 30(1): 9-17.]
(  0) 0) |
| [31] |
Qiu L P, Zhang Q, Zhu H S, et al. Erosion reduces soil microbial diversity, network complexity and multifunctionality[J]. The ISME Journal, 2021, 15(8): 2474-2489. DOI:10.1038/s41396-021-00913-1
(  0) 0) |
| [32] |
Wen Y C, Li H Y, Lin Z A, et al. Long-term fertilization alters soil properties and fungal community composition in fluvo-aquic soil of the North China Plain[J]. Scientific Reports, 2020, 10(1): 7198. DOI:10.1038/s41598-020-64227-6
(  0) 0) |
| [33] |
Chen S T, Wu M M, Li T, et al. Effects of EM bacteria on tomato yield and soil bacterial community[J]. Acta Horticulturae Sinica, 2025, 1—14[2025-09-02].[陈舒婷, 吴幕绵, 李涛, 等. 有效微生物群落对番茄产量及根际土壤细菌群落的影响[J/OL]. 园艺学报, 2025, 1—14[2025-09-02].]
(  0) 0) |
| [34] |
Xu A X, Li L L, Coulter J A, et al. Long-term nitrogen fertilization impacts on soil bacteria, grain yield and nitrogen use efficiency of wheat in semiarid Loess Plateau, China[J]. Agronomy, 2020, 10(8): 1175. DOI:10.3390/agronomy10081175
(  0) 0) |
| [35] |
Xu P G, Xie K Z, Hu X Y, et al. Effects of different continuous cropping years on diversity of bacterial communities in the rhizosphere soil of potatoes (In Chinese)[J]. Agricultural Research in the Arid Areas, 2024, 42(3): 197-205. [徐沛国, 谢奎忠, 胡新元, 等. 不同连作年限马铃薯根际土壤细菌群落特征研究[J]. 干旱地区农业研究, 2024, 42(3): 197-205.]
(  0) 0) |
 2026, Vol. 63
2026, Vol. 63


