2. 湖南省耕地与农业环境生态研究所, 长沙 410125
2. Hunan Institute of Farmland and Agricultural Environment and Ecology, Changsha 410125, China
近年来,工业化、城镇化的快速发展使土壤污染呈现出重金属-有机复合污染趋势[1-5]。污染物通过多种方式进入环境,例如化石燃料燃烧、化肥和农药施用、污水灌溉等,最终大气和水体中的污染物通过干湿沉降和渗透作用进入土壤[6-7]。由于土壤颗粒的独特理化性质,污染物易在土壤中赋存[8-11],导致土壤成为复合污染的汇。其中镉(Cd)和菲作为代表性污染物,在耕地土壤中普遍存在。全国耕地土壤中Cd含量为0.01~5.50 mg·kg–1,而东部沿海地区多环芳烃(PAHs)的平均含量为1172.7 μg·kg–1,严重威胁着土壤生态和人类健康[12-13]。
土壤原位修复技术包括物理修复、化学修复、植物修复和微生物修复。主要通过施加土壤改良剂、采用超积累植物,或改变土壤理化性质以实现低成本、低环境扰动的修复[14-15]。稻田独特的水分管理造成了土壤厌氧的环境特性[16]。水稻通过根系泌氧作用(ROL)[17]和径向氧损失在根系表面形成一层微氧层[18],该过程影响了水稻根际氧化还原电位(Eh)、pH和微生物群落丰度[19]。此外,通过氧化亚铁离子形成根表铁膜吸附Cd和菲,协同降低Cd和菲的生物有效性[20]。受ROL影响,根际微氧环境并不稳定,会随着昼夜波动,并伴随着根际铁锰的溶解导致Cd的再活化[21]。主动调控微氧生境以优化污染物阻控效果,成为当前研究的关键挑战。根际微生物群落的ROL作用在污染物转化中发挥关键作用:好氧型Fe(II)氧化菌通过ROL提供的氧气将Fe2+氧化为Fe3+沉淀,促进Cd的共沉淀;而厌氧型硫酸盐还原菌在厌氧条件下生成硫化物(S2–),通过形成CdS沉淀固定Cd[22-23]。改变土壤氧含量可以调控微生物-植物-土壤界面过程,有效降低污染物的环境效应,维持土壤功能[24]。在水培条件下,通过UFB纳米气泡发生器向营养液中泵氧,使根系和地上部的砷(As)含量分别降低了12.5%和46.4%[25];向水稻田土壤中添加负载纳米气泡的生物质炭和矿物质均能有效降低水稻中的As[26-28];插入塑料滴管向土壤中通气作为水稻栽培技术创新,塑料管表面诱导的氧化铁层富集了土壤中1.8%的总As[29]。这些研究证明了改变水稻根际微氧环境能有效降低水稻吸收和积累有害污染物,但是潜在的作用机制没有得到充分揭示。
为此,本研究通过在水稻根际土壤中插入改良的塑料滴管,探讨水稻根际微氧环境的改变对水稻根际Eh、pH等土壤理化性质、铁膜形成以及根际微生物群落影响及其机制,以探寻人工调控水稻根际微氧环境降低水稻根系对Cd和菲吸收的方法。
1 材料与方法 1.1 供试材料氯化镉(CdCl2,99%)和菲(Phenanthrene,97%)纯度为分析纯,购自上海阿拉丁生化科技股份有限公司;无机试剂均为分析纯,购自湖南汇虹试剂有限公司;甲醇、二氯甲烷和乙腈等有机试剂均为色谱纯,购自上海麦克林生化科技股份有限公司;供试水稻品种选用湖南地区主栽中稻品种“黄华占”,种子购自湖南金色农丰种业有限公司。挑选饱满的水稻种子用10%的H2O2浸泡30 min,然后在30℃黑暗条件下的智能人工气候箱中用超纯水浸泡催芽。经过4 d种子萌发,将育苗盘中的超纯水更换为水稻营养液,pH调节为5.5。培养条件设置为:温度为25℃,光照12 h,黑暗12 h,光照强度为8000 Lux,湿度为80%,每3天更换一次水稻营养液。盆栽试验于湘潭大学开展,供试土壤取自益阳桃江县水稻田,土壤基本理化性质如下:pH 7.0,有机质12.6 g·kg–1,有效磷25.5 mg·kg–1,速效钾60.4 g·kg–1,铵态氮16.4 mg·kg–1,Cd 0.67 mg·kg–1,菲0.17 mg·kg–1。
1.2 水稻盆栽试验如图 1所示,将塑料滴管上下开口使空气能有效通过,并在侧面均匀开孔加强根际土壤气体和空气的交换。通过设置不同插管深度改变水稻根际微氧生境,根据水稻根系生长范围,设计插管深度分别为10 cm(D1)、15 cm(D2)、20 cm(D3)和25 cm(D4),将滴管垂直插入水稻根系并在土平面上预留5 cm便于气体交换,同时设置不插管组作为对照组(CK)。分别于分蘖期、拔节期、抽穗期、成熟期收集水稻,并通过抖土法收集根际2 mm土壤,将土壤分为两份,一份自然风干后过60目筛,用于测定理化性质,一份储存于–80℃冰箱用于高通量测序。
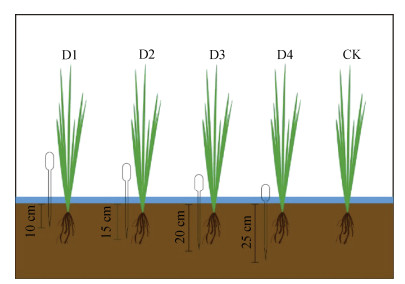
|
注:D1、D2、D3、D4分别为不同插管深度处理,CK为空白对照组。Note:D1,D2,D3,and D4 represent treatments with different tube insertion depths,while CK denotes the blank control group. 图 1 试验示意图 Fig. 1 Schematic diagram of the experiment |
采用微波消解法提取土壤和水稻样本中的总Cd。对于土壤样本,称取0.2 g土壤样本加入到消解罐中,加入6 mL HNO3、2 mL HF和2 mL HCl,150℃消解10 min,180℃消解5 min,210℃消解30 min,加入1 mL HClO4后在电加热板上赶酸至1 mL以下,定容至50 mL,过0.22 μm滤膜后待测;对于水稻样本,称取0.2 g水稻根际样本加入到消解罐中,加入8 mL HNO3,120℃预加热,于130℃消解8 min,150℃消解5 min,180℃消解30 min,定容至50 mL,过滤后待测。
按照以下方法提取水稻根表不同形态Cd[29]。称取0.2 g新鲜水稻根样本,加入50 mL的0.175 mol·L–1(NH4)2C2O4和0.1 mol·L–1 H2C2O4缓冲溶液(pH 4.0),浸泡3 h,提取新鲜根表无定形部分铁斑中的Cd含量;然后将提取后的水稻根取出用超纯水清洗干净,加入50 mL的DCB溶液(0.03 mol·L–1 Na3C6H5O7-2H2O、0.125 mol·L–1 NaHCO3和0.06 mol·L–1 Na2S2O4)提取根表定形部分铁斑中的Cd含量,浸泡3 h;最后将去除铁斑的水稻根用超纯水清洗干净,烘干至恒重后进行微波消解,获得根中残渣态Cd。
使用ICP-MS分析样本中Cd的含量,采用多元素标准溶液(GNM-M261141-2013)建立了校准曲线。为确保结果的准确性,采用铑(Rh)和铼(Re)元素作为内标,二者的回收率为85%~110%。对标准物质GBW07426和GBW10045按照样本同样的方法进行处理来评估样本中Cd的提取效率,Cd的回收率为91.36%~112.06%。
1.4 样品中菲的提取与测定准确称取0.2 g样品置于带有聚四氟乙烯盖的棕色玻璃瓶中。向瓶中加入10 mL正己烷和二氯甲烷混合液(1︰1,v/v),涡旋30 s,4℃超声萃取30 min,3500 r·min–1离心15 min,收集萃取液,重复3次,合并萃取液,然后在氮吹仪上浓缩至1.0 mL。将浓缩液移入硅胶柱中,用1.0 mL正己烷洗涤玻璃瓶,然后将洗涤液移入硅胶柱中。用10 mL正己烷和二氯甲烷混合液(1︰1,v/v)洗脱,洗脱液用氮吹浓缩至1.0 mL,加入3.0 mL乙腈,再浓缩至1.0 mL以下,将溶剂完全置换为乙腈,最后用乙腈定容至2.0 mL,用0.22 μm有机滤膜过滤至棕色液相小瓶中,待测。
使用HPLC分析样本中菲的含量。测试参数为:色谱柱为250 × 4.6 mm Luna 5 µm C18;流动相为70%乙腈和30%超纯水;流速为1.0 mL·min–1;温度为30℃;进样量为20 μL;菲的紫外吸收波长为254 nm,激发波长为254 nm,发射波长为350 nm;总运行时间15 min。为确保结果的准确性,在石英砂中添加1.0 mg·kg–1的菲按照与样本同样的处理步骤来评估样本中菲的提取效率,菲的回收率为86.22%~93.25%。
1.5 土壤微生物群落结构分析将D2处理组的根际土壤和根表铁斑样本送至深圳微科盟科技有限公司采用16s rDNA高通量测序技术,分析根际土壤微生物群落结构。首先对原始测序数据进行质量控制,去除低质量序列和引物污染序列。后使用Qiime2软件中的DADA2插件对序列进行质量控制、去噪拼接,去除嵌合体,形成OTU(扩增特征序列)。通过Silva数据库对OTU进行分类学注释,获得从门到属水平的物种组成,并进一步计算α和β多样性指数。
1.6 qPCR分析利用实时荧光定量PCR(qPCR)对根际土壤和根表铁斑总DNA中耐Cd基因(czcC和cadA)和菲降解基因(pahE4和pahE1)进行定量分析,引物序列见表 1。
|
|
表 1 PCR引物及其序列 Table 1 PCR primers and sequences |
使用Excel 2019对数据进行基本处理,使用SPSS Statistics 27.0对各处理数据进行统计分析,使用图基检验(Tukey)(P < 0.05)方法来检验各处理之间是否存在显著性差异。利用QIIME2计算各处理的物种群落结构、多样性(Chao1)等指标。利用R语言(version 3.3.1)绘制图表。
2 结果 2.1 插管对土壤理化性质的影响由表 2可知,插管可以显著改变根际微氧环境。与对照组相比,不同插管深度处理组均能有效增加土壤中DO的含量,并显著增加根际土壤中Fe和SOM的含量。改变根际微氧环境对水稻根际土壤的pH产生扰动。试验结果表明,插管作为调节水稻微氧结构变化的手段,有效驱动水稻根际土壤理化性质的改变。
|
|
表 2 改变根际微氧环境对土壤理化性质的影响 Table 2 Effects of altering rhizosphere micro-oxygen environment on soil physicochemical properties |
如图 2所示,调节根际微氧环境能显著降低水稻成熟期糙米中Cd和菲含量,插管后糙米中Cd的含量为0.10~0.53 mg·kg–1,菲含量为0.045~0.091 mg·kg–1(图 2a)。与对照组相比,处理组糙米中Cd含量下降了24.2%~61.1%(P < 0.05),菲含量下降了26.1%~50.6%。插入深度为15 cm(D2)组中Cd和菲含量下降幅度最大,糙米中Cd平均含量为0.20 mg·kg–1,菲含量为0.045 mg·kg–1。相较于对照组(CK),不同插管深度处理组水稻茎、叶、稻壳中Cd含量显著上升(图 2b),水稻茎中菲含量显著上升(图 2c),可能是根部污染物向上部迁移转运致使水稻茎、叶中Cd和菲含量上升。
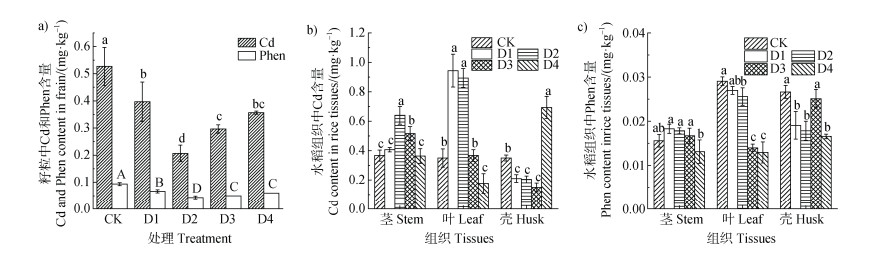
|
注:图中不同小写字母表示处理间在P < 0.05水平上存在显著差异。Note:Different lowercase letters above the bars indicate significant differences among treatments at the level of P < 0.05. 图 2 不同插管深度处理中成熟期糙米中Cd和菲含量(a)、水稻根系中Cd(b)和菲含量(c) Fig. 2 Contents of Cd and phenanthrene in rice brown rice at mature stage(a), contents of Cd(b)and phenanthrene in rice roots(c) |
如图 3a和图 3b所示,相较于CK组,不同深度插管处理下成熟期水稻根系中Cd和菲含量显著升高。进行插管处理后,成熟期水稻根系无定形态Cd(AFIP-Cd)含量上升13.3%~46.4%(P < 0.05),根系中菲含量升高8.8%~41.0%(P < 0.05),该现象与水稻氧化还原电位改变后影响水稻根表铁斑形成有关,如图 3c所示,根际不同深度插管处理下水稻根表无定形态Fe含量显著上升,最高升至CK组1.47倍。结果表明不同深度插管处理所致的Cd和菲在水稻根部的积累与水稻根部Fe的行为显著相关。
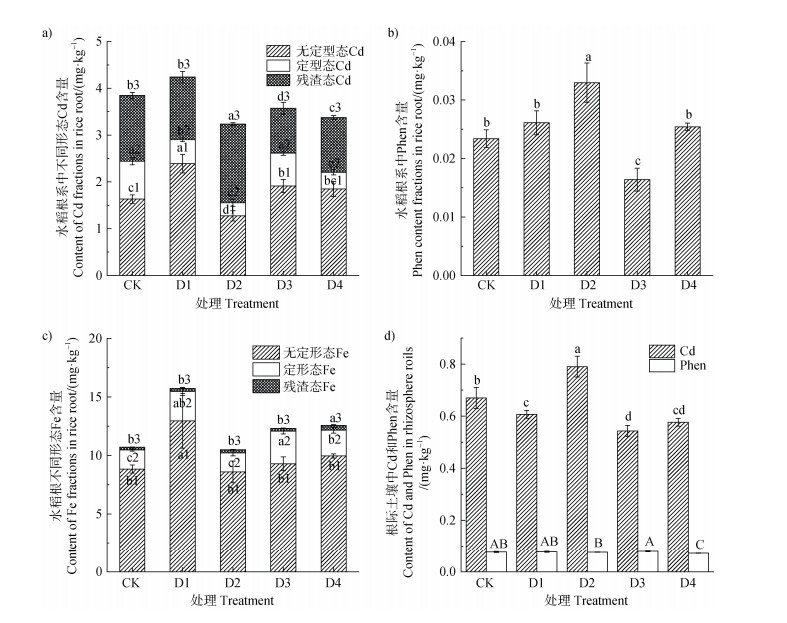
|
图 3 水稻根系中Cd含量和赋存形态(a)、菲含量(b)、Fe含量和赋存形态(c)、水稻根际土壤中Cd和菲总量(d) Fig. 3 The content and chemical forms of Cd(a), phenanthrene(b)and Fe(c)in the root system of rice, the total amount of Cd and phenanthrene(d) |
如图 3d所示,相比于CK组,不同插管深度处理组中根际土壤总Cd和菲呈现下降趋势,D1、D3、D4处理总Cd含量分别下降9.4%、18.8%、14.0%,D2和D4组根际土壤中总菲含量分别下降了1.5%和6.2%,其他组变化不明显,可能与土壤空间异质性相关。插管处理改变了水稻根际土壤中Cd和菲的赋存形态,生物有效性降低,减少了水稻植株中Cd和菲的积累。水稻根际土壤中Cd存在形态由可交换态向碳酸盐结合态和铁锰氧化物结合态转变,根际土壤中的菲由水溶态转变为有机结合态和残渣态。
2.4 插管影响水稻根际土壤中细菌群落保留所有样品中相对丰度前20的属绘制成热图。如图 4所示,改变根际微氧环境显著影响了水稻成熟期根际土壤中的群落分布。相比于CK组,处理组根际水稻土壤中Anaeromyxobacter sp.(厌氧黏细菌属)的相对丰度增加。管壁土壤中细菌群落与水稻根际群落结构存在明显差异,根际土壤中优势菌属为Candidatus Udaeobacter、Candidatus Koribacter、Bathyarchaeia sp.(深古菌)、Pseudolabrys sp.(假双斧状菌属)等,管壁土壤中优势菌属为Sphingomonas sp.(鞘氨醇单胞菌属)、Mycobacterium sp.(分枝杆菌属)等。群落丰度图表明,改变水稻根际微氧环境,水稻根际菌群维持了结构稳定性。

|
注:SB:根际土壤样品;TB:管壁土壤样品;SCK:对照组根际土壤。下同。Note:SB:Rhizosphere soil sample;TB:Sample of iron oxide on the pipe wall;SCK:Control treatment. The same below. 图 4 属水平细菌群落丰度热图 Fig. 4 Heat map of genus-level bacterial community abundance |
如图 5a所示,Chao1指数显示插管处理并未显著改变水稻根际土壤的根际细菌群落和生物多样性,表明其不影响水稻根际群落结构。与根际土壤相比,管壁土壤(TB)中Chao1指数显著下降,表明管壁土壤中细菌多样性显著低于水稻根际土壤(SB),这可能与管壁处土壤中径向氧损失有关。
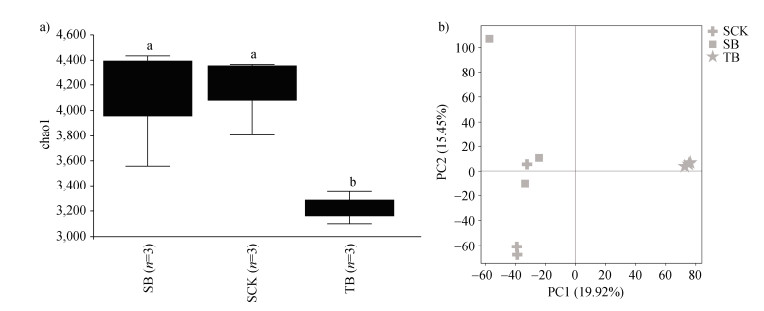
|
图 5 Chao1指数(a)和PCA主成分分析(b) Fig. 5 Chao1 index(a)and principal component analysis(PCA)(b) |
如图 5b所示,主成分分析(PCA)表明,各样本在PC1和PC2两个主成分上存在显著聚类(PC1:19.92%;PC2:15.45%)。根际土壤(SCK、SB)集中在PC1负值象限,而管壁土壤组(TB)则位于PC1正值象限,说明管壁土壤微生物与水稻根际土壤微生物存在显著性差异。SCK组与SB组的点位存在一定程度的重叠,这表明在水稻根际微氧环境改变的情况下,水稻根际细菌群落功能保持稳定。分别对水稻根际土壤和管壁土壤进行共现网络分析。图 6显示的结果表明,根际土壤中细菌群落结构与管壁土壤存在差异,根际土壤微生物群落相对复杂,且具有不同的群落特征。与管壁土壤相比,根际土壤共现网络更加复杂,表明根际土壤群落冗余度更高、稳定性更强。
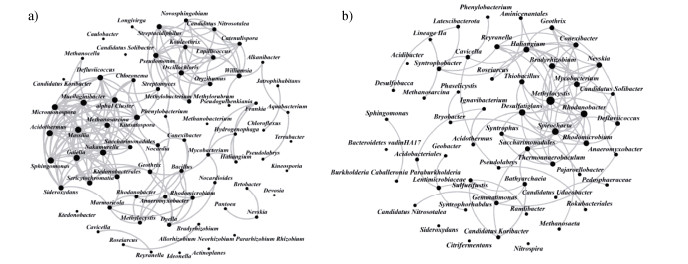
|
图 6 根际细菌群落共现网络特征:土壤(a);管壁土壤(b) Fig. 6 Analysis of co-occurrence networks of rhizosphere bacterial communities: Soil(a), Tube surface soil(b) |
如图 7所示,基因功能预测结果表明,改变根际微氧环境显著提高了土壤中大肠杆菌生物膜形成通路(Biofilm formation - Escherichia coli)的通路水平,表明水稻根际细菌通过外排泵蛋白实现对Cd和PAHs的抗性。同时管壁土壤与水稻根际土壤的KEGG通路预测结果出现了显著差异,管壁土壤中ABC transporters(ABC转运蛋白)、Degradation of aromatic compounds(芳香族化合物降解)、Lysosome(溶酶体)、Quorum sensing(群体感应)的通路表达显著增强,而Bacterial chemotaxis(微生物趋向性)、Biofilm formation(生物膜形成)显著下降,表明在根际土壤和管壁土壤中,细菌群落对于抗Cd和菲的决策出现了显著差异。
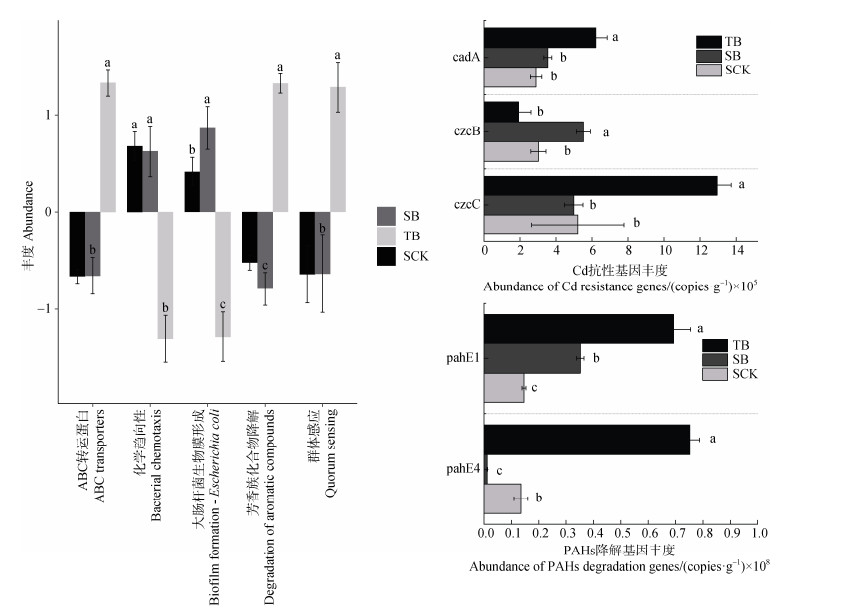
|
图 7 基于KEGG功能分类的多重比较柱状图和功能基因qPCR验证 Fig. 7 Multi-comparison analysis of differentially expressed genes based on KEGG functional classification(bar chart)with functional gene qPCR validation |
如图 7b和图 7c所示,SB组中cadA、czcB和pahE1的丰度分别为3.54×105 copies·g–1、5.52×105 copies·g–1和0.352×108 copies·g–1。相较于对照组,分别提高了1.22倍、1.83倍和2.41倍。与SB组相比,TB组中cadA、czcC、pahE1和pahE4基因丰度上升,但是czcB丰度低于SB组,这可能是管壁土壤中较简单的群落结构和较低的细菌丰度导致的。qPCR结果表明,调节水稻根际微氧环境能显著上调根际土壤中细菌抗Cd和菲基因的表达,促进根际微生物群落对Cd和菲的阻控。
3 讨论 3.1 改变根际微氧环境影响水稻组织对Cd和菲的积累稻田土壤中的Cd与菲复合污染对粮食安全及生态系统健康构成严重威胁,人工供氧技术是修复土壤重金属-有机复合污染的有效策略。本研究探讨了改变水稻根际土壤氧含量对Cd-菲复合污染稻田土壤修复的可行性,设计了不同埋置深度的插管处理,探究了对水稻吸收积累Cd和菲的阻控效果。与对照组相比,改善根际微氧环境可以有效降低根际土壤中的Cd和菲的含量,同时显著降低了水稻籽粒中Cd和菲的含量,降幅范围分别为24.2%~61.1%和26.1%~50.6%,降幅差异与插管深度密切相关,这可能是不同深度下微生物群落对氧的响应不同。深入分析污染物在水稻体内的迁移行为发现(图 2),各插管处理均不同程度地降低了Cd与菲从各组织向籽粒的关键转运系数(TF),其中Cd在糙米/茎的转移因子降低程度最大(44%),而菲在糙米/根的转移因子降低程度最大(25%)。
3.2 改变水稻根际微氧环境阻控水稻富集Cd和菲的作用机制插管显著提高了土壤体系的DO含量、氧化还原电位(Eh)和SOM含量,并扰动了根际土壤pH,促使土壤溶液中的Fe2+向Fe3+转化,进而诱导次生铁(氢)氧化物的沉淀。通过插管构建土壤中氧气扩散通道能形成铁氧化物的优势点位,形成对重金属具有特异性吸附的胶膜。本研究表明,根际不同深度插管处理下水稻根表富集污染物增强,这可能与根部AFIP-Fe含量显著上升有关,最高升至CK组的1.47倍,该现象与已有研究结论相符[30–32]。同时,促进水稻根系污染物固定,根部AFIP-Cd含量提高13.3%~46.4%,根系中菲含量提高8.8%~41.0%。结果表明,改变根际微氧环境处理组根表Cd和菲含量与AFIP-Fe含量呈显著正相关,表明根际铁膜生成且对Cd和菲具有吸附作用。综合而言,插管增加了类径向氧损失通道,改变水稻根际氧环境,从而诱导次生铁(氢)氧化物和Cd、菲发生共沉淀,阻碍水稻根系对Cd和菲的富集。改变水稻根际微氧环境促进了根际土壤SOM含量的提升,实现了根际土壤和水稻籽粒对Cd和菲的阻控。
3.3 改变水稻根际微氧环境调节水稻根际细菌群落结构稻田土壤独特的水分管理与水稻的根际泌氧作用共同构建了水稻根际微域独特的兼性厌氧细菌群落结构[33]。试验结果表明,通过插管形成新的氧通路,改变了水稻根际微域细菌群落结构,优势菌群由Anaeromyxobacter sp.(厌氧黏杆菌属)、Pseudolabrys sp.(假双斧状菌属)、Haliangium sp.(海无柄孢囊黏细菌属)变为Bathyarchaeia sp.(深古菌)、Bryobacter sp.(苔藓杆菌属)、Candidatus Udaeobacter。管壁铁(氢)氧化物表膜形成了独特的细菌群落,其优势细菌菌属为Sphingomonas sp.(鞘氨醇单胞菌属)、Mycobacterium sp.(分枝杆菌属)等,有研究表明这些菌属可以通过胞外聚合物(EPS)螯合Cd2+、分泌酪氨酸酶氧化菲,从而实现对Cd-菲复合污染的修复[34-36]。
多样性分析表明,相较于SCK组,SB组Chao1指数没有显著性差异,表明通过改变水稻根际微氧环境通过功能冗余维持了群落稳定性。相较于CK组,插管处理组(SB)的物种丰度提高,细菌群落功能冗余度上升,同时低丰度物种上升。有趣的是,插管处理导致根际Cd含量提高13.3%~46.4%(P < 0.05),菲含量提高8.8%~41.0%(P < 0.05),但是选择压力的上升并没有降低低丰度物种丰度,这可能与氧含量的上升促进重金属抗性基因等功能基因的表达有关。分析结果表明,通过改变根际微氧生境,细菌群落结构出现显著变化。DO驱动的Cd/菲活化与SOM转化协同调控群落演替,使Cd、菲和SOM成为驱动细菌群落重构的关键环境驱动力。
结合基于KEGG功能分类的差异分析和qPCR分析结果表明,改变根际微氧环境使cadA、czcB和pahE1的丰度分别上调至3.54×105 copies·g–1、5.52×105 copies·g–1和0.352×108 copies·g–1,分别为CK组的1.22倍、1.83倍和2.41倍,提高了水稻根际细菌群落的Biofilm formation - Escherichia coli通路水平,即促进水稻根际微生物群落分泌胞外多糖和黏附蛋白的能力。管壁土壤独特的微生物群落结构实现了ABC transporters(ABC转运蛋白)、Degradation of aromatic compounds(芳香族化合物降解)、Lysosome(溶酶体)、Quorum sensing(群体感应)通路的加强,表明管壁高氧区微生物可能形成了对Cd的外排泵、对菲的氧化开环的阻控机制。
4 结论本研究系统阐明了微氧调控对水稻吸收Cd-菲的协同阻控机制。结果证实,根际氧含量的增加显著促进了根表铁膜的形成与功能强化,从而增强了对Cd和菲的吸附固定作用;同时,重塑了根际微生物群落结构,强化了微生物介导的生物固定和降解过程。本研究为轻中度Cd-PAH污染稻田“边生产、边修复”提供了成本低、易推广的根际调控范式。未来应进一步在田间尺度验证溶解氧补给阈值及持续时效,并结合微生物菌剂或缓释氧化材料,构建长效、智能的微氧调控技术体系。
| [1] |
Cai Q Y, Mo C H, Wu Q T, et al. The status of soil contamination by semivolatile organic chemicals(SVOCs)in China: A review[J]. Science of the Total Environment, 2008, 389(2/3): 209-224.
(  0) 0) |
| [2] |
Song X L, Li C J, Chen W F. Phytoremediation potential of Bermuda grass(Cynodon dactylon(L.)pers.)in soils co-contaminated with polycyclic aromatic hydrocarbons and cadmium[J]. Ecotoxicology and Environmental Safety, 2022, 234: 113389. DOI:10.1016/j.ecoenv.2022.113389
(  0) 0) |
| [3] |
Yi S W, Li F, Wu C, et al. Co-transformation of HMs-PAHs in rhizosphere soils and adaptive responses of rhizobacteria during whole growth period of rice(Oryza sativa L.)[J]. Journal of Environmental Sciences, 2023, 132: 71-82. DOI:10.1016/j.jes.2022.07.017
(  0) 0) |
| [4] |
Zhang J J, Shi Z M, Liu S T, et al. Evaluation of the effectiveness of composite mineral remediation agents on Cd immobilization in soils and rice[J]. Soil and Sediment Contamination, 2022, 31(3): 386-403. DOI:10.1080/15320383.2021.1960795
(  0) 0) |
| [5] |
Zhang X R, Chen J, Wang W, et al. Photosynthetic mechanisms of carbon fixation reduction in rice by cadmium and polycyclic aromatic hydrocarbons[J]. Environmental Pollution, 2024, 344: 123436. DOI:10.1016/j.envpol.2024.123436
(  0) 0) |
| [6] |
Guo G H, Wang Y T, Zhang D G, et al. Source-specific ecological and health risks of potentially toxic elements in agricultural soils in Southern Yunnan Province and associated uncertainty analysis[J]. Journal of Hazardous Materials, 2021, 417: 126144. DOI:10.1016/j.jhazmat.2021.126144
(  0) 0) |
| [7] |
Yu P Y, Shao X Y, Wang M D, et al. Effects of atmospheric deposition on heavy metal contamination in paddy field systems under different functional areas in Changzhutan, Hunan Province, China[J]. Science of the Total Environment, 2024, 933: 172953. DOI:10.1016/j.scitotenv.2024.172953
(  0) 0) |
| [8] |
Li L M, Liu R, Chen J J, et al. Biotrophic interactions between plant and endophytic bacteria in removal of PAHs and Cd from contaminated soils enhanced by graphene oxide[J]. Journal of Cleaner Production, 2023, 417: 137996. DOI:10.1016/j.jclepro.2023.137996
(  0) 0) |
| [9] |
Li Y, Liu C, Weng L P, et al. Prediction of the uptake of Cd by rice(Oryza sativa)in paddy soils by a multi-surface model[J]. Science of the Total Environment, 2020, 724: 138289. DOI:10.1016/j.scitotenv.2020.138289
(  0) 0) |
| [10] |
Pan S F, Ji X H, Liu X L, et al. Influence of landform, soil properties, soil Cd pollution and rainfall on the spatial variation of Cd in rice: Contribution and pathway models based on big data[J]. Science of the Total Environment, 2024, 912: 168687. DOI:10.1016/j.scitotenv.2023.168687
(  0) 0) |
| [11] |
Zhang Y, Wang X, Ji X H, et al. Effect of a novel Ca-Si composite mineral on Cd bioavailability, transport and accumulation in paddy soil-rice system[J]. Journal of Environmental Management, 2019, 233: 802-811. DOI:10.1016/j.jenvman.2018.10.006
(  0) 0) |
| [12] |
Falciglia P P, De Guidi G, Catalfo A, et al. Remediation of soils contaminated with PAHs and nitro-PAHs using microwave irradiation[J]. Chemical Engineering Journal, 2016, 296: 162-172. DOI:10.1016/j.cej.2016.03.099
(  0) 0) |
| [13] |
Ghosh P, Mukherji S. Fate, detection technologies and toxicity of heterocyclic PAHs in the aquatic and soil environments[J]. Science of the Total Environment, 2023, 892: 164499. DOI:10.1016/j.scitotenv.2023.164499
(  0) 0) |
| [14] |
Hamid Y, Tang L, Hussain B, et al. Organic soil additives for the remediation of cadmium contaminated soils and their impact on the soil-plant system: A review[J]. Science of the Total Environment, 2020, 707: 136121. DOI:10.1016/j.scitotenv.2019.136121
(  0) 0) |
| [15] |
Su Y Q, Shi Q Y, Li Z Y, et al. Rhodopseudomonas palustris shapes bacterial community, reduces Cd bioavailability in Cd contaminated flooding paddy soil, and improves rice performance[J]. Science of the Total Environment, 2024, 926: 171824. DOI:10.1016/j.scitotenv.2024.171824
(  0) 0) |
| [16] |
Kong F Y, Guan D X, Huang P W, et al. Unveiling the barriers of Cd translocation from soil to rice: Insights from continuous flooding[J]. Science of the Total Environment, 2024, 946: 174265. DOI:10.1016/j.scitotenv.2024.174265
(  0) 0) |
| [17] |
Dai H Y, Wu B B, Chen B L, et al. Diel fluctuation of extracellular reactive oxygen species production in the rhizosphere of rice[J]. Environmental Science & Technology, 2022, 56(12): 9075-9082.
(  0) 0) |
| [18] |
Kuzyakov Y, Razavi B S. Rhizosphere size and shape: Temporal dynamics and spatial stationarity[J]. Soil Biology and Biochemistry, 2019, 135: 343-360. DOI:10.1016/j.soilbio.2019.05.011
(  0) 0) |
| [19] |
Lü L H, Sun L N, Yuan C L, et al. The combined enhancement of RL, nZVI and AQDS on the microbial anaerobic-aerobic degradation of PAHs in soil[J]. Chemosphere, 2022, 307: 135609. DOI:10.1016/j.chemosphere.2022.135609
(  0) 0) |
| [20] |
Qin L Y, Wang M, Sun X Y, et al. Formation of ferrihydrite induced by low pe+pH in paddy soil reduces Cd uptake by rice: Evidence from Cd isotope fractionation[J]. Environmental Pollution, 2023, 328: 121644. DOI:10.1016/j.envpol.2023.121644
(  0) 0) |
| [21] |
Liu Z, Wang Q Q, Huang S Y, et al. The risks of sulfur addition on cadmium accumulation in paddy rice under different water-management conditions[J]. Journal of Environmental Sciences, 2022, 118: 101-111. DOI:10.1016/j.jes.2021.08.022
(  0) 0) |
| [22] |
Zhang F, Peng R, Wang L F, et al. Iron and sulfur reduction caused by different growth seasons inhibits cadmium transfer in the soil-rice system[J]. Ecotoxicology and Environmental Safety, 2022, 236: 113479. DOI:10.1016/j.ecoenv.2022.113479
(  0) 0) |
| [23] |
Sui F F, Kang Y X, Wu H, et al. Effects of iron-modified biochar with S-rich and Si-rich feedstocks on Cd immobilization in the soil-rice system[J]. Ecotoxicology and Environmental Safety, 2021, 225: 112764. DOI:10.1016/j.ecoenv.2021.112764
(  0) 0) |
| [24] |
Azhar U, Ahmad H, Shafqat H, et al. Remediation techniques for elimination of heavy metal pollutants from soil: A review[J]. Environmental Research, 2022, 214: 113918. DOI:10.1016/j.envres.2022.113918
(  0) 0) |
| [25] |
Huang M Y, Nhung N T H, Dodbiba G, et al. Mitigation of arsenic accumulation in rice(Oryza sativa L.)seedlings by oxygen nanobubbles in hydroponic cultures[J]. Ecotoxicology and Environmental Safety, 2023, 268: 115700. DOI:10.1016/j.ecoenv.2023.115700
(  0) 0) |
| [26] |
Chu Q N, Sha Z M, Li D T, et al. Oxygen nanobubble-loaded biochars mitigate copper transfer from copper-contaminated soil to rice and improve rice growth[J]. ACS Sustainable Chemistry & Engineering, 2023, 11(13): 5032-5044.
(  0) 0) |
| [27] |
Sha Z M, Chen Z, Feng Y F, et al. Minerals loaded with oxygen nanobubbles mitigate arsenic translocation from paddy soils to rice[J]. Journal of Hazardous Materials, 2020, 398: 122818. DOI:10.1016/j.jhazmat.2020.122818
(  0) 0) |
| [28] |
Ding Y Q, HuangDeng L Y, Tang B R, et al. Effects of oxygen-loaded biochar on nitrogen transformation and arsenic migration in paddy soil (In Chinese)[J]. China Environmental Science, 2025, 45(3): 1410-1421. [丁一淇, 黄邓铃尧, 唐炳然, 等. 载氧生物炭对水稻土中氮转化及砷迁移的影响[J]. 中国环境科学, 2025, 45(3): 1410-1421.]
(  0) 0) |
| [29] |
Yuan Z F, Pu T Y, Jin C Y, et al. Sustainable removal of soil arsenic by naturally-formed iron oxides on plastic tubes[J]. Journal of Hazardous Materials, 2022, 439: 129626. DOI:10.1016/j.jhazmat.2022.129626
(  0) 0) |
| [30] |
Gu J F, Huo Y, Zeng P, et al. Increasing phosphorus inhibits the retention and prevention of cadmium by iron plaque and promotes cadmium accumulation in rice plants[J]. Chemosphere, 2022, 307: 135642. DOI:10.1016/j.chemosphere.2022.135642
(  0) 0) |
| [31] |
Sebastian A, Prasad M N V. Iron plaque decreases cadmium accumulation in Oryza sativa L. and serves as a source of iron[J]. Plant Biology, 2016, 18(6): 1008-1015. DOI:10.1111/plb.12484
(  0) 0) |
| [32] |
Zeng T, Khaliq M A, Li H L, et al. Assessment of Cd availability in rice cultivation(Oryza sativa): Effects of amendments and the spatiotemporal chemical changes in the rhizosphere and bulk soil[J]. Ecotoxicology and Environmental Safety, 2020, 196: 110490. DOI:10.1016/j.ecoenv.2020.110490
(  0) 0) |
| [33] |
Zhang X F, Yu H Y, Li F B, et al. Behaviors of heavy metal(loid)s in a cocontaminated alkaline paddy soil throughout the growth period of rice[J]. Science of the Total Environment, 2020, 716: 136204. DOI:10.1016/j.scitotenv.2019.136204
(  0) 0) |
| [34] |
Vishwakarma P, Dubey S K. Diversity of endophytic bacterial community inhabiting in tropical aerobic rice under aerobic and flooded condition[J]. Archives of Microbiology, 2020, 202(1): 17-29. DOI:10.1007/s00203-019-01715-y
(  0) 0) |
| [35] |
Li N, Liu R, Chen J J, et al. Enhanced phytoremediation of PAHs and cadmium contaminated soils by a Mycobacterium[J]. Science of the Total Environment, 2021, 754: 141198. DOI:10.1016/j.scitotenv.2020.141198
(  0) 0) |
| [36] |
Liu S H, Zeng G M, Niu Q Y, et al. Bioremediation mechanisms of combined pollution of PAHs and heavy metals by bacteria and fungi: A mini review[J]. Bioresource Technology, 2017, 224: 25-33. DOI:10.1016/j.biortech.2016.11.095
(  0) 0) |
 2026, Vol. 63
2026, Vol. 63


