2. 中国科学院广州地球化学研究所电子显微镜中心实验室, 广州 510640
2. Electron Microscopy Center, Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, Guangzhou 510640, China
铁氧化物作为地球表层系统中的重要矿物组分,在土壤、水体及沉积物中广泛分布,其相转化过程对重金属的迁移、转化和归宿具有重要影响[1–3]。水铁矿(Fh)作为一种非晶态铁氧化物,具有较高的比表面积和表面活性,常作为重金属的天然吸附剂[4–6]。然而,在Fe(Ⅱ)的催化作用下,Fh可通过溶解-再结晶或固态转化路径转化为晶态铁氧化物,如纤铁矿(Lp)、针铁矿(Gt)或磁铁矿(Mt),该过程通常伴随着比表面积和表面化学性质的显著变化[7-8],从而影响重金属的吸附与释放行为。镉(Cd)作为一种毒性较强的重金属元素,在环境中具有高迁移性和生物毒性[9-10],其在铁氧化物转化过程中的分布和固存特征直接关系环境污染的控制与修复[11-12]。
自然环境中,腐殖酸(HA)作为一种复杂的天然有机物,广泛存在于土壤和水体中,其分子结构中富含羧基、羟基等活性官能团,能够通过表面络合、静电作用或共沉淀等方式与铁氧化物和重金属相互作用[13-14]。已有研究表明,HA可能通过竞争吸附或改变铁氧化物表面性质抑制其相转化,同时增强重金属的固存能力[15-16]。例如,HA可通过与Fe(Ⅲ)络合降低Fe(Ⅱ)的氧化速率,从而延缓Fh向晶态铁氧化物的转化[17];此外,HA的活性官能团可能通过桥联作用促进Cd的吸附[15]。然而,HA对铁氧化物转化动力学及Cd吸附行为的调控机制尚不完全清楚,尤其是在微观尺度上,碳(C)和Cd在转化过程中的分布特征及固存机制仍需进一步研究。
近年来,透射电镜(TEM)结合能量色散谱(EDS)和电子能量损失谱(EELS)等高分辨率表征技术为研究铁氧化物-有机质-重金属相互作用提供了有力工具[18–20]。TEM高角环形暗场(HAADF)和EDS图谱则可直观揭示矿物形貌、元素分布及晶体缺陷信息,EELS技术能够精确解析不同含碳官能团的分布和演化。对此,本研究以Fe(Ⅱ)诱导的Fh转化为实验体系,系统分析了HA和Cd对转化过程的影响,结合TEM-HAADF、EDS图谱及EELS技术,探讨了C和Cd在转化过程中的微观分布特征及固存机制。研究旨在回答以下科学问题:(1)HA如何影响铁氧化物的转化动力学?(2)在三元体系中,HA如何通过其活性官能团调控Cd的吸附行为及在不同铁氧化物相中的分布特征有哪些?(3)C在铁氧化物转化过程中的固存机制是什么?通过比较Fh-Cd体系和Fh-HA-Cd体系的转化动力学、Cd吸附量及C分布特征,本研究拟揭示HA在铁氧化物转化及Cd固存中的关键作用。本研究可为揭示铁氧化物-有机质-重金属相互作用的微观机制提供理论支持,并为Cd污染的地球化学行为调控提供科学依据。
1 材料与方法 1.1 试剂及预处理本研究所用的化学试剂有FeCl3·6H2O(CAS:10025-77-1,分子量:270.3,分析纯,纯度大于99%,麦克林生化科技有限公司,上海)、FeCl2·4H2O(CAS:13478-10-9,分子量:198.81,分析纯,纯度大于99.95%,麦克林生化科技有限公司,上海)、CdCl2·H2O(CAS:654054-66-7,分子量:228.35,分析纯,纯度大于99%,科密欧化学试剂有限公司,天津)以及HA(CAS:1415-93-6,Sigma-Aldrich,默克公司,德国达姆施塔特)。
Fe(Ⅲ)、Fe(Ⅱ)和Cd(Ⅱ)储备液的制备:首先将超纯水(18.2 MΩ·cm,25 ℃)进行1 h的曝气处理,随后转移至厌氧箱(CN-VA3,威格科技有限公司,苏州,氧气浓度低于10–4 Vol%),并敞口直至厌氧箱氧气含量稳定至10–4 Vol%以下,随后将FeCl3·6H2O、FeCl2·4H2O和CdCl2·H2O固体分别溶于曝气的超纯水,得到Fe(Ⅲ)、Fe(Ⅱ)和Cd(Ⅱ)的储备液。HA储备液的制备:在制备HA储备液前,需要对HA进行纯化,即采用5 mL浓氢氟酸(HF)和5 mL浓盐酸(HCl)(1︰1体积比)加入1 L超纯水中,混合物搅拌24 h后,以10 000 rŸmin–1离心15 min,并用超纯水洗涤以去除HF和HCl,最后通过冷冻干燥得到纯化HA。纯化HA溶于超纯水中,pH调整至大于12以完全溶解HA固体。随后,将HA储备溶液搅拌12 h并过滤,以去除不溶物,滤液用于测定总有机碳(TOC)浓度。
1.2 共沉淀物合成与批量转化实验在厌氧箱中,将50 mL 100 mmolŸL–1 Fe(Ⅲ)、50 mL 1 mmolŸL–1 Cd(Ⅱ)和54.19 mL 46.13 mmolŸL–1 HA的储备溶液溶于装有340.81 mL曝气超纯水的棕色玻璃瓶(避免光照对转化的影响),混合悬浊液搅拌1 h去除残余氧气。Fe(Ⅲ)、Cd(Ⅱ)和HA的初始浓度分别为10 mmolŸL–1、100 μmolŸL–1和5 mmolŸL–1。水铁矿(Fh)-HA-Cd共沉淀物的初始Cd:C:Fe摩尔比为1:20:100,与典型Cd污染土壤的比例[19]一致。为研究HA对铁氧化物转化及Cd固存的影响,设置Fe(Ⅲ)初始浓度为10 mmolŸL–1、Cd(Ⅱ)为100 μmolŸL–1的Fh-Cd共沉淀物作为对照组进行转化实验,即将50 mL 100 mmolŸL–1 Fe(Ⅲ)、50 mL 1 mmolŸL–1 Cd(Ⅱ)的储备溶液溶于装有395 mL曝气超纯水中。Fh-HA-Cd实验组和Fh-Cd对照组分别进行三组转化实验,为保证足够的测试用量,再分别将实验组和对照组进行的三次实验所采集的固体样本经过充分混合后用于后续测试分析[19]。合成Fh-Cd和Fh-HA-Cd共沉淀之后,棕色玻璃瓶中混合液的初始pH分别为2.21和2.63。厌氧箱的氧气监测值保持不变,即表示氧气去除完毕后,随后使用1 molŸL–1 NaOH或1 molŸL–1 HCl将pH调整至7,来合成Fh-Cd和Fh-HA-Cd共沉淀,悬浊液始终以200 rŸmin–1持续搅拌。此外,pH在Fh合成及后续转化期间始终保持在7.00 ± 0.06。
合成后的Fh-Cd和Fh-HA-Cd共沉淀物被视为0 h样品,随即加入5 mL 100 mmolŸL–1 Fe(Ⅱ)储备液,激活两组共沉淀物的转化,此时反应体系的Fe(Ⅱ)浓度为1 mmolŸL–1。据前人[19]研究表示,该Fe(Ⅱ)浓度催化速率适中,有利于更好地观察转化后的矿物变化及HA和Cd分布。根据相关研究,Fe(Ⅱ)催化24 h内反应速率较快,随后反应速率减弱[18-19],因此,本研究在反应初期进行更多次的采样,以便于更准确地观察反应变化,即在0、6、12、24、48、72、120和168 h对转化样品进行收集,体积为50 mL。收集的样品以10 000 rŸmin–1离心10 min,离心后的铁氧化物-HA-Cd上清液通过0.45 μm聚醚砜(PES)滤膜过滤后进行TOC测定,而铁氧化物-Cd和铁氧化物-HA-Cd的上清液通过PES滤膜过滤后测定Cd浓度。两组的固体样品在厌氧箱中干燥、粉碎并储存,以备X射线衍射(XRD)、透射电子显微镜(TEM)测试。
1.3 分析测试 1.3.1 总有机碳(TOC)浓度测定在TOC测定前,铁氧化物-HA-Cd滤液用1 molŸL–1 HCl酸化(酸/滤液体积比为1︰100)。滤液中的HA浓度通过Vario TOC分析仪(Elementar,德国)测定。在酸性条件下HA可能沉淀或絮凝,因此滤液的测定应在酸化后30 min内完成。基于标准样品和两组重复样品的分析精度优于正负10%(2SD)。
1.3.2 Cd浓度测定滤液用2%(v:v)HNO3酸化和稀释。所有滤液的Cd浓度通过电感耦合等离子体质谱仪(ICP-MS,Agilent 7900,美国)测定。在测试过程中引入内标溶液(115In,100 μg∙L–1)以校正偏差。Cd ICP标准和重复样品的精度优于正负5%(2SD)。
1.3.3 X射线衍射(XRD)扫描铁氧化物的物相鉴定采用D8 Advance衍射仪(Bruker公司,德国)进行,配备Cu Kα辐射(λ = 0.154 18 nm)。数据采集范围为10°至70°(2θ),电压为40 kV,电流为40 mA。仪器扫描速度为每步2.4 s,扫描速率0.02°,固定步长2° Ÿmin–¹。数据通过LynxEye XE能量色散硅条探测器以连续扫描模式收集。
1.3.4 透射电子显微镜(TEM)表征将Fh-HA-Cd转化过程中0 h和168 h样品进行微观表征,以揭示铁氧化物、HA和Cd的分布情况。共沉淀的微观表征采用Thermo Scientific FEI Talos F200S透射电子显微镜(TEM)进行,电压为200 kV,配备SuperX能量色散光谱仪(EDS)和Gatan Continuum 1077电子能量损失光谱仪(EELS)。TEM表征前,将固体样品置于乙醇中,并超声处理30 min,使固体颗粒充分分散。将10 μL悬浊液移液至Si3N4载网上,随后在红外灯下干燥5 min。铁氧化物的形貌在高角度环形暗场进行观察,Fe、C和Cd的空间分布通过EDS面扫进行分析,铁氧化物和C的空间分布通过EELS分析。C K边、O K边和Fe L边的背景扣除范围分别为248.5~278.5 eV、493.6~523.6 eV和673.0~703.0 eV,积分信号范围分别为278.5~308.5 eV、523.6~553.6 eV和703.0~733.0 eV。
1.4 数据处理与统计分析TOC及Cd浓度数据的处理采用Excel 2024进行。XRD的物相鉴定和里特维尔德(Rietveld)精修采用Profex 5.2.4软件进行。TEM-EDS-EELS数据分析及图像解析采用DigitalMicrograph 3.5进行。图片内的注释采用CorelDRAW软件进行。
2 结果 2.1 转化过程中铁矿物、腐殖酸和镉含量的变化铁氧化物的相对含量分析显示,在转化激活之前,实验组和对照组的水铁矿(Fh)均已成功合成(图 1a和图 1b)。在Fh-Cd体系中,加入Fe(Ⅱ)激活转化后,6 h时纤铁矿(Lp)占48.08%,针铁矿(Gt)占43.49%,随后Lp在120 h前持续转化为Gt,至168 h时少量磁铁矿(Mt,占4.82%,图 1a)。在Fh-HA-Cd体系中,大部分腐殖酸(TOC = 87.22%~95.90%,图 2a)被铁氧化物吸附,固相HA浓度从初始4.94 mmolŸL–1下降至4.49 mmolŸL–1(图 2a)。HA的存在使转化速率减慢,6 h时Lp占11.40%,12 h时增至87.20%,24 h前Gt占37.46%,168 h时矿物组成为Fh(2.63%)、Lp(42.79%)和Gt(54.6%),未检测到Mt(图 1b)。
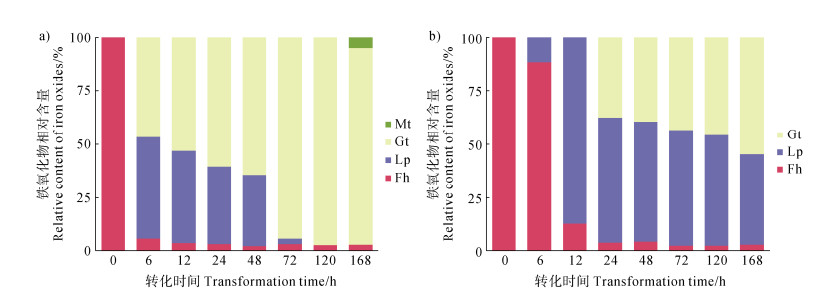
|
注:Fh:水铁矿,Lp:纤铁矿,Gt:针铁矿,Mt:磁铁矿。下同。 Note: Fh: ferrihydrite; Lp: lepidocrocite; Gt: goethite; Mt: magnetite. The same below. 图 1 水铁矿转化过程中铁氧化物的相对含量分布(a. 水铁矿+镉转化对照组;b. 水铁矿+腐殖酸+镉转化实验组) Fig. 1 Relative content distribution of Fe oxides during the transformation process of ferrihydrite(a. Control group of ferrihydrite+cadmium transformation; b. Experimental group of ferrihydrite+humic acid+cadmium transformation) |
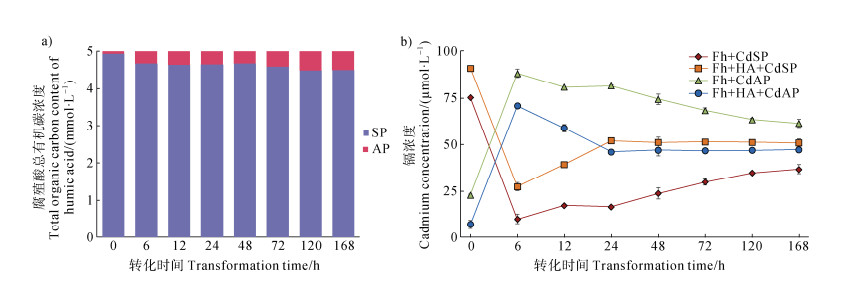
|
注:SP:固相,AP:液相,HA:腐殖酸,Cd:镉。下同。 Note: SP: soild phase, AP: aqueous phase, HA: humic acid, Cd: cadmium. The same below. 图 2 水铁矿-腐殖酸-Cd共沉淀转化过程中腐殖酸总有机碳浓度变化(a)和镉浓度变化(b) Fig. 2 The variation of total organic carbon concentration(a)and cadmium concentration(b)during the transformation of ferrihydrite-humic acid-Cd coprecipitation |
在矿物转化前(0 h),Fh-Cd和Fh-HA-Cd共沉淀物的Cd浓度分别为70.99 μmolŸL–1和83.66 μmolŸL–1(图 2b),表明大部分Cd被Fh初始吸附。转化激活后,固相Cd浓度在6 h时迅速下降,随后实验组和对照组均呈现缓慢上升趋势,Fh-HA-Cd实验组固相Cd浓度在24 h后趋于稳定,较Fh-Cd对照组更快达到平衡(图 2b)。总体而言,Fh-HA-Cd实验组固相Cd浓度较Fh-Cd对照组高约5%~10%。
2.2 矿物形貌及元素分布特征TEM-HAADF图像显示,0 h时Fh-HA-Cd共沉淀物呈现无定形的云雾状结构(图 3a和图 3b)。168 h后,观察到板条状Lp和棒状Gt,Lp和Gt纳米颗粒常被云雾状Fh包围或包裹(图 3c,图 3e),Lp晶体中存在大量纳米孔隙和缺陷(图 3c和图 3e)。EDS图像表明,0 h时C和Cd分布与Fe和O高度相关(图 4a),168 h后Fh覆盖的铁氧化物团聚体中C和Cd分布相似(图 4b),而无Fh覆盖的团聚体中C信号无明显规律,Cd信号仍与Fe和O相关(图 4c)。
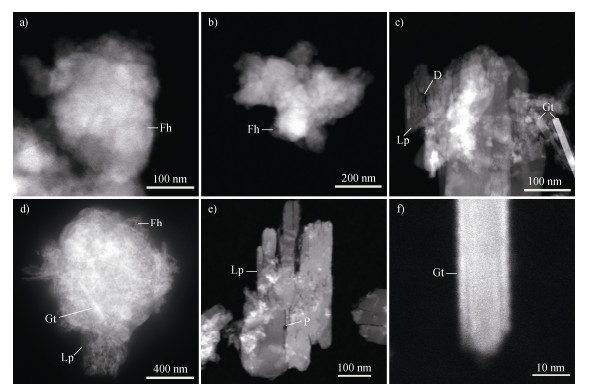
|
注:D:缺陷,P:孔隙。 Note: D: defect, P: pore. 图 3 水铁矿-腐殖酸-镉共沉淀转化过程中铁氧化物的透射电镜高角环形暗场(TEM-HAADF)图像(a.和b. 0 h的水铁矿形貌;c.和d. 168 h的铁氧化物共沉淀;e. 168 h的纤铁矿;f. 168 h的针铁矿) Fig. 3 Transmission electron microscope-high angle annular dark field(TEM-HAADF)images of Fe oxides during the ferrihydrite-humic acid-cadmium transformation(a. and b. morphologies of ferrihydrite at 0 h; c. and d. Co-precipitation of Fe oxides for 168 h; e. lepidocrocite at 168 h; f. goethite at 168 h) |
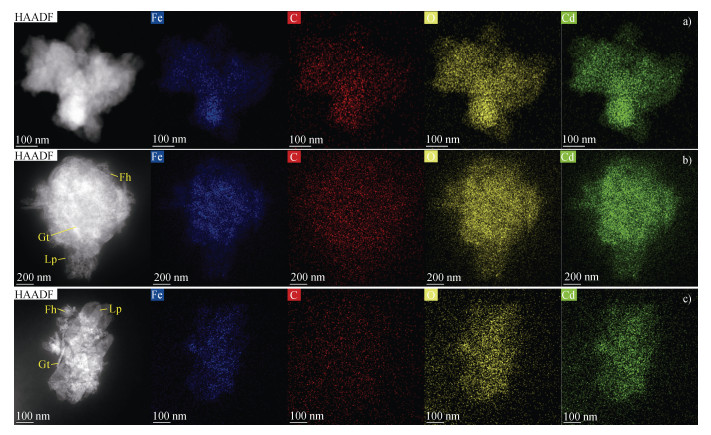
|
注:HAADF,高角环形暗场。 Note: HAADF, high angle annular dark field. 图 4 水铁矿-腐殖酸-镉转化过程中能量色散谱面扫图像(a. Fh(0 h);b. Fh覆盖的矿物团聚体(168 h);c. 无Fh覆盖的矿物团聚体(168 h)) Fig. 4 Mapping images by energy dispersive spectrometer during the ferrihydrite-humic acid-cadmium transformation(a. Fh(0 h); b. Fe mineral aggregates covered by Fh 168 h; c. Fe mineral aggregates without Fh coverage(168 h)) |
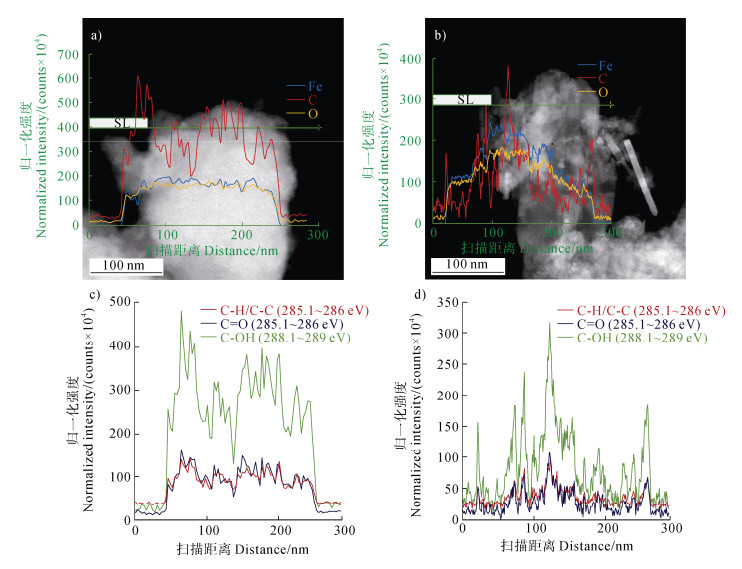
EELS线扫分析显示,0 h时Fh中C信号强度高于Fe和O,特别是在60~80 nm处峰值明显,100~250 nm内分布异质性较强(图 5a)。168 h时,C信号强度降低,集中在Lp缺陷(约90 nm)和微孔隙(约125 nm)处(图 5b)。不同含碳官能团的EELS谱图表明,285.1~286 eV(C-H/C-C)在0 h(图 5c)信号强度高且波动大,168 h(图 5d)降低;288.1~289 eV(C=O)在0 h(图 5c)峰值丰富,168 h(图 5d)显著减弱;289.9~292 eV(C-OH)在0 h(图 5c)强度高,168 h(图 5d)局部峰值出现但整体下降。
|
注:SL:扫描线。 Note: SL: scan line. 图 5 水铁矿+腐殖酸+镉转化过程中Fe、O和C的电子能量损失谱图(a. 0 h;b. 168 h) Fig. 5 Electron energy loss spectra of Fe, O, and C during the Fh+HA+Cd transformation(a. 0 h; b. 168 h) |
Fh-Cd和Fh-HA-Cd体系的转化速率差异表明,HA作为环境因子显著调控Fe(Ⅱ)诱导的铁氧化物相转化[15,17,21]。在Fh-Cd体系中,Fe(Ⅱ)诱导的转化快速,XRD结果显示,6 h时Lp和Gt已分别占48.08%和43.49%(图 1a),表明Fe(Ⅱ)通过加速Fh的溶解-再结晶过程促进了晶态铁氧化物的形成[7-8]。120 h后Lp向Gt的转化进一步表明,Gt可能是热力学上更稳定的相[19],而168 h时,XRD检测到少量Mt(4.82%)生成(图 1a),这可能与Fe(Ⅱ)催化作用下铁氧化物晶态转化的复杂过程有关[7-8]。TEM-HAADF图像(图 3c,图 3e)显示,Lp和Gt呈现板条状和棒状结构,表明晶态结构的形成可能影响表面性质和吸附行为[19]。相比之下,Fh-HA-Cd体系中,HA显著抑制转化速率,6 h时Lp仅占11.40%,12 h时增至87.20%,且168 h内未检测到Mt(图 1b),表明HA通过与Fe(Ⅱ)/Fe(Ⅲ)的络合或表面吸附,降低Fe(Ⅱ)的催化效率[15,21-23]。固相HA浓度的下降(从4.94 mmolŸL–1降至4.49 mmolŸL–1,图 2a)可能与铁氧化物物相转化过程中表面性质的变化有关[24-27]。Fh通常具有较高的表面活性,有利于吸附大量HA和Cd [25-26]。研究结果显示,Fh向Lp和Gt转化后,固相HA浓度降低(图 2a),可能与晶态铁氧化物表面吸附位点减少或表面化学性质变化有关[28]。此外,HA可能在转化过程中发生部分降解或脱附,进一步导致固相HA浓度的降低。HA的调控作用表明,其在自然环境中可显著影响铁氧化物相转化速率,从而间接影响Cd的固存行为。
3.2 Cd在水铁矿转化过程中的吸附与固存机制Cd吸附量的变化反映了铁氧化物相转化对其吸附能力的动态影响。转化初期(0~6 h),固相Cd浓度迅速下降(图 2b),可能由于Fh向Lp和Gt转化导致比表面积(SSA)显著减少[24–27],从而减少了表面吸附位点。Fh的高SSA使其初始吸附了大量Cd(70.99 μmolŸL–1和83.66 μmolŸL–1),但随着晶态Lp和Gt的形成,吸附能力下降;然而,6 h后固相Cd浓度的缓慢上升(图 2b)表明,新形成的Lp和Gt通过其他机制继续固存Cd。实验组中固相Cd浓度较对照组高约5%~10%,且在24 h后更快达到稳定(图 2b),提示HA的存在显著增强了Cd的固相保留能力。可能的机制包括:(1)HA中的活性官能团(如羧基和羟基)通过表面络合作用增强了Cd的吸附能力[13,29],HA可能通过桥联作用将Cd固定在铁氧化物表面;(2)HA抑制了铁物种的快速转化[15,27,30],延长了Fh的存在时间,从而延长了Cd在高SSA矿物上的保留时间;(3)HA可能通过影响Lp的结晶度导致晶体缺陷的增加,这些缺陷为Cd提供了额外的固存空间[15,19,27]。
TEM-HAADF和EDS分析进一步支持了上述机制。0 h时,C和Cd与Fe和O高度相关(图 4a),表明Fh对Cd和HA的初始吸附能力强。168 h后,Lp和Gt对Cd的吸附仍显著,但对C的吸附减弱(图 5b),这与晶态铁氧化物的低SSA和表面化学性质变化[24]一致。Fe-O与Cd的相关性(图 4)表明,铁氧化物是控制Cd分布的主要因素。Cd可能通过多种机制保留于新形成的铁氧化物中,包括表面吸附、结构取代和物理包裹。Lp晶体中的纳米孔隙和缺陷(图 3c和图 3e)可能为Cd的物理包裹提供了位点,而Cd的结构取代可能发生在Lp或Gt的晶格中,尤其是在Fe位点的替代,这种机制在先前的研究中已有报道[19]。此外,HA的存在可能通过改变铁氧化物表面的电荷性质,进一步促进Cd的吸附,尤其是在转化初期。
3.3 C在铁氧化物转化过程中的固存与演化机制EELS线扫和含碳官能团分析揭示了C在转化过程中的动态固存机制。0 h时,Fh中C信号强度高于Fe和O,特别是在60~80 nm处峰值明显(图 5a),反映了Fh表面HA的富集。100~250 nm内C分布的异质性可能与HA在Fh颗粒间的非均匀吸附有关。168 h时,C信号强度降低,集中在Lp缺陷(约90 nm)和微孔隙(约125 nm)处(图 5b),表明C从Fh表面向晶态铁氧化物缺陷的迁移。含碳官能团的演化(图 5c和图 5d)进一步支持了该结论:285.1~286 eV(C-H/C-C)信号在168 h时显著降低,表明C-H或C-C键在转化过程中可能发生断裂或氧化;288.1~289 eV(C=O)信号的减弱提示C=O键的脱附或降解;289.9~292 eV(C-OH)信号在168 h时局部峰值出现但整体下降,反映了C-OH键的部分保留。上述变化表明,HA在转化过程中经历了显著的降解或脱附,可能是由于Fe(Ⅱ)诱导的氧化还原反应导致了HA分子结构的分解。
C的固存机制可能与铁氧化物的结构特征密切相关。Fh的高SSA使其能够吸附大量HA,但随着Lp和Gt的形成,SSA减少导致HA的脱附[24]。然而,Lp和Gt中的缺陷和孔隙为C提供了新的固存位点,这在自然环境中可能对有机碳的长期固存具有重要意义。例如,在土壤中,铁氧化物缺陷可能通过物理包裹作用保护有机碳免于微生物降解。此外,HA的降解可能释放出低分子量有机物,这些物质可能进一步与铁氧化物表面相互作用,影响其表面化学性质。
3.4 环境意义与局限性本研究的结果对理解铁氧化物在自然环境中的地球化学行为具有重要意义。HA对Fh转化的抑制作用表明,在富含有机质的环境(如湿地土壤或河流沉积物)中,铁氧化物的相转化可能较慢,非晶态Fh可能长期存在,从而保持较高的重金属吸附能力。HA增强Cd固存的能力提示,在Cd污染土壤的修复中,添加富含HA的有机质可能是一种有效的策略。然而,HA的降解和C的脱附可能导致有机碳的释放,这在长期尺度上可能影响土壤碳循环。
本研究的局限性在于实验条件可能无法完全模拟自然环境。例如,实验中控制的pH、温度和Fe(Ⅱ)浓度可能与自然环境存在差异。此外,研究未考虑微生物活动对转化和吸附过程的潜在影响。未来研究可结合原位表征技术和分子动力学模拟,进一步探索不同环境条件(pH、离子强度、微生物活动)对转化动力学和元素固存的影响。
4 结论本研究通过系统实验和多尺度表征技术,揭示了Fe(Ⅱ)诱导下水铁矿(Fh)向晶态铁氧化物转化的动力学,以及HA和Cd在转化过程中的吸附和固存行为。结果表明,Fe(Ⅱ)显著促进了Fh向Lp和Gt的快速转化,而HA中的活性官能团(羧基、羟基等)通过占据铁氧化物表面的位点,明显减缓转化速率。Fh-HA-Cd转化实验组中较高的固相Cd浓度表明,HA增强了Cd的固相保留能力。在转化开始前,C和Cd与Fh高度相关,转化开始后Lp和Gt对Cd的吸附能力仍较强,但对C的吸附显著减弱,反映了晶态铁氧化物比表面积的减少及表面化学性质的变化。在转化过程中,C主要固存于Fh表面及Lp的缺陷和孔隙中,C=O和C-OH键减少,表明HA在转化中的降解或脱附行为。Cd则通过吸附、结构取代及物理包裹等多种机制保留于新形成的铁氧化物中。本研究表明,HA通过减缓铁氧化物转化并促进Cd固存,显著调控Cd的地球化学过程,为阐明铁氧化物-有机质-重金属相互作用机制提供了关键科学支撑。未来研究可结合原位表征技术(如原位X射线吸收光谱)和分子动力学模拟,进一步阐明HA-Cd-铁氧化物相互作用的动态过程及微观机制,同时探索不同环境条件(如pH、离子强度)对转化和吸附行为的影响,为Cd污染的治理和环境修复提供更加精确的理论支持。
| [1] |
Giannetta B, Balint R, Said-Pullicino D, et al. Fe(Ⅱ)-catalyzed transformation of Fe (oxyhydr) oxides across organic matter fractions in organically amended soils[J]. Science of the Total Environment, 2020, 748: 141125. DOI:10.1016/j.scitotenv.2020.141125
(  0) 0) |
| [2] |
Liu C X, Shi Z Q, Zachara J M. Kinetics of uranium(Ⅵ) desorption from contaminated sediments: Effect of geochemical conditions and model evaluation[J]. Environmental Science & Technology, 2009, 43(17): 6560-6566.
(  0) 0) |
| [3] |
Qiu J W, Hou X K, Ren Y, et al. Photoinduced transformation of ferrihydrite in the presence of aqueous sulfite and its influence on the repartitioning of Cd[J]. Water Research, 2023, 231: 119607. DOI:10.1016/j.watres.2023.119607
(  0) 0) |
| [4] |
Meng F Y, Bu H L, Fei Y H, et al. Effects of clay minerals on Fe2+-induced phase transformation of ferrihydrite[J]. Applied Geochemistry, 2022, 144: 105401. DOI:10.1016/j.apgeochem.2022.105401
(  0) 0) |
| [5] |
ThomasArrigo L K, Kaegi R, Kretzschmar R. Ferrihydrite growth and transformation in the presence of ferrous iron and model organic ligands[J]. Environmental Science & Technology, 2019, 53(23): 13636-13647.
(  0) 0) |
| [6] |
Schulz K, ThomasArrigo L K, Kaegi R, et al. Stabilization of ferrihydrite and lepidocrocite by silicate during Fe(Ⅱ)-catalyzed mineral transformation: Impact on particle morphology and silicate distribution[J]. Environmental Science & Technology, 2022, 56(9): 5929-5938.
(  0) 0) |
| [7] |
Notini L, ThomasArrigo L K, Kaegi R, et al. Coexisting goethite promotes Fe(Ⅱ)-catalyzed transformation of ferrihydrite to goethite[J]. Environmental Science & Technology, 2022, 56(17): 12723-12733.
(  0) 0) |
| [8] |
Handler R M, Frierdich A J, Johnson C M, et al. Fe(Ⅱ)-catalyzed recrystallization of goethite revisited[J]. Environmental Science & Technology, 2014, 48(19): 11302-11311.
(  0) 0) |
| [9] |
Li S Y, Ru D Z, Fang Y T, et al. Adsorption and passivation mechanisms of cadmium and arsenic contamination in water and soil environments by silico-ferric modified biochar (In Chinese)[J]. Acta Pedologica Sinica, 2024, 61(6): 1591-1604. DOI:10.11766/trxb202307150277 [李诗怡, 茹东周, 房友田, 等. 硅-铁改性生物质炭对水土环境中镉砷的吸附及钝化机制研究[J]. 土壤学报, 2024, 61(6): 1591-1604.]
(  0) 0) |
| [10] |
Huang M X, Guan Y F, Su Z X, et al. Interfacial reactions between As(Ⅴ) and Cd(Ⅱ) co-adsorption onto various mineral surfaces (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(6): 1583-1593. DOI:10.11766/trxb202101140027 [黄敏雪, 管玉峰, 苏子贤, 等. 砷镉在不同矿物界面的相互作用过程[J]. 土壤学报, 2022, 59(6): 1583-1593.]
(  0) 0) |
| [11] |
Blommaert H, Aucour A M, Wiggenhauser M, et al. From soil to cacao bean: Unravelling the pathways of cadmium translocation in a high Cd accumulating cultivar of Theobroma cacao L.[J]. Frontiers in Plant Science, 2022, 13: 1055912. DOI:10.3389/fpls.2022.1055912
(  0) 0) |
| [12] |
Barati E, Moore R E T, Ullah I, et al. An investigation of zinc isotope fractionation in cacao (Theobroma cacao L.) and comparison of zinc and cadmium isotope compositions in hydroponic plant systems under high cadmium stress[J]. Scientific Reports, 2023, 13: 4682. DOI:10.1038/s41598-023-30899-z
(  0) 0) |
| [13] |
Christl I, Milne C J, Kinniburgh D G, et al. Relating ion binding by fulvic and humic acids to chemical composition and molecular size. 2. metal binding[J]. Environmental Science & Technology, 2001, 35(12): 2512-2517.
(  0) 0) |
| [14] |
Liao P, Liang Y Z, Shi Z Q. Impact of divalent cations on dark production of hydroxyl radicals from oxygenation of reduced humic acids at anoxic–oxic interfaces[J]. ACS Earth and Space Chemistry, 2019, 3(4): 484-494. DOI:10.1021/acsearthspacechem.8b00181
(  0) 0) |
| [15] |
Bu H L, Lei Q K, Tong H, et al. Humic acid controls cadmium stabilization during Fe(Ⅱ)-induced lepidocrocite transformation[J]. Science of the Total Environment, 2023, 861: 160624. DOI:10.1016/j.scitotenv.2022.160624
(  0) 0) |
| [16] |
Luo M, Bai H C, Chen T Y, et al. Effects of humic acids on the adsorption, chemical speciation, and bioaccessibility of soil lead and cadmium (In Chinese)[J]. China Environmental Science, 2020, 40(3): 1191-1202. [罗梅, 柏宏成, 陈亭悦, 等. 腐殖酸对土壤铅镉吸附、赋存形态及生物可给性的影响[J]. 中国环境科学, 2020, 40(3): 1191-1202.]
(  0) 0) |
| [17] |
Qu C C, Chen J Z, Mortimer M, et al. Humic acids restrict the transformation and the stabilization of Cd by iron (hydr) oxides[J]. Journal of Hazardous Materials, 2022, 430: 128365. DOI:10.1016/j.jhazmat.2022.128365
(  0) 0) |
| [18] |
Liu F, Lu Y, Shi Z Q. Nanoscale mechanisms of carboxyl carbon preservation during Fe(Ⅱ)-induced ferrihydrite transformation[J]. Geochimica et Cosmochimica Acta, 2024, 373: 1-16. DOI:10.1016/j.gca.2024.03.027
(  0) 0) |
| [19] |
Hu S W, Zhen L R, Liu S H, et al. Synchronous sequestration of cadmium and fulvic acid by secondary minerals from Fe(Ⅱ)-catalyzed ferrihydrite transformation[J]. Geochimica et Cosmochimica Acta, 2022, 334: 83-98. DOI:10.1016/j.gca.2022.08.006
(  0) 0) |
| [20] |
Wang P, Lu Y, Hu S W, et al. Kinetics of Ni reaction with organic matter-ferrihydrite composites: Experiments and modeling[J]. Chemical Engineering Journal, 2020, 379: 122306. DOI:10.1016/j.cej.2019.122306
(  0) 0) |
| [21] |
Qu C C, Fein J B, Chen W L, et al. Mechanistic investigation and modeling of Cd immobilization by iron (hydr) oxide-humic acid coprecipitates[J]. Journal of Hazardous Materials, 2021, 420: 126603. DOI:10.1016/j.jhazmat.2021.126603
(  0) 0) |
| [22] |
Ding Y, Liu M Q, Peng S M, et al. Binding characteristics of heavy metals to humic acid before and after fractionation by ferrihydrite[J]. Chemosphere, 2019, 226: 140-148. DOI:10.1016/j.chemosphere.2019.03.124
(  0) 0) |
| [23] |
Lu Y, Liang Y Z, Liu F, et al. Nano scale visualization of enhanced adsorption and distribution of humic acid on hematite: Effect of Pb(Ⅱ) ions[J]. Chemical Geology, 2020, 541: 119573. DOI:10.1016/j.chemgeo.2020.119573
(  0) 0) |
| [24] |
Das S, Jim Hendry M, Essilfie-Dughan J. Adsorption of selenate onto ferrihydrite, goethite, and lepidocrocite under neutral pH conditions[J]. Applied Geochemistry, 2013, 28: 185-193. DOI:10.1016/j.apgeochem.2012.10.026
(  0) 0) |
| [25] |
Zheng Y Y, Yu Z H, Zhang J B, et al. Effect of humic acid-ferrihydrite complex on soil organic carbon in newly reclaimed soils (In Chinese)[J]. Soils, 2024, 56(6): 1184-1191. [郑延云, 余正洪, 张佳宝, 等. 腐殖酸-水铁矿复合物提升新整治耕地土壤有机碳的效应[J]. 土壤, 2024, 56(6): 1184-1191.]
(  0) 0) |
| [26] |
Hu S W, Liu T X, Li F B, et al. The abiotic and biotic transformation processes of soil iron-bearing minerals and its interfacial reaction mechanisms of heavy metals: A review (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(1): 54-65. DOI:10.11766/trxb202010300268 [胡世文, 刘同旭, 李芳柏, 等. 土壤铁矿物的生物-非生物转化过程及其界面重金属反应机制的研究进展[J]. 土壤学报, 2022, 59(1): 54-65.]
(  0) 0) |
| [27] |
Lu Y, Hu S W, Wang Z M, et al. Ferrihydrite transformation under the impact of humic acid and Pb: Kinetics, nanoscale mechanisms, and implications for C and Pb dynamics[J]. Environmental Science: Nano, 2019, 6(3): 747-762. DOI:10.1039/C8EN01327F
(  0) 0) |
| [28] |
Sheng A X, Li X X, Arai Y, et al. Citrate controls Fe(Ⅱ)-catalyzed transformation of ferrihydrite by complexation of the labile Fe(Ⅲ) intermediate[J]. Environmental Science & Technology, 2020, 54(12): 7309-7319.
(  0) 0) |
| [29] |
Du H H, Peacock C L, Chen W L, et al. Binding of Cd by ferrihydrite organo-mineral composites: Implications for Cd mobility and fate in natural and contaminated environments[J]. Chemosphere, 2018, 207: 404-412. DOI:10.1016/j.chemosphere.2018.05.092
(  0) 0) |
| [30] |
Shen X Y, Zhu H Y, Wang P, et al. Mechanistic and modeling insights into the immobilization of Cd and organic carbon during abiotic transformation of ferrihydrite induced by Fe(Ⅱ)[J]. Journal of Hazardous Materials, 2022, 436: 129216. DOI:10.1016/j.jhazmat.2022.129216
(  0) 0) |
 2026, Vol. 63
2026, Vol. 63


