微生物在土壤中的结构与功能是生态研究广泛关注的热点。目前,对土壤微生物的研究主要集中在土壤微生物群落结构和分布特征[1]、酶活性和土壤微生物数量变化[2]、人为干扰下土壤微生物的变化情况及群落演替和土壤微生物之间的关系[3-4]。此外,土壤微生物多样性在维持土壤质量和生态系统稳定方面的作用也日益引起人们的重视[5]。真菌作为土壤微生物区系的重要组分,在土壤中的养分循环、提高和保持土壤肥力、改善土壤结构等方面发挥着重要作用[6]。其作为土壤中的分解者,能够有效分解各类大分子物质及难分解凋落物,有利于促进植物对营养元素的吸收,是生态系统健康的指示物[7-9]。获取真菌多样性信息对于明确不同环境中真菌群落的作用、深入了解生态系统的内部结构和功能变化有重要意义。
近年来,越来越多的研究者采用不同方法对土壤中微生物多样性进行分析。其中,Biolog微平板法无需分离纯种微生物,通过微生物对碳源的利用能力反映微生物群落的总体代谢特征,成为研究微生物功能多样性的主流方法之一[10]。相关研究多集中在农田[11]、林地[12]、草原[13]、污染土壤[14]、废水处理过程中[15]的微生物碳源代谢特征分析,而利用Biolog-FF板对土壤中真菌碳源代谢多样性的研究相对较少,尤其是盐渍土壤环境下真菌的碳源代谢多样性与植物群落演替的关系尚不明确。
黄河三角洲地处海陆交接处,随距海远近、成土年龄、盐渍化程度的不同,形成了以裸地为起点的强度、中度、轻度不同耐盐程度的植被演替系列。本研究采用Biolog-FF微平板法,结合土壤理化性质进行分析,对不同盐生植被群落下土壤真菌碳源代谢水平和真菌功能多样性指数进行研究,来探寻土壤真菌碳源代谢水平随盐生植被演替的变化规律,为盐生植被演替提供重要的参考依据,从而为黄河三角洲生态恢复和利用提供理论支持和技术支持。
1 材料与方法 1.1 研究区概况研究地点位于山东省东营市黄河入海口,地理位置为东经118°44′14.1″-118°55′10.3″,北纬37°26′16.7″-37°32′41.4″,属于暖温带半湿润地区,大陆性季风气候。日照丰沛,年均气温12.5 ℃,降水量时空分布不均,年均降水量555.9 mm,70%的降水集中在夏季7、8月份,年均蒸发量是降水量的3.22倍[16]。土壤类型主要为潮土和盐土,土壤质地主要为轻壤土和中壤土。
1.2 样品采集与分析通过对黄河三角洲多次实地考察,按照盐生植被自然演替顺序,在研究区内沿东西向路线,横跨现代三角洲和近代三角洲,选择滨海滩涂(裸地),强耐盐植物群落(柽柳(Tamarix chinensis)群落、马绊草(Angiospermae)群落),轻度耐盐植物群落(罗布麻(A.venetum)群落、白茅(Imperata)群落),每个植被类型选择3个样地,共15个样地采集土壤样品。采集每个样品时在采样点周围标出50 cm × 50 cm的区域,在植株附近10 cm内分0~20 cm、20~40 cm两层用土钻钻取采样,采用对角线五点采样法,每个样地内采集5个土样,充分混匀,除去较大的根系等杂物,分成两份,每份约200 g。一份封于灭菌袋中,4 ℃保存,用于酶活性和土壤理化性质分析; 另一份放入超低温冷冻机中,-80 ℃保存,用于土壤真菌功能多样性研究。
土壤全氮(TN)测定采用元素分析仪,碱解氮(AN)测定采用碱解扩散法,有效磷(AP)测定采用Olsen法,土壤有机质(SOM)测定采用低温外加热重铬酸钾氧化-比色法,土壤粒径分析参考Kettler等[17]的方法。
1.3 土壤真菌碳源代谢水平测定采用Biolog-FF微平板法对不同盐生植被下土壤真菌的碳源代谢活性进行分析。将每个植被下3个样地土壤设置为3次重复实验。每个样地各称取10 g土壤样品于高压灭菌锥形瓶中,向瓶中加入90 mL 0.85%无菌NaCl溶液,用封口膜封口后放入振荡器,以250 r·min-1转速振荡30 min,然后将土壤溶液稀释至10-2,取150 µL稀释液于Biolog-FF微平板孔中,并将其置于26 ℃恒温箱中黑暗培养,每隔24 h用Biolog读数仪读取490 nm波长的光密度值,培养时间为24 h。
1.4 数据处理采用每孔平均吸光值(Average well color development,AWCD值)来表征真菌群落功能代谢能力,计算表达式:
| $ AWCD=\sum{\left( {{C}_{i}}-R \right)}/N $ |
式中,Ci为各反应孔在490 nm下的光密度值; R为FF板对照孔A1的吸光值,N为培养基碳源的种类,碳源种类数为95。Ci-R的值小于0的孔在计算中均记为0,即Ci-R的值均为大于等于0的数。
土壤真菌功能多样性计算公式如下:
香农-威尔指数
| $ {{P}_{i}}=\left( {{C}_{i}}-R \right)/\sum{\left( {{C}_{i}}-R \right)}; $ |
丰富度指数(S)为每孔中(C-R)的值大于0.25的孔数;
辛普森指数(D)又称优势度指数:
土壤真菌的AWCD值、多样性指数和稳定性指标的显著性检验采用单因素方差分析(one-way ANOVA)和最小显著性差异分析(LSD); 用Person相关系数分析真菌多样性指标与土壤理化性质相关性; 主成分分析采用SPSS22.0软件完成; 冗余分析采用Canoco5.0软件。
2 结果 2.1 不同盐生植被下土壤的理化性质据表 1可知,0~20 cm土层与20~40 cm土层中,马绊草、白茅、罗布麻群落覆被下土壤质地均与裸地和柽柳群落覆被下具有显著差异(P<0.05),其中马绊草、白茅、罗布麻群落覆被下砂粒含量显著低于裸地和柽柳群落,柽柳群落覆被下砂粒含量最高,0~20 cm土层为50.86%,20~40 cm土层为39.64%,均显著高于裸地; 马绊草、白茅、罗布麻群落覆被下粉粒含量显著高于裸地和柽柳群落,柽柳群落下粉粒含量为最低,其中,0~20 cm土层为45.10%,显著低于其余四种样地,20~40 cm土层为55.67%,与裸地差异不显著; 五种群落覆被下黏粒含量无显著差异(P>0.05);同一植物群落覆被下不同土层间土壤质地无显著差异(P>0.05)。0~20 cm土层中,白茅群落覆被下土壤含水率高达20.9%,显著高于其他样地(P<0.05);20~40 cm中,柽柳群落覆被下土壤含水率为7.86%,显著低于其他样地; 同一样地中20~40 cm土层土壤含水率低于0~20 cm土层,但差异不显著(P>0.05)。土壤温度在各样地中差异不显著,在0~20 cm土层中,土壤温度范围为21.50~31.88℃,裸地最高,白茅群落覆被下最低; 20~40 cm土层中温度范围为22.88~27.33℃,马绊草覆被下最高,白茅覆被下最低。
|
|
表 1 黄河三角洲盐生植被演替过程中土壤理化性质的比较 Table 1 Soil physicochemical properties relative to halophytic vegetation in succession in the Yellow River Delta |
在0~20 cm、20~40 cm土层,马绊草群落、白茅群落、罗布麻群落覆被下SOM均显著高于裸地和柽柳群落,其中,柽柳覆被下SOM含量最低,甚至低于裸地,0~20 cm土层含量为0.35 g·kg-1,与裸地差异不显著(P>0.05),在20~40 cm土层含量为0.27 g·kg-1,与裸地差异显著(P<0.05)。裸地土壤TN含量在0~20 cm、20~40 cm土层中均为最低,分别为0.24 g·kg-1、0.15 g·kg-1,显著低于其他四种植物样地(P<0.05),白茅群落覆被下TN含量最高,0~20 cm土层为0.71 g·kg-1,20~40 cm土层为0.55 g·kg-1,同一植物群落覆被下不同土层间TN差异不显著。四种耐盐植物群落覆被下AN含量较裸地相比均显著提高(P<0.05),而同一植物群落覆被下不同土层间AN差异不显著。相反,AP含量显著降低(P<0.05)且同一植物群落覆被下不同土层间具有显著差异(P<0.05)。本研究采用电导率(EC)表征土壤含盐量,柽柳、马绊草、白茅、罗布麻群落EC较裸地显著下降(P<0.05),0~20 cm土层的降幅分别为80.40%、65.97%、71.39%、68.00%,20~40 cm土层的降幅分别为86.21%、68.46%、78.76%、78.17%,差异显著(P<0.05)。相同样地不同深度土层SOM、TN、AN、AP、EC含量总体表现为0~20 cm>20~40 cm,即土层加深,养分含量降低,含盐量降低。
总体而言,随盐生植被从裸地-强耐盐植物群落-轻度耐盐植物群落正向演替过程中,土壤盐化程度逐渐降低,土壤理化性质发生显著变化,土壤质量呈现改善趋势。
2.2 不同盐生植被下土壤真菌碳源代谢水平的动态变化不同样地不同深度土层AWCD值变化如图 1,结果表明:0~20 cm和20~40 cm的土样中土壤真菌利用单一碳源的AWCD值均随时间的延长而增大,在24 h以内各样地AWCD全部低于0.1,真菌利用碳源的能力较低。这是因为接种培养后,土壤真菌需要24 h的滞后期以适应Biolog微平板的环境。
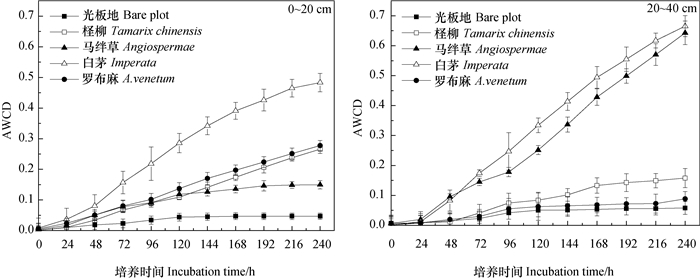
|
图 1 土壤真菌平均吸光值变化 Fig. 1 Change in average well color development (AWCD) of fungi |
由图 1可见,不同样地土壤真菌对碳源利用程度存在一定差异,4种耐盐植物群落覆被下真菌碳源利用程度均高于裸地。具体表现为:0~20 cm土层为白茅>罗布麻>柽柳>马绊草>裸地,即强耐盐植物群落下土壤真菌AWCD值显著高于裸地(P<0.05),轻度耐盐植物群落高于强耐盐植物群落,罗布麻群落作为轻度耐盐性植物群落,其AWCD值与强耐盐性植物群落尤其是柽柳群落的差异不显著(P>0.05)。20~40 cm土层则为白茅>马绊草>柽柳>罗布麻>裸地,罗布麻群落真菌碳源利用能力低于强耐盐植物群落,这可能与不同植物、不同土壤环境下根际分泌物的成分和数量对土壤中真菌的影响作用有关。白茅群落真菌碳源利用能力在0~20、20~40 cm土层均为最高,裸地最低。同一样地不同土层中,白茅和马绊草群落表现为0~20 cm<20~40 cm,而柽柳和罗布麻群落则表现为0~20 cm>20~40 cm,裸地的碳源利用能力相似。
2.3 不同盐生植被下土壤真菌多样性土壤真菌多样性指数可详尽反映真菌群落物种组成和个体数量分布情况,反映真菌功能多样性的不同侧面[18-19],从表 2可以看出,4种耐盐植物群落下0~20和20~40 cm土壤真菌群落的香农-威尔指数H、丰富度指数S、辛普森指数D均高于裸地。0~20 cm土层中,3种指数均表现为白茅>罗布麻>柽柳>马绊草>裸地,即轻度耐盐植物群落>强耐盐植物群落>裸地,且差异显著(P<0.05);而20~40 cm土层则表现为马绊草>白茅>柽柳>罗布麻>裸地,作为轻度耐盐植物的马绊草群落,其3种多样性指数值均最高,且与其他样地差异显著(P<0.05)。以上说明随盐生植被正向演替,改善了土壤中真菌群落的多样性和丰富度,提高了群落中常见物种的优势度。同一样地不同土层中,除马绊草群落,其余样地的3种指数均表现为0~20 cm>20~40 cm。
|
|
表 2 不同覆被类型下土壤真菌功能多样性指数 Table 2 Functional diversity indices of soil microbial communities relative to halophytic vegetation |
由相关分析(表 3)可知,0~20 cm土层中,AWCD值与全氮、碱解氮和过氧化氢酶活性呈现显著正相关(P<0.05),香农-威尔指数H与土壤盐度呈现显著负相关(P<0.05),与有机质含量呈现显著正相关(P<0.05),丰富度指数S与全氮、碱解氮、有机质及过氧化氢酶活性呈现显著正相关(P<0.05),且这三种多样性指数均与磷酸酶呈现显著正相关(P<0.05)。辛普森指数D与土壤含盐量呈现极显著负相关(P<0.01)。20~40 cm土层中,AWCD值、香农-威尔指数H和丰富度指数S与有机质含量以及磷酸酶呈现显著正相关(P<0.05),与过氧化氢酶呈现极显著正相关(P<0.01),此外,香农-威尔指数H和辛普森指数D与土壤含盐量呈现显著负相关(P<0.05),与全氮和碱解氮含量呈现显著正相关(P<0.05)。两土层中有效磷和脲酶均与AWCD值及各多样性指数无显著相关关系。土壤盐度、全氮、碱解氮、磷酸酶和过氧化氢酶是影响土壤真菌群落功能多样性的重要环境因子,说明盐生植被演替改变了土壤理化性质与微生物生物量,进而影响真菌的功能多样性。
|
|
表 3 平均吸光值、土壤真菌多样性指数与土壤理化性质相关性 Table 3 Correlation coefficient of average well color development and diversity indices of fungi communities with soil physicochemical properties |
主成分累计方差贡献率一般要求达到85%[20],对Biolog-FF微平板上95种碳源的代谢情况进行主成分分析。提取主成分要求相对应特征值大于1,据此原则提取前3个主成分,累计贡献率可达88.62%,其中PC1轴贡献率为52.18%,PC2轴贡献率为19.28%,真菌碳源代谢主成分分析结果如图 2所示。结果表明,不同盐生植被下土壤真菌PC值出现了明显的分布差异,大体可以分为三大类:0~20 cm土层下的白茅群落、罗布麻群落及20~40 cm土层下的白茅群落、马绊草群落均分布在PC1轴正方向,PC2轴正方向; 0~20 cm土层下的裸地群落、马绊草群落均分布在PC1轴负方向,PC2轴负方向; 其余群落均分布在PC1轴负方向,PC2轴正方向。各样地在0~20与20~40 cm土层下利用的碳源发生较好分离,说明土层加深明显改变了真菌群落的碳源利用能力。
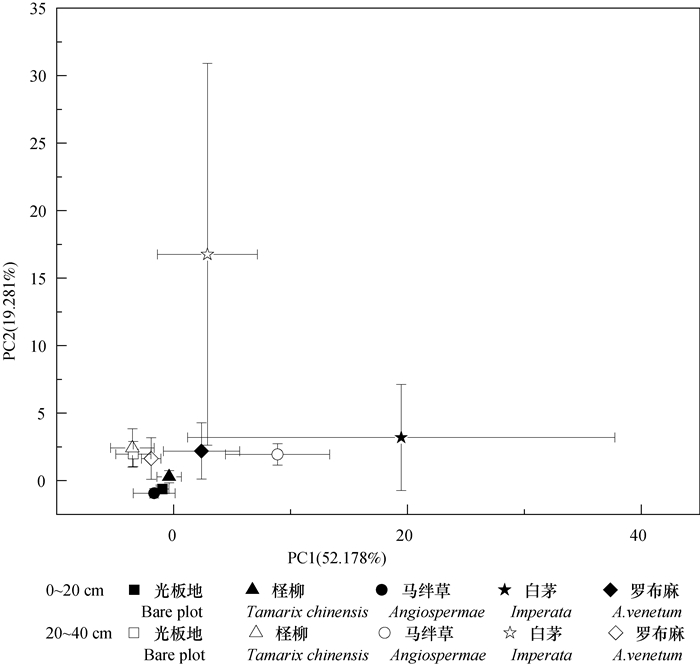
|
图 2 土壤真菌碳源代谢特征分析 Fig. 2 Analysis of carbon source metabolism characteristic of soil fungi |
不同土层下土壤真菌碳源代谢利用种类也会发生差异。总体而言,糖类、醇类和酸类是控制土壤真菌碳源代谢发生差异的主要碳源。其中,0~20 cm土层利用的主要碳源种类有纤维醇、鸟氨酸、D-甘露醇等44种,而在20~40 cm的土层中,利用的主要碳源有D-山梨醇、丙三醇、L-天冬氨酸等39种。
2.5 土壤理化性质对真菌功能多样性的影响为探讨环境因子对土壤真菌代谢特征的影响,选择冗余分析(RDA)对环境梯度进行直接排序。Axis1与Axis2的累积解释变量在0~20、20~40 cm土层分别达96.58%、97.22%,说明土壤理化性质对土壤真菌的代谢特征有较大影响。其中,在0~20 cm土层,Axis1与TN、AN、SOM、磷酸酶、脲酶、过氧化氢酶呈正相关,与EC、AP呈负相关,Axis2与AN、EC、SOM、AP、脲酶呈正相关,与TN、磷酸酶、过氧化氢酶呈负相关,TN、磷酸酶和过氧化氢酶对真菌碳源代谢特征影响高于其他理化性质。在20~40 cm土层Axis1与TN、AN、SOM、磷酸酶、脲酶、过氧化氢酶呈正相关,与EC、AP呈负相关,Axis2与磷酸酶、脲酶呈正相关,与TN、AN、EC、SOM、AP、过氧化氢酶呈负相关,SOM、AP、过氧化氢酶对真菌的代谢特征高于其他理化性质。
3 讨论 3.1 盐生植被演替对土壤真菌群落碳源代谢活性的影响研究结果显示,在盐生植被正向演替过程中,0~20与20~40 cm土层土壤真菌的AWCD值和各多样性指数的变化规律基本一致,均表现为轻度耐盐植物群落>强耐盐植物群落>裸地,说明土壤真菌的代谢活性和功能多样性均有一定的提高,这与周凤等[21]的研究结果相近。主成分分析表明糖类、醇类和酸类是控制碳源代谢利用发生差异的主要碳源。有研究发现,微生物碳源利用能力增强可以反映相应微生物种群数量的增加[22]。王艳云等[23]研究发现,随盐生植被正向演替,土壤中真菌丰富度逐渐增加,且不同演替阶段真菌群落结构组成差异较大。真菌群落结构的差异改变了其代谢功能,从而对生态系统进程产生一定影响[24]。微生物碳源代谢差异与地上植被类型更替关系密切,地上植被更替使土壤中凋落物和根系分泌物产生变化,从而引起土壤中微生物群落组成的改变,进而影响其代谢功能[25]。在盐生植被正向演替的过程中,由于根系间的交错叠加作用,根系分泌物更加丰富,使根系土壤中的维生素、碳水化合物、氨基酸和有机酸等物质更加丰富,为根际真菌的生存和繁衍提供了所需能源和营养物质,且在盐生植被正向演替过程中,不同植物会产生不同的根系特异分泌物,从而形成与之相适应的根际真菌群落,提高土壤真菌的整体代谢活性,促进了土壤真菌群落结构多样化的形成。根际是根系分泌物和土壤生物之间形成的独特群落环境。根系分泌物发生微小改变能够导致根际微生物区系发生极大改变,它是联系植物和根际微生物的重要环境因子[26]。纳小凡等[27]的研究也证明植物根与土壤微生物之间存在相互选择和作用。除马绊草群落外,其他样地真菌代谢功能均有随土层加深而降低的趋势,张志政等[28]发现,土壤微生物数量随土壤深度的增加而显著减少。另一重要原因是表层土壤较深层土壤有更丰富的凋落物和根系分泌物为微生物提供养分,有利于微生物的生长[29]。由于植株根系代谢为根际微生物提供较多的碳源,使得根际土壤微生物数量以及多样性均高于非根际,根系调整自身分泌物的组成和数量来积极响应土壤环境的变化[30],随着土层加深,土壤环境发生改变,根系分泌物的组成和数量随之改变,从而影响真菌的数量和代谢功能。
3.2 盐生植被演替中土壤理化性质变化对真菌群落碳源代谢活性的影响随盐生植被正向演替,地上植物的种类不断增加,对土壤理化性质产生重要影响,而微生物代谢功能的变化与地上植被演替过程中土壤理化性质关系密切[31]。土壤水分、有机质、碱解氮、有效磷等因子是影响土壤微生物群落组成的重要环境因子,这些因子的改变能够影响微生物生存的微环境,进而影响微生物的种类、活性及分布[32-33]。由图 3可知,不同土层下土壤理化性质对真菌碳源代谢活性影响基本一致,土壤含盐量和有效磷含量均与真菌碳源代谢活性呈现负相关,而其他理化性质则与真菌碳源代谢活性呈正相关,电导率、全氮、碱解氮和有机质是控制土壤真菌碳源代谢的主要因素。有研究指出,随着土壤含盐量的增加,土壤微生物数量呈明显的下降趋势[34]。由于土壤盐分不仅能够影响土壤对CO2的释放,同时也能显著抑制土壤微生物活性,造成微生物种类和数量减少,因此,土壤盐分含量越高,土壤微生物碳源代谢能力越弱[35-36]。Muhammad等[37]认为,土壤盐碱化程度的降低会促进微生物对有机质的分解作用。随着盐生植被的正向演替,土壤含盐量不断降低,而全氮、碱解氮和有机质的含量不断升高,土壤环境不断优化,进而使土壤真菌群落结构朝着更加稳定的方向发展。研究发现,随土层加深,土壤理化性质均发生改变,植物根系分布逐渐减少,土壤水、气、热等生态因子逐渐限制土壤微生物正常活动,使其代谢功能逐渐降低[38-39]。
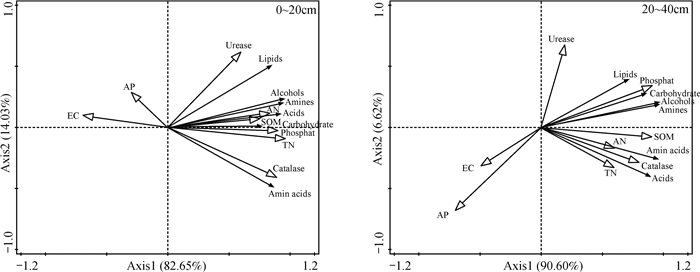
|
图 3 土壤理化性质对真菌功能多样性的影响 Fig. 3 Analysis of the influence of soil physicochemical properties on soil fungus community |
随盐生植被正向演替,土壤盐化程度逐渐降低,土壤质量不断改善,土壤真菌群落结构朝着更加稳定的方向发展。随着盐生植被在“裸地-强耐盐性植物-轻度耐盐性植物”的演替过程中,土壤真菌AWCD值显著提高(P<0.05),白茅群落的真菌代谢活性在两个土层中均最高。土壤真菌群落的香农-威尔指数H、丰富度指数S、辛普森指数D表现为轻度耐盐性植物>强耐盐性植物>裸地,且差异显著; 除马绊草群落,其余样地的三种指数值表现为0~20 cm大于20~40 cm土层。电导率、全氮、碱解氮和有机质是控制土壤真菌碳源代谢的主要因素。土壤盐度对真菌生长具有显著抑制作用。不同土层下土壤真菌碳源利用种类也会发生差异,而糖类、醇类和酸类是控制土壤真菌碳源代谢发生差异的主要碳源。
| [1] |
Xu Z, Yu G, Zhang X, et al. Biogeographical patterns of soil microbial community as influenced by soil characteristics and climate across Chinese forest biomes. Applied Soil Ecology
(  0) 0) |
| [2] |
景宇鹏, 李跃进, 姚一萍, 等. 盐渍化土壤酶活性及其与微生物、理化因子的关系. 中国农业科技导报, 2016, 18(2): 128-138. Jing Y P, Li Y J, Yao Y P, et al. Enzyme activities of saline-alkali soil and its relationship with soil microbial biomass and physicochemical factor (In Chinese). Journal of Agricultural Science and Technology, 2016, 18(2): 128-138. (  0) 0) |
| [3] |
刘志梅, 陆兆华, 梁震, 等. 造纸废水灌溉对黄河三角洲退化湿地可培养土壤微生物的影响. 环境工程学报, 2011, 5(7): 1491-1496. Liu Z M, Lu Z H, Liang Z, et al. Effect of irrigation with papermaking wastewater on incubation soil microbes of degraded wetland in Yellow River Delta (In Chinese). Chinese Journal of Environmental Engineering, 2011, 5(7): 1491-1496. (  0) 0) |
| [4] |
Cong M Y, Cao D, Sun J K, et al. Soil microbial community structure evolution along halophyte succession in Bohai Bay wetland . Journal of Chemistry, 2014.
(  0) 0) |
| [5] |
夏品华, 寇永珍, 喻理飞. 喀斯特高原退化湿地草海土壤微生物群落碳源代谢活性研究. 环境科学学报, 2015, 35(8): 2549-2555. Xia P H, Kou Y Z, Yu L F. Carbon metabolic soil microbial community in Caohai Karst Plateau degraded wetland:A case study in southwest China (In Chinese). Acta Scientiae Circumstantiae, 2015, 35(8): 2549-2555. (  0) 0) |
| [6] |
张晶, 张惠文, 李新宇, 等. 土壤真菌多样性及分子生态学研究进展. 应用生态学报, 2004, 15(10): 1958-1962. Zhang J, Zhang H W, Li X Y, et al. Research advances in soil fungal diversity and molecular ecology (In Chinese). Chinese Journal of Applied Ecology, 2004, 15(10): 1958-1962. DOI:10.3321/j.issn:1001-9332.2004.10.051 (  0) 0) |
| [7] |
王继伟, 巨天珍, 曹春, 等. 甘肃小陇山日本落叶松人工林土壤优势真菌多样性探讨. 干旱区资源与环境, 2013, 27(3): 173-176. Wang J W, Ju T Z, Cao C, et al. The diversity discuss on soil dominant fungi in the pure Larix kaempferi plantations of Xiaolongshan of Tianshui City in Gansu (In Chinese). Journal of Arid Land Resources and Environment, 2013, 27(3): 173-176. (  0) 0) |
| [8] |
徐祖祥, 祝小祥, 徐进, 等. 临安雷竹林施肥现状及问题的分析. 农学学报, 2015, 5(5): 53-56. Xu Z X, Zhu X X, Xu J, et al. The status and problem analysis of fertilization in the bamboo forest in Lin'an (In Chinese). Journal of Agriculture, 2015, 5(5): 53-56. (  0) 0) |
| [9] |
Brito I, Goss M J, Carvalho M D, et al. Impact of tillage system on arbuscular mycorrhiza fungal communities in the soil under Mediterranean conditions . Soil & Tillage Research, 2012, 121: 63-67.
(  0) 0) |
| [10] |
董艳, 汤利, 郑毅, 等. 施氮对间作蚕豆根际微生物区系和枯萎病发生的影响. 生态学报, 2010, 30(7): 1797-1805. Dong Y, Tang L, Zheng Y, et al. Effects of N application on rhizosphere microflora and fusarium wilt occurrence of intercroped faba bean (In Chinese). Acta Ecologica Sinica, 2010, 30(7): 1797-1805. (  0) 0) |
| [11] |
Kumar U, Shahid M, Tripathi R, et al. Variation of functional diversity of soil microbial community insub-humid tropical rice-rice cropping system under long-termorganic and inorganic fertilization . Ecological Indicators, 2017, 73: 536-543. DOI:10.1016/j.ecolind.2016.10.014
(  0) 0) |
| [12] |
王晶晶, 樊伟, 崔珺, 等. 氮磷添加对亚热带常绿阔叶林土壤微生物群落特征的影响. 生态学报, 2017, 37(24): 8361-8373. Wang J J, Fan W, Cui J, et al. Effects of nitrogen and phosphorus addition on soil microbial community characteristics in a subtropical evergreen broadleaved forest (In Chinese). Acta Ecologica Sinica, 2017, 37(24): 8361-8373. (  0) 0) |
| [13] |
杨有芳, 字洪标, 刘敏, 等. 高寒草甸土壤微生物群落功能多样性对广布弓背蚁蚁丘扰动的响应. 草业学报, 2017, 26(1): 43-53. Yang Y F, Zi H B, Liu M, et al. Responses of soil microbial community functional diversity to Camponotus herculeanus ant-hill disturbance in alpine meadows (In Chinese). Acta Prataculturae Sinica, 2017, 26(1): 43-53. (  0) 0) |
| [14] |
滕应, 黄昌勇, 骆永明, 等. 铅锌银尾矿区土壤微生物活性及其群落功能多样性研究. 土壤学报, 2004, 41(1): 113-119. Teng Y, Huang C Y, Luo Y M, et al. Microbial activities and functional diversity of community in soils polluted with Pb-Zn-Ag mine tailings (In Chinese). Acta Pedologica Sinica, 2004, 41(1): 113-119. DOI:10.3321/j.issn:0564-3929.2004.01.019 (  0) 0) |
| [15] |
张崇淼, 马宇超, 牛全睿, 等. 渐增NaCl对印染废水处理系统活性污泥微生物的影响. 工业水处理, 2017, 37(2): 33-37. Zhang C M, Ma Y C, Niu Q R, et al. Influences of gradual-increase NaCl on the activated sludge microbes in dyeing wastewater treatment systems (In Chinese). Industrial Water Treatment, 2017, 37(2): 33-37. (  0) 0) |
| [16] |
王艳霞, 冯宏, 李华兴, 等. 生物复混肥对土壤微生物的影响研究. 植物营养与肥料学报, 2008, 14(6): 1206-1211. Wang Y X, Feng H, Li H X, et al. Effects of bio-compound fertilizer on soil microorganism (In Chinese). Plant Nutrition and Fertilizer Science, 2008, 14(6): 1206-1211. DOI:10.3321/j.issn:1008-505X.2008.06.028 (  0) 0) |
| [17] |
Kettler T A, Doran J W, Gilbert T L. Simplified method for soil particle-size determination to accompany soil-quality analyses . Soil Science Society of America Journal, 2001, 65(3): 849-852. DOI:10.2136/sssaj2001.653849x
(  0) 0) |
| [18] |
黄红艳.次生盐渍化土壤的微生物多样性及微生物改良效应研究.上海: 上海交通大学, 2012 Huang H Y. Soil microbal diversity in secondary salinization soils and it's microbial remidation(In Chinese). Shanghai: Shanghai Jiao Tong University, 2012 (  0) 0) |
| [19] |
夏江宝, 许景伟, 李传荣, 等. 黄河三角洲退化刺槐林不同改造方式对土壤酶活性及理化性质的影响. 水土保持通报, 2012, 32(5): 171-175. Xia J B, Xu J W, Li C R, et al. Effects of different improving patterns for degraded Robinia pseucdoacacia plantation on soil enzyme activity and physicochemical properties in Yellow River Delta (In Chinese). Bulletin of Soil and Water Conservation, 2012, 32(5): 171-175. (  0) 0) |
| [20] |
郝黎仁, 樊元, 郝哲欧, 等. SPSS实用统计分析. 北京: 中国水利水电出版社, 2003. Hao L R, Fan Y, Hao Z O, et al. Statistical analysis of SPSS (In Chinese). Beijing: China Water and Power Press, 2003. (  0) 0) |
| [21] |
周凤, 许晨阳, 金永亮, 等. 生物炭对土壤微生物C源代谢活性的影响. 中国环境科学, 2017, 37(11): 4202-4211. Zhou F, Xu C Y, Jin Y L, et al. Effect of biochar on metabolic activity of soil microbial carbon (In Chinese). China Environmental Science, 2017, 37(11): 4202-4211. DOI:10.3969/j.issn.1000-6923.2017.11.025 (  0) 0) |
| [22] |
马玲, 马琨, 汤梦洁, 等. 间作与接种AMF对连作土壤微生物群落结构与功能的影响. 生态环境学报, 2013, 32(8): 1341-1347. Ma L, Ma K, Tang M J, et al. Effects of intecropping and inoculation of AMF on the microbial community structure and function of continuous cropping soil (In Chinese). Ecology and Environmental Sciences, 2013, 32(8): 1341-1347. DOI:10.3969/j.issn.1674-5906.2013.08.011 (  0) 0) |
| [23] |
王艳云, 姜爱霞, 郭笃发. 黄河三角洲土壤真菌群落结构对盐生植被演替的响应. 环境科学学报, 2016, 36(11): 4146-4152. Wang Y Y, Jiang A X, Guo D F. Response of soil fungal community structure to halophytic vegetation succession in the Yellow River Delta (In Chinese). Acta Scientiae Circumstantiae, 2016, 36(11): 4146-4152. (  0) 0) |
| [24] |
Caracciolo A B, Bustamante M A, Nogues I, et al. Changes in microbial community structure and functioning of a semiarid soildue to the use of anaerobic digestate derived composts and rosemary plants . Geoderma, 2015, 245/246: 89-97. DOI:10.1016/j.geoderma.2015.01.021
(  0) 0) |
| [25] |
Urbanová M, Šnajdr J, Baldrian P. Composition of fungal and bacterial communities in forest litter and soil is largely determined by dominant trees . Soil Biology & Biochemistry, 2015, 84: 53-64.
(  0) 0) |
| [26] |
Haichar F E Z, Santaella C, Heulin T, et al. Root exudates mediated interactions belowground . Soil Biology & Biochemistry, 2014, 77(7): 69-80.
(  0) 0) |
| [27] |
纳小凡, 郑国旗, 邢正操, 等. 连作对再植枸杞根际细菌群落多样性和群落结构的影响. 土壤学报, 2017, 54(5): 1280-1292. Na X F, Zheng G Q, Xing Z C, et al. Effects of monocropping on diversity and structure of the bacterial community in rhizosphere of replanted Lycium barbarum L. (In Chinese). Acta Pedologica Sinica, 2017, 54(5): 1280-1292. (  0) 0) |
| [28] |
张志政, 马淼, 张旭龙. 深松对乌拉尔甘草根际土壤养分以及微生物群落功能多样性的影响. 生态学报, 2017, 37(15): 5137-5145. Zhang Z Z, Ma M, Zhang X L. Effect of subsoiling on soil nutrient and microbe functional diversity of Glycyrrhiza uralensis rhizospheres (In Chinese). Acta Ecologica Sinica, 2017, 37(15): 5137-5145. (  0) 0) |
| [29] |
Murphy D V, Cookson W R, Braimbridge M, et al. Relationships between soil organic matter and the soil microbial biomass(size, functional diversity, and community structure)in crop and pasture systems in a semi-arid environment . Soil Research, 2011, 49(7): 582-594. DOI:10.1071/SR11203
(  0) 0) |
| [30] |
Walker T S, Bais H P, Grotewold E, et al. Root exudation and rhizosphere biology . Plant Physiology, 2003, 132(1): 44-51. DOI:10.1104/pp.102.019661
(  0) 0) |
| [31] |
王晓峰, 汪思龙, 张伟东. 杉木凋落物对土壤有机碳分解及微生物生物量碳的影响. 应用生态学报, 2013, 24(9): 2393-2398. Wang X F, Wang S L, Zhang W D. Effects of Chinese fir litter on soil organic carbon decomposition and microbial biomass carbon (In Chinese). Chinese Journal of Applied Ecology, 2013, 24(9): 2393-2398. (  0) 0) |
| [32] |
杨东伟, 章明奎, 张鹏启, 等. 水田改果园后土壤微生物学特性演变. 土壤学报, 2018, 55(1): 182-193. Yang D W, Zhang M K, Zhang P Q, et al. Evolution of soil in microbiology after reclamation of paddy into orchard (In Chinese). Acta Pedologica Sinica, 2018, 55(1): 182-193. (  0) 0) |
| [33] |
Hoogmoed M, Cunningham S C, Baker P, et al. N-fixing trees in restoration plantings:Effects on nitrogen supply and soil microbial communities . Soil Biology & Biochemistry, 2014, 77(7): 203-212.
(  0) 0) |
| [34] |
牛世全, 杨建文, 胡磊, 等. 河西走廊春季不同盐碱土壤中微生物数量、酶活性与理化因子的关系. 微生物学通报, 2012, 39(3): 416-427. Niu S Q, Yang J W, Hu L, et al. Relationship with soil microbial quantity, soil enzyme activity and physicochemical factor between different salinealkali soil in Hexi Corridor in spring (In Chinese). Microbiology China, 2012, 39(3): 416-427. (  0) 0) |
| [35] |
王笛, 马风云, 姚秀粉, 等. 黄河三角洲退化湿地土壤养分、微生物与土壤酶特性及其关系分析. 中国水土保持科学, 2012, 10(5): 94-98. Wang D, Ma F Y, Yao X F, et al. Properties of soil microbes, nutrients and soil enzyme activities and their relationship in a degraded wetland of Yellow River Delta (In Chinese). Science of Soil and Water Conservation, 2012, 10(5): 94-98. DOI:10.3969/j.issn.1672-3007.2012.05.015 (  0) 0) |
| [36] |
翁永玲, 宫鹏. 黄河三角洲盐渍土盐分特征研究. 南京大学学报(自然科学), 2006, 42(6): 602-610. Weng Y L, Gong P. Soil salinity measurements on the Yellow River Delta (In Chinese). Journal of Nanjing University(Natural Sciences), 2006, 42(6): 602-610. (  0) 0) |
| [37] |
Muhammad S, MüLler T, Joergensen R G. Relationships between soil biological and other soil properties in saline and alkaline arable soils from the Pakistani Punjab . Journal of Arid Environments, 2008, 72(4): 448-457. DOI:10.1016/j.jaridenv.2007.06.016
(  0) 0) |
| [38] |
Chen X L, Wang D, Chen X, et al. Soil microbial functional diversity and biomass as affected by different thinning intensities in a Chinese fir plantation . Applied Soil Ecology, 2015, 92: 35-44. DOI:10.1016/j.apsoil.2015.01.018
(  0) 0) |
| [39] |
燕辉, 刘广全, 李红生. 青杨人工林根系生物量、表面积和根长密度变化. 应用生态学报, 2010, 21(11): 2763-2768. Yan H, Liu G Q, Li H S. Changes of root biomass, root surface area, and root length density in a Populus cathayana plantation (In Chinese). Chinese Journal of Applied Ecology, 2010, 21(11): 2763-2768. (  0) 0) |
 2018, Vol. 55
2018, Vol. 55


