2. 安顺学院/贵州省科技厅土壤污染控制与修复工程技术中心,贵州安顺 561000;
3. 武汉贝纳科技服务有限公司,湖北武汉 430070
山药(Dioscorea opposita)为薯蓣科多年生草质藤本植物,其地下根茎为主要利用器官,是我国传统的药食同源植物。现代药理研究表明,山药具有抗衰老、调节免疫、抗肿瘤、降血糖等作用,其主要化学成分有多糖、尿囊素、皂甙等[1]。我国栽培山药历史悠久,由于栽培的地域环境条件不同和人工选择的原因,形成了各具特色的地方品种。贵州安顺山药因口感软糯,富含蛋白质、多糖等成为大众喜爱的品种之一。土壤生态环境因子、养分状况是影响植物生长及品质形成的主要因素,随着人们对土壤微生物生态因子重要性认识的不断深入,将土壤微生物学特性作为评价土壤质量和健康程度的相应指标已广受关注,其结果可用于指导生产实践[2]。陆地生态系统中的土壤微生物群落多样性受到土壤养分的显著影响[3]。研究表明,山药连作会破坏土壤耕层微生物种群结构,抑制土壤酶活性,可能导致山药连作障碍[4]。随着山药种植规模的扩大,为保证其优良品质,推行规范化种植,开展了大量栽培管理措施、施肥及土传病害防治方面的研究,然而结合土壤微生物群落结构及其多样性,分析其与土壤化学性质、根茎营养成分关系方面的研究鲜有报道。高通量测序技术具有可全面、准确获得微生物群落结构信息的特点,已被广泛应用于微生物研究中[5-7]。本研究采用高通量测序技术,通过提取不同环境土壤样品的DNA,选择合适的通用引物扩增16S的目标区域,检测目标区域的序列变异和丰度,分析环境中细菌群落结构及其多样性,结合根际土壤养分状况及部分酶活性的检测,研究山药根际土壤中细菌群落特征与土壤养分、根茎糖类含量的关系,阐明影响山药根茎中营养物质累积的重要土壤生态因子,对于研究山药种植专用生物肥料及其种植土壤环境评价提供数据参考。
1 材料与方法 1.1 供试材料前期对安顺4个山药种植区山药营养成分的分析发现,不同种植区的山药根茎在灰分、粗纤维和蛋白质的质量分数上有显著差异[8],因此本研究选取安顺市辖区内7个集中种植山药的村寨(表 1)采集样本,每个村寨选取连续种植山药2年的有代表性的5个地块作为样本(5个重复)。于2017年3月10日至30日期间整地并施基肥后,用薯蓣科薯蓣属植物山药(经安顺学院农学院沈昱翔副教授鉴定)芦头种植。于2017年10月3日至15日期间采集土壤样品及山药样品,每个地块按5点取样法,将山药根茎采挖出后,抖落根茎上附着的土壤作为根际土壤,混匀后储存于无菌自封袋中,按表 1编号后低温运输,-20℃冰箱保存。土壤均为黄棕壤。
|
|
表 1 研究样本基本情况 Table 1 Basic information of the experiment plots of the study |
采用土壤DNA提取试剂盒(北京索莱宝科技有限公司)提取土壤样本总DNA,经紫外分光光度计(上海元析仪器设备有限公司)测定纯度,1%琼脂糖凝胶电泳检测后,用DNA回收试剂盒回收,于-20℃保存备用。
以提取的总DNA为模板,采用16SrDNA V3-V4区引物(上海生工生物工程技术服务有限公司):338F:(5′-ACTCCTACGGGAGGCAGCAG-3′),806R:(5′-GGACTACHVGGGTWTCTAAT-3′)进行PCR扩增(上海精宏实验设备有限公司)。PCR反应条件:94℃预变性4 min,94℃变性30 s,55℃退火30 s,72℃延伸45 s,35个循环,最后72℃延伸10 min。PCR产物采用琼脂糖凝胶DNA回收试剂盒(TIANGEN)回收目的条带,使用Qubit荧光定量系统对回收产物进行检测定量,等量混合不同样品PCR回收产物,构建高通量测序文库,IlluminaHiseq 2500上机测序。
1.3 根际土壤生态指标及根茎糖类指标检测土壤化学性质采用常规分析方法[9],总有机碳采用高温外热重铬酸钾氧化容量法,碱解氮采用碱解扩散法,有效磷采用0.5mol·L-1NaHCO3浸提—钼蓝比色法,速效钾采用1mol·L-1NH4OAc浸提—火焰分光光度法,pH用电位法(酸度计)。
土壤酶活性测定[10]:过氧化氢酶活性测定采用容量法(以KMnO4计,mL·g-1·30min-1),蔗糖酶活性测定采用3,5-二硝基水杨酸比色法,脲酶活性测定采用靛酚蓝比色法,磷酸酶活性测定采用磷酸苯二钠(4-氨基安替比林)比色法。
山药根茎糖类指标检测:可溶性糖、淀粉含量测定[11]采用硫酸蒽酮法和高氯酸法;粗多糖测定[12]采用85%乙醇除去低聚糖、单糖、双糖等,用95℃水浴水提后硫酸蒽酮显色,于620 nm波长下比色法测定;粗蛋白含量测定采用GB/T5009.5-2010中的分光光度法。
1.4 数据处理样品经IlluminaHiseq 2500测序进行PE250双端测序后,对获得的原始测序序列进行过滤和质控,通过质量分值衡量测序序列的质量和拼接效果,选取长度大于100bp,平均质量分值> 20,拼接序列重叠区域错配率小于20%的序列作为有效序列,进行下游分析。以97%水平的SILVA数据库为参考,计算OTUs的丰度。
采用QIIME软件进行α多样性分析,包括香农指数、Chao1指数、文库覆盖率。采用QIIME分析流程,使用UniFrace方法进行β多样性分析。
采用Vegan软件进行典型相关分析(Canonical Correlation Analysis, CCA)。使用R软件做环境因子与物种丰度的相关性分析。
2 结果 2.1 根际土壤生态特性与根茎营养成分含量从表 2可见,7个样本土壤偏酸性,且其养分含量及酶活性均有显著差异。表 3可见,7个样本的山药根茎中4种营养成分含量也呈现一定差异。对根际土壤的化学性质与山药根茎中营养成分相关性的分析(表略)可知,碱解氮与有机质呈极显著正相关(相关系数为0.877),过氧化氢酶与有效磷呈显著正相关(相关系数为0.811),山药根茎中粗多糖与根际土壤的有机质呈显著正相关(相关系数为0.770),可溶性糖与土壤有机质、全氮及碱解氮含量呈极正显著相关或显著正相关(相关系数分别为0.942、0.810、0.790),上述结果说明土壤碳、氮养分能够促进山药根茎中糖的积累。
|
|
表 2 山药根际土壤生态特性 Table 2 Ecological characteristic of the rhizosphere soil of Chinese yam |
|
|
表 3 山药根茎中营养成分含量 Table 3 Nutrient contents in rhizome of Chinese yam /(g·100g-1) |
高通量测序数据经过滤、质控后,对7个样本随机抽取的有效序列所对应的稀释曲线分析,结果表明深度测序已接近饱和,可用于后续分析。在97%相似水平下的OTU进行生物信息统计分析。图 1显示了“门”水平的物种相对丰度。从统计结果可知,相对丰度大于1%的菌群有9个,分别为变形菌门(31.0%)、绿弯菌门(22.8%)、酸杆菌门(22.7%)、放线菌门(8.6%)、拟杆菌门(4.3%)、厚壁菌门(3.1%)、奇古菌门(1.5%)、芽单胞菌门(1.3%)和硝化螺旋菌门(1.1%)。从数据分析结果可见,变形菌,绿弯菌和酸杆菌、放线菌是优势种群(相对丰度 > 5%),它们的相对丰度均大于5%,占了总序列的85.1%;此外还发现了相对丰度小于1%的其他44个稀有门类,但分布不均匀,仅在部分样本中发现。在“属”水平上进行分析,7个样本中均发现慢生根瘤菌属(1.4%),5个样本(S2, S3, S5, S6, S7)发现假单胞菌属(0.4%)。从结构来看,表现为7个样本共有大多数相同的细菌群落,但也存在一定差异。已有研究表明土壤pH、有机碳和全氮是土壤细菌群落结构和多样性的主导因子[13],据此分析认为本研究7个样本的细菌群落结构存在差异的原因可能与土壤理化性质有关。

|
图 1 各样本在门水平的物种相对丰度条形图 Fig. 1 Relative abundances of the species of bactera in the samples at the phylum level in bar chart |
香农指数反映物种丰富度和均度的影响,用于说明微生物群落分布的均匀度,其数值大小主要衡量非均衡分布状况。Chao1指数仅简单指群落中物种的多样性,不考虑丰度情况。对表 4的两种多样性指数进行比较,结果表明S5、S6、S7这3个样本的细菌群落物种丰度、多样性和均度比较接近;S1、S2和S4样本的在一个水平;而S3样本的菌群丰度、多样性与均度与其余样本比较处于中间。从细菌群落多样性指数上可将7个样本分为3个类别。经相关性分析发现,香农指数与Chao1指数和土壤磷酸酶活性为显著相关(相关系数分别为-0.644**和-0.506*),说明在山药根际土壤中细菌群落的多样性对磷酸酶活性有较大影响。
|
|
表 4 α多样性指数统计 Table 4 Statistics of α diversity indices |
在β多样性研究中,PCoA(Principal coordinate analysis)是基于UniFrace的主坐标分析,可直观显示不同样品中微生物进化上的相似性或差异性。图 2显示了在菌群β多样性中各样本的特征贡献值,其中S5、S6、S7样本的菌群多样性占71.44%,为菌群多样性的主要贡献者,与α多样性分析结果相互印证。

|
图 2 样本主坐标分析 Fig. 2 Sample principal coordinate analysis |
采用LEfSe分析检测不同组别中具有显著丰度差异特征的菌群。从图 3a可知,除平寨村(S2)外的6个样本在多个菌群丰度上存在显著差异,其中放线菌、绿弯菌、酸杆菌、变形菌分别在不同组别中起重要作用,说明这几个优势菌群对于土壤细菌群落结构产生重要影响。图 3b将7个细菌门在6个不同样本中的门、纲、目、科、属水平的差异信息用饼形图表示,其中最大的变形菌门菌群类别较多(见图 3b,a1~a9,b0~b4),且差异明显;乐平村(S6)土壤中所含细菌群落种类较丰富,且与其他样本的差异明显,与多样性指数分析的结果一致。

|
注:a)为LDA分析结果,通过线性回归分析两个组别当中有显著作用的细菌类群。b)为6个样本中细菌群落由门至属(或种)的分类级别差异,右边图例为不同分类水平上菌群的名称。图中的每一个小圆圈代表该水平下的一个分类,从内到位的圈,分别是不同的分类水平的分类树,圆圈直径大小与相对丰度大小呈正比;不同的分组用不同的颜色区分,其中不同的颜色节点表示在相应颜色组别中起到重要作用的微生物类群,黄色节点表示的是在所有组中均没有起到重要作用的微生物类群 Note: a) shows results of LDA analysis, and bacterial groups with significant effects among the two plots through linear regression analysis. b) shows differences in classification level from phylum to genus (or species) in classification of soil bacteria in the six samples, and in the diagram on the right are listed names of bacterial groups at different classification levels. Each small circle in the figure represents a taxon at a set classification level. The concentric circles from inside to outside represent classification trees at different classification levels. Different groups are coloured differently, indicating that the microbial groups plays an important role in the group correspondingly colored, while yellow dots represent the microbial groups that do not play any important role in all the groups 图 3 菌群统计结果 Fig. 3 Statistics chart of microflora |
CCA分析结果可反映菌群与环境因子之间的关系,从中可知影响样品分布的重要环境驱动因子。
从图 4a可见,土壤化学指标可聚为两类,其中pH与样本中细菌群落分布的相关性最大,且位于第Ⅲ、Ⅳ象限之间的轴上,与AP、AK、TOC、TN呈正相关,而与碱解氮呈负相关。
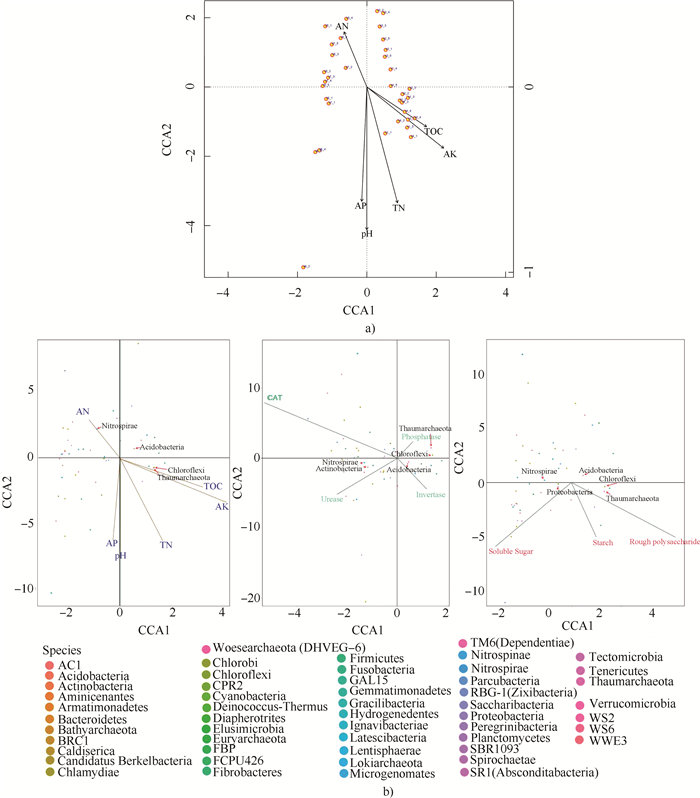
|
a),样本与理化指标相关分析CCA analysis of sample andphysico-chemical indices;b),细菌群落与理化指标、酶活性及根茎糖类含量相关性Correlations of bacteria community withphysico-chemical indices, enzyme activities, saccharide content in rhizome 注:图中箭头表示环境因子(或糖类物质),箭头连线的长度示某个环境因子与物种分布相关的大小,箭头越长,说明相关越大。环境因子与物种之间的夹脚为锐角时表示该物种与环境因子之间呈正相关,钝角时则呈负相关。箭头连线和物种的夹角(以中心的十字为角的顶点)代表某个环境因子与物种相关性大小,夹脚越小,相关性越高;反之越低。TOC表示总有机碳,AN表示碱解氮,AP表示有效磷,AK表示速效钾,CAT表示过氧化氢酶,Invertase表示蔗糖酶,Urease表示脲酶,Phosphatase表示磷酸酶,Solublesugar表示可溶性糖,Starch表示淀粉,Roughpolysaccharide表示粗多糖 Note:Arrows in the picture mean environmental factors, and length of the line with an arrow denotes extent of the correlation between environmental factors and bacterial species. The longer the arrow, the closer the relationship. The angle between environmental factors and bacterial species is acute, signifying positive relationship, otherwise, negative relationship. The angle between the line with an arrow and bacterial species (with the cross in the center being the vertex of the angle) suggests extent of the relationship. The sharper the angle, the closer the relationship, and the duller, the looser. TOC stands for total organic carbon, AN for alkalytic nitrogen, AP for available phosphorus, AK for available potassium, CAT for catalase, invertase for sucrase 图 4 山药根际土壤理化指标与样本及细菌群落CCA分析 Fig. 4 CCA analysis of soil physicochemical indexes and bacterial communities in yam rhizosphere |
图 4b中优势菌群绿弯菌、奇古菌与TOC、AK、TN、AP和pH这5个环境因子呈正相关;而酸杆菌与pH、AP呈负相关,与TOC、AK呈正相关,进一步说明土壤pH因子是影响土壤细菌群落分布的主要环境驱动因子之一,且也是影响土壤养分状况的重要因子。碱解氮单独归为一类,位于第Ⅱ象限,与其他环境因子呈负相关,与硝化螺旋菌高度正相关,说明了土壤中硝化细菌在促进氮素同化的同时,可能对土壤中其他养分因子将会产生一定抑制作用。
几种土壤酶分别位于4个象限,相互之间的相关性表现不强(图 4b)。优势菌群奇古菌和绿弯菌与磷酸酶呈正相关关系;酸杆菌与蔗糖酶呈较高正相关关系,但与过氧化氢酶为负相关;硝化螺旋菌和放线菌与脲酶和过氧化氢酶均呈正相关关系,但又与磷酸酶和蔗糖酶呈负相关,说明土壤中几种酶活性对优势菌群有不同程度的影响,且这种影响比较复杂,这可能跟土壤酶活性的时空异质性[13]及菌群结构复杂性有关。
山药根茎中的3种糖类物质相互之间有一定相关关系,其中淀粉与可溶性糖、粗多糖为正相关,而粗多糖与可溶性糖为弱负相关,说明粗多糖的累积一方面随可溶性糖增加而增加,另一方面随着粗多糖的累积可能会抑制可溶性糖的积累。优势菌群中奇古菌和绿弯菌与淀粉正相关,并且这两种菌群与粗多糖为显著正相关(相关系数为0.54,P < 0.01);变形菌和硝化螺旋菌与可溶性糖为正相关,与粗多糖为负相关;酸杆菌与可溶性糖的夹角几乎呈180°,说明这个菌群与可溶性糖呈负相关关系。上述结果说明在山药根际土壤中的奇古菌和绿弯菌菌群利于多糖和淀粉的累积。
3 讨论土壤不仅提供了细菌群落生长繁殖的微环境,其理化性质又间接影响土壤细菌群落结构的组成。土壤微生物参与了土壤中的碳、氮等营养素的循环和能量流动,参与了腐殖质的形成、土壤结构的形成与改良,是土壤生态的重要组分,也是植物生长及品质形成的主要影响因子。本研究在山药根际土壤中发现的4个优势菌群与于海玲[14]、金奇[15]的研究结果相似,均有变形菌、酸杆菌和放线菌,是多数酸性土壤中存在的菌群,这是因为土壤细菌群落是一个相对稳定的系统,施肥或连作等条件可能只影响某些种群的丰度,而没有改变群落种类[16]。此外,这些优势菌群参与土壤的氮素循环[17-18],有利于植物的生长。本研究中7个样本的优势菌群基本一致,而菌群丰度及结构呈现一定差异。
在土壤化学指标与细菌群落关系研究中,本研究结果表明,土壤pH是影响土壤细菌群落分布的重要因子。朱平等[19]对祁连山中部4种典型植被类型土壤细菌群落结构与理化性质相关性的研究结果表明,土壤细菌群落结构与土壤pH、含水量、总有机碳和总氮呈显著正相关,且土壤pH对细菌群落结构的影响最大,这与本研究结果一致。土壤细菌的影响因子大小为土壤有机碳、土壤总氮、含水量、电导率等,其中土壤有机碳和土壤总氮有显著性影响[20]。王鹏等[21]的研究发现总磷、铵态氮和有机质含量是与细菌群落相关性较大的土壤化学指标。本研究发现酸杆菌、绿弯菌、奇古菌和硝化螺旋菌分别与土壤的总有机碳(TOC)、AK、TN、AP、AN相关,说明细菌群落结构受土壤化学因子的影响,与赵丰云等[22]的研究结果一致。微生物通过向土壤分泌胞外酶及死亡后细胞自溶产生的胞内酶推动土壤中的生物化学反应,因此土壤酶活性及土壤化学指标相互间存在着密切配合和相互促进的复杂关系。本研究分析表明,酸杆菌与蔗糖酶和TOC均为正相关关系,蔗糖酶参与土壤中的碳循环,推测酸杆菌能够促进蔗糖酶活性,从而增加土壤中TOC的积累;硝化螺旋菌与脲酶和碱解氮为正相关,脲酶参与土壤中的氮循环,据此推测硝化螺旋菌通过增加脲酶活性,从而增加土壤中碱解氮含量。
本研究对山药根茎中几种糖类物质含量与土壤中部分优势菌群相关关系的分析表明,山药粗多糖的积累与土壤中的奇古菌和绿弯菌菌群显著正相关。奇古菌是近20年来在中温环境中发现的广泛大量存在的一类古菌,它们可能在土壤C、N的生物地球化学循环中发挥重要作用[23],其中的氨氧化古菌是酸性土壤中硝化作用的主要推动者[24],绿弯菌通过光合作用进行自养,增加土壤碳素,推测可能这些细菌通过改善土壤中的C、N循环来促进山药根系糖类物质的运输及贮藏。综上所述,土壤中酸杆菌、硝化螺旋菌、奇古菌和绿弯菌这4类细菌主要通过改善土壤中的碳、氮养分状况,促进山药根茎对可溶性糖、粗多糖及淀粉的积累。
高通量测序技术对山药根际土壤中细菌群落多样性的分析,以及细菌群落与土壤养分、山药根茎主要营养成分的关系分析结果显示,它们之间存在一定相关性,但由于土壤微生物与微生物之间、与土壤养分之间及与植物之间存在十分复杂的相互作用关系,研究这些相互作用关系并揭示其作用机理需要进行更加深入细致的研究,因此今后可分别就几种优势菌群、菌种组合与土壤理化特征、山药根茎营养成分等的互作进行机理研究和应用研究。
4 结论对山药根际土壤微生态环境及根茎营养成分的研究表明,其优势细菌群落为变形菌、绿弯菌、酸杆菌和放线菌;土壤pH是影响细菌群落结构的重要因子;酸杆菌和硝化螺旋菌可能通过促进土壤中蔗糖酶、脲酶活性提高土壤的碳、氮水平,奇古菌和绿弯菌促进根际土壤的C、N循环,增加土壤C、N养分,土壤中碳、氮养分能够促进山药根茎中可溶性糖、粗多糖及淀粉的积累。
| [1] |
邵礼梅, 许世伟. 山药化学成分及现代药理研究进展. 中医药学报, 2017, 45(2): 125-127. Shao L M, Xu S W. Advances in chemical constituents and modern pharmacology of Chinese yam (In Chinese). Acta Chinese Medicine and Pharmacology, 2017, 45(2): 125-127. DOI:10.3969/j.issn.1002-2392.2017.02.039 (  0) 0) |
| [2] |
李光宇, 吴次芳. 土壤微生物研究在农田质量评价中的应用. 土壤学报, 2018, 55(3): 543-556. Li G Y, Wu C F. Application of soil microbial studies to farmland quality evaluation (In Chinese). Acta Pedologica Sinica, 2018, 55(3): 543-556. (  0) 0) |
| [3] |
Liu Z, Liu G, Fu B, et al. Relationship between plant species diversity and soil microbial functional diversity along a longitudinal gradient in temperate grasslands of Hulunbeir, Inner Mongolia, China . Ecological Research, 2008, 23(3): 511-518. DOI:10.1007/s11284-007-0405-9
(  0) 0) |
| [4] |
孙凯宁, 杨宁, 王克安, 等. 山药连作对土壤微生物群落及土壤酶活性的影响. 水土保持研究, 2015, 22(6): 95-98. Sun K N, Yang N, Wang K A, et al. Effect of Chinese Yam continuous cropping on the soil microbial community and soil enzyme activity (In Chinese). Research of Soil & Water Conservation, 2015, 22(6): 95-98. (  0) 0) |
| [5] |
赵帅, 周娜, 赵振勇, 等. 基于高通量测序分析盐角草根部内生细菌多样性及动态规律. 微生物学报, 2016, 56(6): 1000-1008. Zhao S, Zhou N, Zhao Z Y, et al. Endophytic bacterial diversity and dynamics in root of Salicornia europaea estimated via high throughput sequencing (In Chinese). Acta Microbiologica Sinica, 2016, 56(6): 1000-1008. (  0) 0) |
| [6] |
戴雅婷, 闫志坚, 解继红, 等. 基于高通量测序的两种植被恢复类型根际土壤细菌多样性研究. 土壤学报, 2017, 54(3): 735-748. Dai Y T, Yan Z J, Xie J H, et al. Soil bacteria diversity in rhizosphere under two types of vegetation restoration based on high throughput sequencing (In Chinese). Acta Pedologica Sinica, 2017, 54(3): 735-748. (  0) 0) |
| [7] |
李岩, 杨晓东, 秦璐, 等. 两种盐生植物根际土壤细菌多样性和群落结构. 生态学报, 2018, 38(9): 3118-3131. Li Y, Yang X D, Qin L, et al. The bacterial diversity and community structures in rhizosphere soil of two halophytes, Lycium ruthenicum and Kalidium capsicum (In Chinese). Acta Ecologica Sinica, 2018, 38(9): 3118-3131. (  0) 0) |
| [8] |
张红霞, 魏方方, 王家顺, 等. 安顺山药根茎与土壤中矿质元素相关性分析. 西南大学学报(自然科学版), 2017, 39(5): 31-36. Zhang H X, Wei F F, Wang J S, et al. Correlation analysis of mineral elements in yam tuber and in its environmental soil in Anshun of Guizhou Province (In Chinese). Journal of Southwest University(Natural Science Edition), 2017, 39(5): 31-36. (  0) 0) |
| [9] |
鲍士旦. 土壤农化分析. 北京: 中国农业出版社, 2000. Bao S D. Soil andagricultural chemistry analysis (In Chinese). Beijing: China Agriculture Press, 2000. (  0) 0) |
| [10] |
关松荫. 土壤酶及其研究法. 北京: 农业出版社, 1986. Gua S Y. Soil enzyme andits research methods (In Chinese). Beijing: China Agriculture Press, 1986. (  0) 0) |
| [11] |
张志良, 瞿伟菁. 植物生理学实验指导. 北京: 高等教育出版社, 2003. Zhang Z L, Qu W J. Experimental instruction in plant physiology (In Chinese). Beijing: Higher Education Press, 2003. (  0) 0) |
| [12] |
张意静. 食品分析技术. 北京: 中国轻工业出版社, 2001. Zhang Y J. Analysis of food technology (In Chinese). Beijing: China Light Industry Press, 2001. (  0) 0) |
| [13] |
杨秉珣, 刘泉, 董廷旭. 川西北不同沙化程度草地土壤细菌群落特征. 水土保持研究, 2018, 25(6): 45-52. Yang B X, Liu Q, Dong T X. Soil bacterial communities of grasslands with different desertification degrees in northwest Sichuan (In Chinese). Research of Soil and Water Conservation, 2018, 25(6): 45-52. (  0) 0) |
| [14] |
于海玲. 施氮量对土壤微生物群落组成特征的影响研究. 长春: 吉林农业大学, 2017. Yu H L. Effect of nitrogen application on composition character of soil microbial communities (In Chinese). Changchun: Jilin Agricultural University, 2017. (  0) 0) |
| [15] |
金奇. 鄱阳湖典型湿地土壤微生物群落特征及对环境变化的响应研究. 南昌: 江西师范大学, 2017. Jin Q. Characteristics of soil microbial community in the Poyang Lake wetland and its response to the environmental change (In Chinese). Nanchang: Jiangxi Normal University, 2017. (  0) 0) |
| [16] |
王佩雯, 朱金峰, 陈征, 等. 高通量测序技术下连作植烟土壤细菌群落与土壤环境因子的耦合分析. 农业生物技术学报, 2016, 24(11): 1754-1763. Wang P W, Zhu J F, Chen Z, et al. Coupling analysis based on high throughput sequencing technology of soil bacterial community and soil environmental factors in continuous cropping tobacco soil (In Chinese). Journal of Agricultural Biotechnology, 2016, 24(11): 1754-1763. (  0) 0) |
| [17] |
王文波, 王延平, 王华田, 等. 杨树人工林连作与轮作对土壤氮素细菌类群和氮素代谢的影响. 林业科学, 2016, 52(5): 45-54. Wang W B, Wang Y P, Wang H T, et al. Effect of different continuous cropping and rotation of poplar plantation on soil nitrogen bacteria community characteristics and nitrogen metabolism (In Chinese). Journal of Forest Sciences, 2016, 52(5): 45-54. (  0) 0) |
| [18] |
张晶, 林先贵, 尹睿. 参与土壤氮素循环的微生物功能基因多样性研究进展. 中国生态农业学报, 2009, 17(5): 1029-1034. Zhang J, Lin X G, Yin R. Advances in functional gene diversity of microorganism in relation to soil nitrogen cycling (In Chinese). Chinese Journal of Ecological Agriculture, 2009, 17(5): 1029-1034. (  0) 0) |
| [19] |
朱平, 陈仁升, 宋耀选, 等. 祁连山中部4种典型植被类型土壤细菌群落结构差异. 生态学报, 2017, 37(10): 3505-3514. Zhu P, Chen R S, Song Y X, et al. Soil bacterial community composition and diversity of four representative vegetation types in the middle section of the Qilian Mountains, China (In Chinese). Acta Ecologica Sinica, 2017, 37(10): 3505-3514. (  0) 0) |
| [20] |
刘兴, 王世杰, 刘秀明, 等. 贵州喀斯特地区土壤细菌群落结构特征及变化. 地球与环境, 2015, 43(5): 490-497. Liu X, Wang S J, Liu X M, et al. Compositional characteristics and variations of soil microbial community in Karst Area of Puding County, Guizhou Province, China (In Chinese). Earth and Environment, 2015, 43(5): 490-497. (  0) 0) |
| [21] |
王鹏, 陈波, 张华. 基于高通量测序的鄱阳湖典型湿地土壤细菌群落特征分析. 生态学报, 2017, 37(5): 1650-1658. Wang P, Chen B, Zhang H. High throughput sequencing analysis of bacterial communities in soils of a typical Poyang Lake wetland (In Chinese). Acta Ecologica Sinica, 2017, 37(5): 1650-1658. (  0) 0) |
| [22] |
赵丰云, 杨湘, 董明明, 等. 加气灌溉改善干旱区葡萄根际土壤化学特性及细菌群落结构. 农业工程学报, 2017, 33(22): 119-126. Zhao F Y, Yang X, Dong M M, et al. Aeration irrigation improving grape rhizosphere soil chemical properties and bacterial community structure in arid area (In Chinese). Transactions of the Chinese Society of Agricultural Engineering, 2017, 33(22): 119-126. DOI:10.11975/j.issn.1002-6819.2017.22.015 (  0) 0) |
| [23] |
张丽梅, 贺纪正. 一个新的古菌类群——奇古菌门(Thaumarchaeota). 微生物学报, 2012, 52(4): 411-421. Zhang L M, He J Z. A novel archaeal phylum:Thaumarchaeota-A review (In Chinese). Acta Microbiologica Sinica, 2012, 52(4): 411-421. (  0) 0) |
| [24] |
侯雪燕. 土壤pH对硝化作用和氨氧化微生物群落结构的影响. 重庆: 西南大学, 2014. Hou X Y. Effects of soil pH on nitrification and community structure of ammonia-oxidizing microorganisms (In Chinese). Chongqing: Southwest University, 2014. (  0) 0) |
2. Engineering Technology Center of Control and Remediation of Soil Contaminationof Provincial Science & Technology Bureau, Anshun University, Anshun, Guizhou 561000, China;
3. Wuhan Benagen Technology Solutions Company Limited, Wuhan 430070, China
 2019, Vol. 56
2019, Vol. 56

