磷(P)是植物生长所必需的营养元素,也是造成水体富营养化和非点源污染的主要污染物。除了无机磷酸盐(Inorganic phosphate,IP),有机磷(Organic phosphate,OP)也是重要的磷库,广泛存在于各种土壤、沉积物中[1-6]。通常,土壤中有机磷约占总磷的30%~65%,而在高有机质土壤中可高达90%[7]。土壤有机磷主要有核酸、核苷酸、肌醇磷酸、磷脂、糖磷、磷蛋白和膦酸酯等[8-9]。自然土壤中,有机磷来源于动植物残体以及有机肥,此外,施入的无机磷肥经微生物的转化作用也可以形成有机磷[10]。
与无机磷类似,有机磷在金属氧化物和黏土矿物表面的吸附、解吸和沉淀反应控制该化合物在环境中的迁移,转化和有效性。在磷的土壤界面反应方面,人们常常更关注可被生物直接利用的无机磷,而忽视了土壤中有机磷这一重要组分[1, 11-12]。有机磷的降解是维持环境中磷生物有效性的重要途径[13],其界面反应在一定程度上也影响磷的地球化学行为和生态系统的生产率[9, 14-16]。
无机磷是植物和微生物可直接利用的磷源,以往磷界面反应的研究主要集中在无机磷。十几年前,关于有机磷界面反应的研究主要探讨有机磷的吸附特性[17]。近年来,应用于无机磷界面反应技术和方法,对有机磷的研究具有很好的借鉴,有力地推动了有机磷界面反应的研究[18-22]。当前对有机磷界面反应的研究技术及方法快速发展,研究体系逐渐贴近环境复杂条件,探明的影响因素更为多样,机制分析和环境效应探讨也越来越深入[23-27]。
本文综述了近十年以来常见土壤有机磷(植酸、甘油磷酸、葡萄糖-6-磷酸等)在矿物表面吸附-解吸和溶解-沉淀等界面反应特性和机制的研究进展,总结了有机磷与矿物相互作用对矿物的稳定性、溶解-沉淀转化的影响及其环境效应,该进展对理解磷素地球化学循环、调控土壤中磷的有效性、提高磷的再循环利用率、解决磷资源危机与生态环境问题具有重要意义。
1 有机磷吸附-解吸的影响因素和反应特性有机磷化合物种类繁多,不同有机磷相对分子质量差异大。相对于正磷酸,有机磷化合物一般分子结构较大,电荷密度高,且含有有机官能团[9]。目前,有关有机磷在矿物表面吸附-解吸的研究一般只涉及相对分子质量较小的化合物,如植酸、甘油磷酸、一磷酸腺苷、葡萄糖-6-磷酸等[23, 26-29]。同正磷酸根一样,有机磷化合物一般通过一个或多个磷酸基团与矿物表面发生相互作用,其反应特性受体系pH条件、有机磷和矿物特性、共存配体、温度和离子强度等因素的影响。
1.1 有机磷的吸附动力学有机磷在矿物表面的吸附起始经历快速吸附阶段,极短时间(数分钟)内达到一定的吸附量,随后是一个较长时间(数小时至数天,甚至数月)的慢吸附过程[28-32],这与无机磷(正磷酸)在矿物表面的吸附过程类似[18, 21, 33]。快速反应主要是配体交换控制,当环境条件利于解吸时,吸附的磷可以再次释放,即快速反应一般是可逆的;慢速反应是扩散吸附,一般为不可逆过程[28]。
1.2 pH对有机磷吸附的影响随pH的变化,有机磷的质子化程度和可变电荷矿物表面电荷特性改变,因此反应体系pH是影响有机磷的吸附行为的重要因素。反应体系pH升高,铁氧化物表面的正电荷密度降低,有机磷在矿物表面的吸附密度降低[30-32, 34-35],与正磷酸在矿物表面的吸附趋势一致[19-21]。pH 3、5和7,针铁矿对甘油磷酸(GP)的最大吸附密度分别为2.00、1.95和1.44 μmol·m–2;随着pH从3增加至10,针铁矿对GP的吸附减少[31]。植酸(IHP)、葡萄糖-6-磷酸(G6P)、一磷酸腺苷(AMP)、三磷酸腺苷(ATP)等有机磷在针铁矿和赤铁矿表面的吸附密度随着pH的升高而降低[30, 32, 34]。
1.3 有机磷和矿物特性对有机磷吸附的影响有机磷的分子尺寸或对分子质量、矿物的结晶度和颗粒尺寸影响有机磷的吸附行为[28-29]。Ruttenberg和Sulak[28]研究了三磷酸腺苷(ATP)、AMP、G6P和氨乙基磷酸四种有机磷以及无机磷在赤铁矿、针铁矿和水铁矿表面的吸附,发现有机磷在铁氧化物表面的吸附随结晶度的升高而降低,最大吸附密度一般随分子量的增大而减小。单位质量(氢)氧化铝对有机磷最大吸附量顺序为:无定形氢氧化铝(AAH) > 勃姆石(γ-AlOOH) > 刚玉(α- Al2O3)[26, 29]。除IHP在AAH上的吸附外,有机磷和无机磷(Pi)在(氢)氧化铝表面的吸附密度随相对分子质量增大而减小:Pi > GP > G6P > ATP > IHP。尽管IHP的分子尺寸最大,AAH对IHP的吸附量却远大于其他有机磷,这可能是由于IHP表面络合物转化成了表面沉淀。AAH对有机磷的起始快速吸附密度最大,不同有机磷在铝氧化物表面的起始快速吸附密度与相对分子质量成反比[29, 36]。此外,随着颗粒尺寸的减小,γ-Al2O3对IHP和Pi的最大吸附密度增加;亲和力常数也随矿物尺寸的降低而增大,γ-Al2O3对IHP的亲和力常数较Pi的大10倍以上,这表明IHP/Pi与Al2O3等纳米氧化物的表面反应活性与矿物颗粒尺寸密切相关[37]。此外,研究发现由于矿物组成的不同,土壤类型影响其对植酸的吸附[38]。
1.4 共存配体对有机磷吸附的影响胡敏酸(HA)和低分子量有机酸等共存配体也影响有机磷的吸附。HA和IHP加入顺序影响三水铝石和高岭石对IHP和HA吸附;且对三水铝石表面的影响比对高岭石的影响更明显。pH小于9时,先添加HA,IHP吸附减少,而在整个pH范围内HA吸附减少。向吸附IHP的矿物体系添加HA对IHP的吸附几乎没有影响,但HA吸附减少。HA和IHP吸附的减少最可能是由于表面可用位点的降低和表面上带负电荷的HA和IHP间的静电排斥。解吸实验表明,IHP与三水铝石表面强烈结合,特别是在pH 6,即使在HA存在下,IHP的解吸也微乎其微[39]。另外,低分子量有机酸抑制了磷化合物的吸附,抑制效果随着羧基数量的增加和分子大小的增加而增加[30]。
1.5 温度和离子强度对有机磷吸附的影响温度、离子强度等因素也影响有机磷的吸附行为。磷化合物在铁氧化物表面的吸附密度随温度的升高而增加,表明吸附过程是吸热和自发的[30]。pH 3~10时,吸附IHP后赤铁矿表面均带负电荷,吸附随离子强度的升高而增大[32]。热力学分析表明,植酸在一种水处理残留物(含有石英、方解石、铁/铝氧化物等)上的吸附是自发的、吸热的和熵驱动的反应[40]。
1.6 有机磷的解吸有机磷在矿物表面的解吸特性影响其迁移和转化,对有机磷解吸特性的认识有助于了解有机磷的生物地球化学循环。研究表明矿物类型、解吸剂类别、预吸附时间、磷化合物类型等均影响有机磷及无机磷的解吸程度[28-29, 41-42]。植酸在几种矿物表面的吸附量大于无机磷,且其解吸程度小于无机磷;几种矿物表面吸附态植酸和无机磷解吸程度由小到大依次为针铁矿、三水铝石、高岭石、蒙脱石[41]。可见,铁铝氧化物表面吸附的有机磷较黏土矿物表面吸附的有机磷更难解吸。预吸附时间越长,解吸量越少,水铁矿经过7 d的预吸附后,解吸的有机磷的量较经1d预吸附的解吸量少14%;相对于无机磷,预吸附时间对有机磷的生物有效性的影响更大[28]。与磷酸盐相比,G6P的初始解吸速率更高;可能是由于孔径效应G6P优先吸附在外表面,G6P可能比磷酸盐的生物有效性更高[42]。
不同解吸剂的对比研究有助于认识不同环境条件下有机磷的迁移扩散特性。水和CaCl2对几种矿物表面吸附植酸的解吸量很少,Mehlich Ⅲ试剂和酸性草酸铵提取的磷相当[41]。H2O解吸过程中,表面电荷屏蔽作用弱,吸附态磷分子间静电斥力大,故解吸率较0.02 mol·L–1 KCl的稍高[43]。柠檬酸主要通过配体交换解吸针铁矿/赤铁矿表面吸附的植酸和磷酸根,解吸随pH降低而增大,解吸率远高于H2O和0.02 mol·L–1 KCl溶液[29, 32, 43]。解吸等温线表明,KCl和H2O对针铁矿吸附IHP/Pi的解吸曲线符合指数方程,而柠檬酸解吸曲线符合直线方程[43]。此外,IHP通过多个磷酸基与针铁矿表面络合,吸附亲和力比Pi强,0.02 mol·L–1的KCl、H2O以及柠檬酸对IHP的解吸率较Pi低[43]。
2 有机磷的吸附-解吸机制对有机磷在矿物表面吸附机制的认识有助于深入理解其吸附行为。在无机磷吸附机制研究中广泛用到的一些技术或方法,如原位的衰减全反射-傅里叶变换红外光谱(ATR-FTIR)、核磁共振波谱(NMR)和原子力显微镜(AFM)以及X射线吸收近边结构(XANES)等,近年也不断用于揭示有机磷在矿物表面的吸附-解吸机制。有机磷在矿物表面的吸附机制与无机磷类似,一般形成内圈络合物(某些情况下还存在氢键作用),或同时形成内圈络合物和表面沉淀[23, 25-26, 31-32, 34]。
2.1 有机磷在矿物表面的络合吸附一般,葡萄糖一磷酸(G1P)、GP和IHP等有机磷在针铁矿、赤铁矿和TiO2等晶质矿物表面形成内圈络合物,在有些反应体系还存在一定的氢键作用[23, 31-32, 34, 44]。ATR-FTIR光谱是解析有机磷在矿物表面吸附机制的重要技术之一。ATR-FTIR光谱分析表明葡萄糖一磷酸(G1P)在针铁矿上形成与pH相关的3种表面络合物,络合物与表面铁原子单齿配位,但是氢键作用程度不同(图 1);表面配位结构和表面电荷是影响G1P解吸速率的两个重要因素[23]。ATR-FTIR光谱进一步的研究发现酸性磷酸酶可水解针铁矿表面吸附的G1P,并释放葡萄糖到溶液,而水解产生的磷酸根又被吸附到针铁矿表面;酸性磷酸酶对针铁矿表面吸附的G1P的水解速率与对溶液中G1P的水解速率一致[45]。矿物表面能够有效地浓缩底物和酶,从而创造具有高酶活性的生物化学环境[45]。而红外光谱和表面络合模型研究表明一甲基磷酸在针铁矿表面形成3种pH有关的且受氢键作用的单齿内圈络合物[46]。类似地,Zeta电位测试、ATR-FTIR光谱分析表明,GP在针铁矿表面形成了内圈络合物[31]。此外,有学者通过31P核磁共振技术,以有机磷二甲基磷酸为探针分子,比较二甲基磷酸和磷酸在针铁矿、四方纤铁矿和纤铁矿表面的吸附,提出磷酸在铁氧化物表面形成双齿双核络合物[22]。
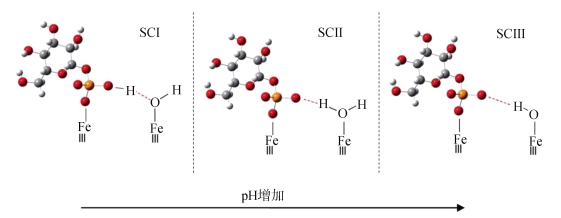
|
图 1 葡萄糖-1-磷酸在针铁矿表面的吸附机制简图。其中橙色球表示磷原子,红色球表示氧原子,灰色球表示碳原子,白色球表示氢原子。红色点线表示氢键[23] Fig. 1 Sketch of adsorptionmechanism of glucose-1-phosphate on surface of goethite. The orange balls, red balls, gray balls, and white balls denote phosphorus atoms, oxygen atoms, carbon atoms, and hydrogen atoms, respectively. The dotted red linesdenote hydrogen bonding[23] |
环境中的重要有机磷IHP在矿物表面的配位机制也受诸多学者的关注。吸附-解吸实验、ζ电位测试和ATR-FTIR分析表明IHP在赤铁矿表面形成内圈表面络合物,可能通过2个磷酸基与矿物表面配位[32]。然而也有学者利用ATR-FTIR分析植酸在针铁矿表面的吸附,并认为植酸在针铁矿表面可形成外圈络合物,且氢键起到重要作用[34]。此外,Zeta电位测量,ATR-FTIR和NMR光谱表明,IHP/Pi在TiO2表面形成内圈络合物,在pH5.0下Pi/IHP吸附密度的比率(1.528/0.453)接近3,表明IHP可能通过其六个磷酸基团中的三个与TiO2表面结合[44]。类似地,吸附实验、Zeta电位测量和ATR-FTIR光谱分析表明植酸通过其六个磷酸基团中的四个与CeO2表面结合[47]。
2.2 有机磷在矿物表面的沉淀与固定在水铁矿和无定形氢氧化铝等弱晶质矿物以及碳酸钙等体系中,IHP和G6P等有机磷在矿物表面形成络合物,同时有机磷可促进矿物的溶解并转化形成有机磷沉淀物。多种技术的联合运用,有利于深入分析有机磷在矿物表面的吸附-沉淀过程及机制。磷K边XANES和31P核磁共振波谱表明,IHP在水铁矿-水界面形成内圈络合物[48]。而磷和铁K边XANES、差分配对分布函数(d-PDF)、ATR-FTIR以及基于同步辐射的XRD等技术综合表明随着磷酸盐和植酸在水铁矿表面吸附量的增加,吸附机制由双齿双核表面配位物向三元配位、以及无定形磷酸铁和无定形植酸铁沉淀过渡[49]。在一定的磷吸附量下,磷酸盐比植酸盐更容易形成表面沉淀。磷酸盐和植酸均能强烈地促进水铁矿的溶解,且植酸的促进效应更显著。此外,无定形磷酸铁和无定形植酸铁具有相似的PO4局部配位环境[49]。与水铁矿体系类似,在无定形氢氧化铝体系中有机磷也存在类似的吸附到沉淀的转化过程。吸附动力学和OH-释放过程、ζ电位测试、原位ATR-FTIR、XRD和固态31P/27Al NMR表明,IHP首先通过配体交换(表面水基和羟基)吸附在无定形氢氧化铝(AAH)表面,形成内圈表面络合物,然后诱导AAH溶解产生的Al3+进一步与IHP的磷酸基团络合形成三元络合物,并逐渐转化为类似于植酸铝(Al-IHP)的表面沉淀[26]。pH、反应时间和IHP浓度影响上述转化过程[26]。除了弱晶质矿物体系,在一些晶质氧化铝体系中,有机磷的吸附与沉淀过程也同时存在。核磁共振技术和表面络合模型研究表明植酸在三水铝石表面同时形成外圈络合物、内圈络合物以及表面沉淀;在较高pH,外圈络合物比例更大,而在较低pH,内圈络合物和表面沉淀形态占主要优势[50]。31P及27Al NMR分析表明表面络合是IHP/Pi在较大尺寸γ- Al2O3表面吸附的主要机制;IHP在小尺寸(5 nm)γ-Al2O3表面除形成表面内圈络合物外,还生成Al-IHP表面沉淀,这是导致较小尺寸γ-Al2O3吸附密度更大的重要原因之一[37]。此外,在pH≤4时,IHP在高岭石上形成内圈络合物和植酸铝沉淀,而在pH≥5.5时,IHP在高岭石表面主要形成内圈络合物[51]。
在碳酸钙等不稳定矿物体系中,有机磷也容易发生沉淀。吸附实验、红外光谱,粉末X射线衍射(XRD),扫描电子显微镜和固体31PNMR分析表明,植酸和磷酸根在碳酸钙表面的吸附量接近,并且能够快速形成表面沉淀,植酸在矿物表面通过溶解-络合-沉淀过程形成球形无定形植酸钙,磷酸根在矿物表面通过溶解-沉淀过程形成板状结晶羟基磷灰石[52]。固态31P{1H} CP/MAS NMR表明在方解石沉淀过程中可以有效地吸收少量溶解性有机磷,并将其结合到矿物结构中[53]。此外,先进的AFM技术可观察有机磷在矿物表面形成沉淀的动力学过程,并认识沉淀的微观生长机制。例如,耦合液体反应池的AFM原位实时观测发现碳酸钙(10-14)表面在G6P的作用下发生溶解并导致溶解蚀坑由原先典型的菱形变为扇形,这是由于发生了G6P-碳酸钙台阶专一性吸附后而稳定了能量较高的(0001)面或(0112)面的结果。借助X-射线光电子能谱分析发现,碳酸钙(10-14)表面在G6P持续作用下溶解引起矿物-水界面液体层内葡萄糖-6-磷酸钙过饱和,而驱动沉淀在矿物界面上成核和生长。此外,在此系统中引入碱性磷酸酶后,除了葡萄糖-6-磷酸钙沉淀外,同时形成了无机磷酸钙沉淀(包括无定型磷酸钙,二水磷酸氢钙和羟基磷灰石)[24]。类似地,AFM用于直接观察在植酸盐、G6P和焦磷酸盐存在下,水镁石[Mg(OH)2](001)面上的溶解-沉淀动力学,结果表明,在相同的溶液条件下,对矿物表面吸附和沉淀的贡献的相对顺序为植酸盐大于焦磷酸盐大于G6P,并且可以用水镁石-水的边界层中的植酸镁、焦磷酸镁成核的诱导时间进行量化[25]。在酸性pH植酸或焦磷酸盐存在下,水镁石溶解过程中,溶液形态的计算表明,相对于植酸镁(Mg5H2Phytate·6H2O)或焦磷酸镁相(Mg2P2O7),溶液可能达到过饱和状态,在达到与水镁石的平衡之前可保持热力学稳定。这与原子力显微镜观察结果一致,即在水镁石表面形成了植酸镁或焦磷酸镁新相[25]。
3 有机磷与矿物相互作用的环境效应有机磷与矿物的相互作用会产生一系列的环境效应。矿物吸附有机磷后其分散和聚集状态会发生变化;对于特殊反应体系,有机磷与矿物的作用会影响矿物的稳定性,导致矿物发生转化。当金属离子与有机磷共存时,有机磷与金属离子在矿物表面发生共吸附反应,改变金属离子的吸附特性和机制,有机磷的吸附机制也受影响。在特定的条件下,有机磷既是磷源,也是碳源,在生物的作用下,有助于固定金属元素。
3.1 有机磷-矿物相互作用对金属离子界面反应的影响在土壤等实际环境中,有机磷和无机磷不可避免与金属离子同时存在,因而会相互影响其吸附机制。以前的研究表明,在无机磷体系中,表面静电效应、形成三元络合物以及形成表面沉淀是促进磷酸根和金属离子在矿物上共吸附的主要机制[54-59]。对于有机磷体系,近几年也有不少进展,主要集中于植酸和重金属离子Cd(Ⅱ)/Zn(Ⅱ)在矿物表面的共吸附研究,涉及的吸附机制主要包括形成三元表面络合物和表面沉淀等[60-64]。相对于赤铁矿-植酸体系,在赤铁矿、IHP、Cd(Ⅱ)三元体系中,Cd(Ⅱ)促进了赤铁矿对IHP的吸附,在较高的pH下,增强效果更明显,这使得赤铁矿对IHP随pH升高反而增大;共存的IHP也促进赤铁矿对Cd(Ⅱ)的吸附[60]。ATR-FTIR光谱表明形成两种结构不同的三元表面络合物(Hm-IHP-Cd和Hm-Cd-IHP-Cd)[60]。IHP的存在促进Zn(Ⅱ)在针铁矿表面的吸附,同样,Zn(Ⅱ)也促进IHP的吸附;三元体系中有机磷和金属离子的吸附容量和机制不同于单一的针铁矿-IHP或针铁矿-Zn(Ⅱ)二元体系,红外光谱分析表明,存在Zn(Ⅱ)时,针铁矿表面吸附IHP形成了Gt-IHP-Zn三元络合物[62]。γ-Al2O3预吸附IHP后促进了对Zn(Ⅱ)的吸附,γ-Al2O3预吸附IHP抑制锌-铝LDH的形成;固态31P NMR分析表明,随着Zn(Ⅱ)浓度或pH的增加,IHP的存在形态发生变化,即从内圈表面络合物先转化为三元表面络合物,进而再转化为植酸锌沉淀;EXAFS分析表明,pH 7条件下,随着Zn(Ⅱ)浓度的增加,二元或三元络合物形态的Zn(Ⅱ)含量降低,而锌-铝LDH形态的Zn(Ⅱ)含量增加(图 2)[61]。在pH8以下,植酸显著增加Cd(Ⅱ)在三水铝石表面的吸附,Cd(Ⅱ)和植酸浓度越高,Cd(Ⅱ)吸附量越大;31P NMR MAS光谱和扩展恒定电容表面络合模型表明形成了两种外圈三元表面络合物[63]。pH4至8,植酸显著增加了高岭石对Cd(Ⅱ)的吸附,扩展恒定电容表面络合模型表明,植酸和Cd(Ⅱ)共吸附体系中,植酸在高岭石表面形成内圈和外圈络合物,以及两种三元表面络合物;在较高pH下,Cd(Ⅱ)的吸附受到抑制,可能是由于可溶性Cd(Ⅱ)-IHP络合物[64]。可见,有机磷和金属离子在矿物表面的吸附一般存在协同效应(尤其是在低pH条件下),即金属离子促进了有机磷的吸附,有机磷也促进金属离子的固定。吸附机制因反应体系而异,多数时候存在多种机制的共同作用。
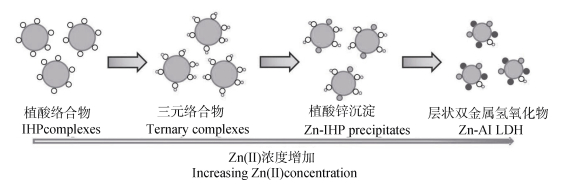
|
图 2 植酸与锌离子在γ-氧化铝表面的共吸附机制简图[61] Fig. 2 Sketch of mechanism of the co-sorption of phytate and Zn(Ⅱ)on γ-alumina[61] |
此外,在特定条件下,甘油磷酸、植酸等有机磷可以促进环境中铀的固定。还原条件下,存在甘油磷酸时,U(Ⅳ)被快速除去,并沉淀为类似于水磷铀钙矿(Ningyoite)的还原态晶质磷酸铀[U(Ⅳ)];与微生物U(Ⅳ)还原产物相比,该矿物质更能抵抗氧化再活化作用[65]。植酸水解大大降低了铀的溶解度,可能是由于形成了三元络合物,植酸铀[U(Ⅵ)]沉淀物和磷酸铀[U(Ⅵ)]矿物[66]。
3.2 有机磷-矿物相互作用对矿物稳定性的影响有机磷与金属纳米颗粒矿物间有强烈的相互作用,并影响纳米颗粒的胶体化学稳定性、纳米颗粒的化学稳定性,进而影响其在环境中的迁移、转化和归宿。粉末X射线衍射,衰减全反射傅里叶变换红外光谱,31P核磁共振光谱,高分辨率电子显微镜、扩展X射线吸收精细结构光谱分析表明,在pH 7.0下,IHP能够促进ZnO纳米颗粒快速溶解-沉淀转化(< 0.5 h),明显快于无机磷酸盐诱导的溶解和转化作用(> 3.0 h)。ZnO纳米颗粒的溶解-沉淀转化速率随着pH值的降低和IHP浓度的增加而增加。多种分析技术表明,ZnO纳米颗粒与IHP的相互作用导致ZnO纳米颗粒快速转化为植酸锌络合物,并进一步转化为结晶性较差的植酸锌(Zn-IHP)。此外,当Pi和IHP共存时,ZnO NPs优先与IHP反应并转化为Zn-IHP(图 3)[27]。TiO2或CeO2纳米颗粒表面吸附的植酸或磷酸根改变其表面电荷,并在较大程度上影响其胶体稳定性;pH、磷的吸附密度影响TiO2或CeO2的聚集和分散,且IHP的影响大于Pi,这与DLVO理论的计算一致[44, 47]。在pH 3条件下,低浓度的植酸导致CeO2的聚集,高浓度的植酸导致CeO2分散,而磷酸根仅导致CeO2的聚集;在pH 7条件下,植酸和磷酸根均可通过调节其表面的Zeta电位而促进CeO2分散[47]。柱迁移实验也表明IHP可促进纳米TiO2在石英砂柱中的运移[67]。此外,有机磷和无机磷均通过配体交换与赤铁矿相互作用,通过磷酸基团向矿物表面传递负电荷,显著降低赤铁矿的ζ电位[35]。在Na+溶液中,赤铁矿悬液的临界絮凝浓度(CCC)随着P浓度的增加而增加;在pH 5.5时,赤铁矿-植酸体系的CCC最大,其次为GP、磷酸盐体系。与磷酸根相比,有机磷不仅可以通过增加负电荷和静电排斥力,而且可以通过磷吸附赤铁矿纳米粒子之间的空间排斥来更有效地稳定赤铁矿悬液。然而,pH4.5时低浓度Ca2+溶液中,IHP存在时赤铁矿的聚集增强[35]。
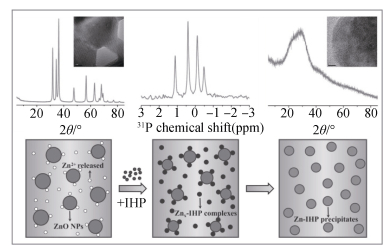
|
图 3 植酸与氧化锌纳米颗粒间的反应机制简图。植酸与ZnO纳米颗粒间的相互作用导致ZnO溶解形成植酸锌络合物,并最终转化形成弱晶质的植酸锌沉淀[27] Fig. 3 Sketch of mechanism of the reaction between phytate and nano ZnOs. Interaction between phytate and nano ZnO particles induces rapid dissolution of nano ZnO particles and transformation into zinc phytate complexes and eventually into poorly crystallized precipitate of zinc phytate[27] |
有机磷是环境中的重要磷库,参与了各种生物地球化学过程。尽管近十年来有机磷-矿物相互作用已经得到国内外众多研究者的关注,但仍需要进一步探讨有机磷的微观吸附机制,以及复杂环境条件下有机磷的吸附反应特性。针对已有的工作,未来关于有机磷-矿物相互作用研究应着眼于以下几个方面。
1)有机磷在矿物表面的反应特性受诸多因素的影响,目前的研究主要涉及体系pH条件、有机磷和矿物类型、共存配体和离子强度等因素。实际环境中,还有很多因素也影响有机磷在矿物表面的反应特性。在今后的研究需更多地关注不同组成与结构矿物(如复合矿物、同晶替代矿物等)-有机磷之间的反应特性。还有待研究氧化还原条件对有机磷在铁氧化物表面的吸附特性及机制的影响。在淹水等厌氧环境下,常常发生(氢)氧化铁的还原,模拟类似条件下有机磷的界面反应过程有助于系统认识有机磷的生物地球化学过程。此外,生物作用在磷素,尤其是有机磷的循环、转化过程中也起着重要作用,亟待研究微生物因素对有机磷吸附-解吸、沉淀-溶解以及水解转化的影响。譬如仍需研究铁还原细菌等厌氧微生物或磷酸酶存在条件下,有机磷在铁氧化物表面的吸附与解吸,沉淀与溶解特性及机制。
2)对有机磷-矿物相互作用机制的认识是了解其环境行为的关键。有机磷在矿物表面吸附-解吸的微观分子机制有待进一步深入研究。譬如目前植酸以及其他肌醇磷酸与矿物表面配位的磷酸基团数目仍缺乏光谱学的直接证据,以后的研究需要结合多种先进的方法或技术,如双共振核磁共振波谱、二维原位衰减全反射-傅里叶变换红外光谱、表面络合模型、量子化学计算等,从分子层面揭示肌醇磷酸等有机磷的表面配位方式。此外,还待加强有机磷-矿物相互作用过程中,表面络合吸附与表面沉淀的定量区分。
3)有机磷-矿物相互作用的环境效应方面,现有的研究主要集中于相互作用对金属离子界面反应行为以及对矿物稳定性的影响。有机磷在环境中与有机物共存,今后的研究需更多地关注有机磷-矿物相互作用对有机物界面行为的影响。此外,还需关注有机磷-矿物相互作用对有机磷的生物有效性及土壤矿物结构与演化的影响。
总之,深入并系统研究土壤有机磷与矿物的相互作用及其环境效应,有助于提高对环境中有机磷的分布、形态、生物有效性等方面的认识,有利于全面了解磷素的迁移、转化与生物地球化学循环。
| [1] |
Turner B L, Papházy M J, Haygarth P M, et al. Inositol phosphates in the environment . Philosophical Transactions of the Royal Society of London Series B:Biological Sciences, 2002, 357: 449-469. DOI:10.1098/rstb.2001.0837
(  0) 0) |
| [2] |
Turner B L, Newman S, Newman J M. Organic phosphorus sequestration in subtropical treatment wetlands . Environmental Science & Technology, 2006, 40: 727-733.
(  0) 0) |
| [3] |
Turner B L, Cheesman A W, Godage H Y, et al. Determination of neo-and D-chiro-inositol hexakisphosphate in soils by solution 31P NMR spectroscopy . Environmental Science & Technology, 2012, 46: 4994-5002.
(  0) 0) |
| [4] |
Doolette A L, Smernik R J, Dougherty W J. Spiking improved solution phosphorus-31 nuclear magnetic resonance identification of soil phosphorus compounds . Soil Science Society of America Journal, 2009, 73: 919-927. DOI:10.2136/sssaj2008.0192
(  0) 0) |
| [5] |
Vestergren J, Vincent A G, Jansson M, et al. High-resolution characterization of organic phosphorus in soil extracts using 2D 1H−31P NMR correlation spectroscopy . Environmental Science & Technology, 2012, 46: 3950-3956.
(  0) 0) |
| [6] |
Shinohara R, Imai A, Kawasaki N, et al. Biogenic phosphorus compounds in sediment and suspended particles in a shallow Eutrophic Lake:A 31P-Nuclear magnetic resonance(31P NMR)study . Environmental Science & Technology, 2012, 46(19): 10572-10578.
(  0) 0) |
| [7] |
Harrison A F. Soil organic phosphorus-A review of world literature . Wallingford, Oxon, UK: CAB Int., 1987.
(  0) 0) |
| [8] |
Baldwin D S. Organic phosphorus in the aquatic environment . Environmental Chemistry, 2013, 10: 439-454. DOI:10.1071/EN13151
(  0) 0) |
| [9] |
Turner B L, Frossard E, Baldwin D S. Organic phosphorus in the environment . Oxfordshire, MA: CABI, 2005.
(  0) 0) |
| [10] |
Condron L M, Turner B L, Cade-menun B J. Chemistry and dynamics of soil organic phosphorus//Sims J T, Sharpley A N. Phosphorus: Agriculture and the Environment. Madison, WI: American Society of Agronomy, Crop Science Society of America, Soil Science Society of America, 2005. 87-121
(  0) 0) |
| [11] |
Arai Y, Sparks D L. Phosphate reaction dynamics in soils and soil components:A multiscale approach . Advances in Agronomy, 2007, 94: 135-179. DOI:10.1016/S0065-2113(06)94003-6
(  0) 0) |
| [12] |
Dodd R J, Sharpley A N. Recognizing the role of soil organic phosphorus in soil fertility and water quality . Resources, Conservation and Recycling, 2015, 105(B): 282-293.
(  0) 0) |
| [13] |
Benitez-Nelson C R, Buesseler K O. Variability of inorganic and organic phosphorus turnover rates in the coastal ocean . Nature, 1999, 398: 502-505. DOI:10.1038/19061
(  0) 0) |
| [14] |
Van Cappellen P, Ingall E D. Redox stabilization of the atmosphere and oceans by phosphorus-limited marine productivity . Science, 1996, 271: 493-496. DOI:10.1126/science.271.5248.493
(  0) 0) |
| [15] |
Bjerrum C J, Canfield D E. Ocean productivity before about 1.9 Gyr ago limited by phosphorus adsorption onto iron oxides . Nature, 2002, 417: 159-162. DOI:10.1038/417159a
(  0) 0) |
| [16] |
Sundareshwar P V, Koepfler E K, Fornwalt B. Phosphorus limitation of coastal ecosystem processes . Science, 2003, 299: 563-565. DOI:10.1126/science.1079100
(  0) 0) |
| [17] |
严玉鹏, 万彪, 刘凡, 等. 环境中植酸的分布、形态及界面反应行为. 应用与环境生物学报, 2012, 18(3): 494-501. br> Yan Y P, Wan B, Liu F, et al. Distribution, species and interfacial reactions of phytic acid in environment (In Chinese). Chinese Journal of Applied & Environmental Biology, 2012, 18(3): 494-501. (  0) 0) |
| [18] |
Wang X, Li W, Harrington R, et al. Effect of ferrihydrite crystallite size on phosphate adsorption reactivity . Environmental Science & Technology, 2013, 47(18): 10322-10331.
(  0) 0) |
| [19] |
Antelo J, Fiol S, Pérez C, et al. Analysis of phosphate adsorption onto ferrihydrite using the CD-MUSIC model . Journal of Colloid and Interface Science, 2010, 347(1): 112-119. DOI:10.1016/j.jcis.2010.03.020
(  0) 0) |
| [20] |
Li W, Feng J, Kwon K D, et al. Surface speciation of phosphate on boehmite(γ-AlOOH)determined from NMR spectroscopy . Langmuir, 2010, 26: 4753-4761. DOI:10.1021/la903484m
(  0) 0) |
| [21] |
Li W, Feng X, Yan Y, et al. Solid state NMR spectroscopic study of phosphate retention mechanisms on aluminum(hydr)oxides . Environmental Science & Technology, 2013, 47: 8308-8315.
(  0) 0) |
| [22] |
Kim J, Li W, Phillips B L, et al. Phosphate adsorption on the iron oxyhydroxides goethite(α-FeOOH), akaganeite(β-FeOOH), and lepidocrocite(γ-FeOOH):A 31P NMR Study . Energy & Environmental Science, 2011, 4: 4298-4305.
(  0) 0) |
| [23] |
Olsson R, Giesler R, Loring J S, et al. Adsorption, desorption, and surface-promoted hydrolysis of glucose-1-phosphate in aqueous goethite(α-FeOOH)suspensions . Langmuir, 2010, 26: 18760-18770. DOI:10.1021/la1026152
(  0) 0) |
| [24] |
Wang L, Qin L, Putnis C V, et al. Visualizing organophosphate precipitation at the calcite–water interface by in situ atomic-force microscopy . Environmental Science & Technology, 2016, 50(1): 259-268.
(  0) 0) |
| [25] |
Wang L, Putnis C V, King H E, et al. Imaging organophosphate and pyrophosphate sequestration on brucite by in situ atomic force microscopy . Environmental Science & Technology, 2017, 51(1): 328-336.
(  0) 0) |
| [26] |
Yan Y, Li W, Yang J, et al. Mechanism of myo-inositol hexakisphosphate sorption on amorphous aluminum hydroxide:Spectroscopic evidence for rapid surface precipitation . Environmental Science & Technology, 2014, 48(12): 6735-6742.
(  0) 0) |
| [27] |
Feng X, Yan Y, Wan B, et al. Enhanced dissolution and transformation of ZnO nanoparticles:The role of inositol hexakisphosphate . Environmental Science & Technology, 2016, 50(11): 5651-5660.
(  0) 0) |
| [28] |
Ruttenberg K C, Sulak D J. Sorption and desorption of dissolved organic phosphorus onto iron(oxyhydr)oxides in seawater . Geochimica et Cosmochimica Acta, 2011, 75: 4095-4112. DOI:10.1016/j.gca.2010.10.033
(  0) 0) |
| [29] |
Yan Y, Liu F, Li W, et al. Sorption and desorption characteristics of organic phosphates of different structures on aluminium(oxyhydr)oxides . European Journal of Soil Science, 2014, 65(2): 308-317. DOI:10.1111/ejss.12119
(  0) 0) |
| [30] |
Lü C, Yan D, He J, et al. Environmental geochemistry significance of organic phosphorus:An insight from its adsorption on iron oxides . Applied Geochemistry, 2017, 84: 52-60. DOI:10.1016/j.apgeochem.2017.05.026
(  0) 0) |
| [31] |
Li H, Wan B, Yan Y, et al. Adsorption of glycerophosphate on goethite(α-FeOOH):A macroscopic and infrared spectroscopic study . Journal of Plant Nutrition and Soil Science, 2018, 181: 557-565. DOI:10.1002/jpln.201700517
(  0) 0) |
| [32] |
Yan Y, Wan B, Liu F, et al. Adsorption-desorption of myo-inositol hexakisphosphate on hematite . Soil Science, 2014, 179(10/11): 476-485.
(  0) 0) |
| [33] |
Wang X, Liu F, Tan W, et al. Characteristics of phosphate sorption-desorption onto ferrihydrite:Comparison with well-crystalline Fe(hydr)oxides . Soil Science, 2013, 178: 1-11. DOI:10.1097/SS.0b013e31828683f8
(  0) 0) |
| [34] |
Johnson B B, Quill E, Angove M J. An investigation of the mode of sorption of inositol hexaphosphate to goethite . Journal of Colloid and Interface Science, 2012, 367: 436-442. DOI:10.1016/j.jcis.2011.09.066
(  0) 0) |
| [35] |
Xu C, Li J, Xu R, et al. Sorption of organic phosphates and its effects on aggregation of hematite nanoparticles in monovalent and bivalent solutions . Environmental Science and Pollution Research, 2017, 24(8): 7197-7207. DOI:10.1007/s11356-017-8382-1
(  0) 0) |
| [36] |
Barrow N J, Feng X, Yan Y. Describing specific adsorption of organic and inorganic phosphates by variable charge oxides . European Journal of Soil Science, 2015, 66: 859-866. DOI:10.1111/ejss.12280
(  0) 0) |
| [37] |
Yan Y, Koopal L K, Li W, et al. Size-dependent sorption of myo-inositol hexakisphosphate and orthophosphate on nano-γ-Al2O3 . Journal of Colloid and Interface Science, 2015, 451: 85-92. DOI:10.1016/j.jcis.2015.03.045
(  0) 0) |
| [38] |
Fuentes B, Mora M, Bol R, et al. Sorption of inositol hexaphosphate on desert soils . Geoderma, 2014, 232/234: 573-580. DOI:10.1016/j.geoderma.2014.06.016
(  0) 0) |
| [39] |
Ruyter-Hooley M, Morton D W, Johnson B B, et al. The effect of humic acid on the sorption and desorption of myo-inositol hexaphosphate to gibbsite and kaolinite . European Journal of Soil Science, 2016, 67: 285-293. DOI:10.1111/ejss.12335
(  0) 0) |
| [40] |
Qiu F, Wang J, Zhao D, et al. Adsorption of myo-inositol hexakisphosphate in water using recycled water treatment residual . Environmental Science and Pollution Research, 2018, 25(29): 29593-29604. DOI:10.1007/s11356-018-2971-5
(  0) 0) |
| [41] |
Shang C, Zelazny L W, Berry D F, et al. Orthophosphate and phytate extraction from soil components by common soil phosphorus tests . Geoderma, 2013, 209/210: 22-30. DOI:10.1016/j.geoderma.2013.05.027
(  0) 0) |
| [42] |
Goebel M, Adams F, Boy J, et al. Mobilization of glucose-6-phosphate from ferrihydrite by ligand-promoted dissolution is higher than of orthophosphate . Journal of Plant Nutrition and Soil Science, 2017, 180(3): 279-282. DOI:10.1002/jpln.201600479
(  0) 0) |
| [43] |
Yan Y, Koopal L K, Liu F, et al. Desorption of myo-Inositol hexakisphosphate and phosphate from goethite by different reagents . Journal of Plant Nutrition and Soil Science, 2015, 178(6): 878-887. DOI:10.1002/jpln.201500254
(  0) 0) |
| [44] |
Wan B, Yan Y, Liu F, et al. Surface speciation of myo-inositol hexakisphosphate adsorbed on TiO2 nanoparticles and its impact on their colloidal stability in aqueous . Science of the Total Environment, 2016, 544: 134-142. DOI:10.1016/j.scitotenv.2015.11.157
(  0) 0) |
| [45] |
Olsson R, Giesler R, Loring J S, et al. Enzymatic hydrolysis of organic phosphates adsorbed on mineral surfaces . Environmental Science & Technology, 2012, 46: 285-291.
(  0) 0) |
| [46] |
Persson P, Andersson T, Nelson H, et al. Surface complexes of monomethyl phosphate stabilized by hydrogen bonding on goethite(α-FeOOH)nanoparticles . Journal of Colloid and Interface Science, 2012, 386: 350-358. DOI:10.1016/j.jcis.2012.07.042
(  0) 0) |
| [47] |
Wan B, Yan Y, Liu F, et al. Impacts of myo-inositol hexakisphosphate and phosphate adsorption on aggregation of CeO2 nanoparticles:Effects of pH and surface coverage . Environmental Chemistry, 2016, 13: 34-42. DOI:10.1071/EN15027
(  0) 0) |
| [48] |
Chen A, Arai Y. Functional group specific phytic acid adsorption at ferrihydrite-water interface . Environmental Science & Technology, 2019. DOI:10.1021/acs.est.9b01511
(  0) 0) |
| [49] |
Wang X, Hu Y, Tang Y, et al. Phosphate and phytate adsorption and precipitation on ferrihydrite surfaces . Environmental Science:Nano, 2017, 4: 2193-2204. DOI:10.1039/C7EN00705A
(  0) 0) |
| [50] |
Ruyter-Hooley M, Larsson A, Johnson B B, et al. Surface complexation modeling of inositol hexaphosphate sorption onto gibbsite . Journal of Colloid and Interface Science, 2015, 440: 282-291. DOI:10.1016/j.jcis.2014.10.065
(  0) 0) |
| [51] |
Hu Z, Jaisi D P, Yan Y, et al. Adsorption and precipitation of myo-inositol hexakisphosphate onto kaolinite . European Journal of Soil Science, 2019. DOI:10.1111/ejss.12849
(  0) 0) |
| [52] |
Wan B, Yan Y, Liu F, et al. Surface adsorption and precipitation of inositol hexakisphosphate on calcite:In comparison with orthophosphate . Chemical Geology, 2016, 421: 103-111. DOI:10.1016/j.chemgeo.2015.12.004
(  0) 0) |
| [53] |
Phillips B L, Zhang Z, Kubista L, et al. NMR spectroscopic study of organic phosphate esters coprecipitated with calcite . Geochimica et Cosmochimica Acta, 2016, 183: 46-62. DOI:10.1016/j.gca.2016.03.022
(  0) 0) |
| [54] |
Rietra R P J J, Hiemstra T, van Riemsdijk W H. Interaction between calcium and phosphate adsorption on goethite . Environmental Science & Technology, 2001, 35(16): 3369-3374.
(  0) 0) |
| [55] |
Hinkle M A G, Wang Z, Giammar D E, et al. Interaction of Fe(Ⅱ)with phosphate and sulfate on iron oxide surfaces . Geochimica et Cosmochimica Acta, 2015, 158: 130-146. DOI:10.1016/j.gca.2015.02.030
(  0) 0) |
| [56] |
Ren X, Tan X, Hayat T, et al. Co-sequestration of Zn(Ⅱ)and phosphate by γ-Al2O3:From macroscopic to microscopic investigation . Journal of Hazardous Materials, 2015, 297: 134-145. DOI:10.1016/j.jhazmat.2015.04.079
(  0) 0) |
| [57] |
Liu J, Zhu R, Liang X, et al. Synergistic adsorption of Cd(Ⅱ)with sulfate/phosphate on ferrihydrite:An in situ ATR-FTIR/2D-COS study . Chemical Geology, 2018, 477: 12-21. DOI:10.1016/j.chemgeo.2017.12.004
(  0) 0) |
| [58] |
Elzinga E J, Kretzschmar R. In situ ATR-FTIR spectroscopic analysis of the co-adsorption of orthophosphate and Cd(Ⅱ)onto hematite . Geochimica et Cosmochimica Acta, 2013, 117: 53-64. DOI:10.1016/j.gca.2013.04.003
(  0) 0) |
| [59] |
Tiberg C, Sjöstedt C, Persson I, et al. Phosphate effects on copper(Ⅱ)and lead(Ⅱ)sorption to ferrihydrite . Geochimica et Cosmochimica Acta, 2013, 120: 140-157. DOI:10.1016/j.gca.2013.06.012
(  0) 0) |
| [60] |
Wan B, Yan Y, Zhu M, et al. Quantitative and spectroscopic investigations of the co-sorption of myo-inositol hexakisphosphate and cadmium(Ⅱ)on to haematite . European Journal of Soil Science, 2017, 68(3): 374-383. DOI:10.1111/ejss.12424
(  0) 0) |
| [61] |
Yan Y, Wan B, Jaisi D P, et al. Effects of myo-inositol hexakisphosphate on Zn(Ⅱ)sorption on γ-alumina:A Mechanistic Study . ACS Earth and Space Chemistry, 2018, 2(8): 787-796. DOI:10.1021/acsearthspacechem.8b00051
(  0) 0) |
| [62] |
Yan Y, Wan B, Zhang Y, et al. In situ ATR-FTIR spectroscopic study of the co-adsorption of myo-inositol hexakisphosphate and Zn(Ⅱ)onto goethite . Soil Research, 2018, 56: 526-534. DOI:10.1071/SR17333
(  0) 0) |
| [63] |
Ruyter-Hooley M, Larsson A, Johnson B B, et al. The effect of inositol hexaphosphate on cadmium sorption to gibbsite . Journal of Colloid and Interface Science, 2016, 474: 159-170. DOI:10.1016/j.jcis.2016.04.028
(  0) 0) |
| [64] |
Ruyter-Hooley M, Johnson B B, Morton D W, et al. The adsorption of myo-inositol hexaphosphate onto kaolinite and its effect on cadmium retention . Applied Clay Science, 2017, 135: 405-413. DOI:10.1016/j.clay.2016.10.023
(  0) 0) |
| [65] |
Newsome L, Morris K, Trivedi D, et al. Biostimulation by glycerol phosphate to precipitate recalcitrant uranium(Ⅳ)phosphate . Environmental Science & Technology, 2015, 49(18): 11070-11078.
(  0) 0) |
| [66] |
Salome K K, Beazley M J, Webb S M, et al. Biomineralization of U(Ⅵ)phosphate promoted by microbially-mediated phytate hydrolysis in contaminated soils . Geochimica et Cosmochimica Acta, 2017, 197: 27-42. DOI:10.1016/j.gca.2016.10.008
(  0) 0) |
| [67] |
Tang Y, Wang X, Yan Y, et al. Effects of myo-inositol hexakisphosphate, ferrihydrite coating, ionic strength and pH on the transport of TiO2 nanoparticles in quartz sand . Environmental Pollution, 2019. DOI:10.1016/j.envpol.2019.06.008
(  0) 0) |
 2019, Vol. 56
2019, Vol. 56


