2. 贵州省农业科学院蚕业研究所,贵阳 550006;
3. 贵州大学农学院,贵阳 550025
以贵州为中心的西南地区是我国岩溶分布的典型区域,由于长期土地利用不合理、土壤瘠薄、水土流失严重、抗侵蚀能力较差,现已成为制约该区域可持续发展的重要生态环境问题[1]。因此,选择水土保持能力强并兼具喜钙、石生、旱生等特点的植物进行恢复重建,是实现该地区生态环境治理的关键[2]。土壤团聚体作为土壤结构的基本单元,对土壤水分渗透与保持、表层土壤侵蚀及植物生长影响较大,其稳定性是评价土壤抗蚀性的主要指标之一[3]。通常利用大团聚体(粒径 > 0.25 mm)百分含量、团聚体平均质量直径(Mean weight diameter,MWD)、几何平均直径(Geometric mean diameter,GMD)和团聚体破坏率(Percentage of aggregate destruction,PAD)反映土壤团聚体稳定性[4]。在退化生态系统植被恢复过程中,丛枝菌根(Arbuscular mycorrhizal,AM)真菌能与大部分植物形成共生关系,可促进植物生长及土壤团聚体的形成和稳定,从而提高岩溶等退化生态系统植被重建的成功率、保证修复效果的持续性和稳定性[5]。其中,AM真菌的菌丝随宿主植物根系生长分泌产生一类具有“超级胶水”性能的特异性蛋白,即球囊霉素相关土壤蛋白(Glomalin-related soil protein,GRSP),是土壤团聚体形成的重要黏合剂,能够提高土壤水分的渗透力和土壤稳定性、多孔结构[6]。接种AM真菌能够提高GRSP含量,进而促进土壤大团聚体形成并增强土壤结构稳定性[7],因而GRSP作为有机胶结物质对土壤团聚体的形成和稳定具有重要的促进作用[8]。桑树(Morus alba)易与AM真菌形成共生关系[9],但岩溶生态系统利用接种AM真菌的桑树进行植被恢复过程中,桑树根围土壤GRSP对土壤团聚体改善及土壤结构的稳定性是否有明显的促进作用尚需探索。
土壤团聚体的形成与稳定对土壤有机碳(Soil organic carbon,SOC)具有重要的物理保护作用,而SOC是各粒级团聚体形成与稳定的重要胶结剂,与GRSP同是土壤团聚体形成与稳定的主要驱动因子[10]。AM真菌等对土壤团聚体的改善会影响各粒级团聚体的SOC含量,也可为SOC提供更多的物理保护,防止其被土壤生物分解[11]。但是,桑树接种AM真菌后其根围土壤各粒级团聚体中的SOC如何变化尚不清楚。而SOC与GRSP关系密切,二者含量提高可改善土壤团聚体稳定性[12]。据此推测,在AM真菌作用下桑树根围土壤团聚体的形成与稳定会同时受到GRSP和SOC的影响。本研究选择石漠化桑园土壤为供试土壤,分析接种AM真菌后土壤团聚体组成与稳定性的变化,探讨AM真菌对SOC、GRSP及土壤团聚体的改善效应和潜在机制,从而为岩溶区桑树生长营造良好的土壤环境提供理论与技术依据。
1 材料与方法 1.1 供试材料供试菌剂摩西管柄囊霉(Funneliformis mosseae)和根内根生囊霉(Rhizophagus intraradices)由广西农业科学院微生物研究所提供。以河沙为基质、三叶草(Trifolium repens L.)和玉米(Zea mays L.)为宿主进行扩繁,供试菌剂包含孢子(孢子密度为112~137 ind·10 g-1)、菌丝、侵染根段及河沙。
供试桑树品种为桑特优2号,种子用0.5% NaClO表面消毒20 min,无菌水冲洗若干次后播种于灭菌河沙培养,期间喷洒无菌水保持河沙湿润,2个月后用于接种菌剂。桑树无菌苗培育过程在广西农科院微生物研究所温室进行。
供试土壤采自贵州省农业科学院石漠化桑园,为石灰性土壤。土壤风干后,利用10 KGy的钴-60辐照灭菌。土壤主要性质为:pH 6.70,有机质43.63 g·kg-1,全氮3.69 g·kg-1,全磷0.337 g·kg-1,全钾3.76 g·kg-1。
1.2 试验设计试验于贵州省农业科学院蚕业研究所温室条件下进行,设CK(对照)、Fm(接种F. mosseae)和Ri(接种R. intraradices)3个处理,每个处理设3个重复,共有9盆,完全随机排列。将灭菌后的土壤装至塑料桶,每桶装入灭菌土5.0 kg、施加菌剂50 g(对照加等量的灭菌菌剂)。
具体操作过程为:先将灭菌的土壤装至塑料桶高度的2/3处; 随后选取2株长势一致的桑苗将其根系均匀蘸满菌剂30 g,将桑苗和剩余菌剂移入已装灭菌土的桶中心位置; 将桑苗固定后装入剩余的灭菌土,确保成功移栽桑苗。桑苗培养期间,所有处理正常供水,每2 d少量多次浇200 mL·桶-1灭菌水,生长温度25~28 ℃,光照时间8~10 h·d-1。在石漠化生境中,一般持续放晴7 d需及时为植物补充水分确保生长良好[13]。因而,本试验对桑树接种培养40 d后不再供水,自然干旱7 d后观测桑树根围土壤团聚体状况。
1.3 样品采集与分析试验结束后,用直尺测量每个处理桑苗株高,数显游标卡尺测量地径。以桑苗地径为中心,挖取其半径5 cm、深10 cm范围内土壤与根系,抖落收集根系周围土壤后清洗根系。将每株幼苗根系剪成1 cm长的小段用于测定AM真菌侵染率,其测定参照Phillips和Hayman[14]曲利苯蓝染色法并适当改进。按0、10%、20%、…、100%的侵染数量给出每条根段的侵染率。
土壤团聚体粒级分级采用干筛和人工湿筛相结合的方法[4, 15]进行,收集各粒级土样,50℃烘干、称重后保存,用于各粒级土壤GRSP和SOC含量测定。其中GRSP分为易提取(easily extractable,EE)- GRSP和总(total,T)-GRSP两个组分,参考文献[16-17]方法测定; SOC采用重铬酸钾氧化-外加热法测定[18]。
1.4 相关计算每个处理样品AM真菌侵染率的计算公式为:
AM真菌侵染率(%)=∑(0×根段数+10%×根段数+20%×根段数+…+100%×根段数)/总根段数
土壤团聚体稳定性以MWD、GMD和PAD反映,其计算公式如下:
| $ \begin{array}{l} {W_{\rm{i}}}(\% ) = {m_{\rm{i}}}/\sum {{m_{\rm{i}}} \times 100} ;\\ {\rm{MWD(mm}}) = (\sum {{X_{\rm{i}}} \cdot {W_{\rm{i}}})/\sum {{W_{\rm{i}}}} } ;\\ {\rm{GMD(mm}}) = \exp [(\sum {{W_{\rm{i}}}} \cdot \lg {X_i})/\sum {{W_{\rm{i}}}} ];\\ PAD(\% ) = [( > 0.25\;{\rm{mm}}\;机械稳定性团聚体 - > \\ 0.25\;{\rm{mm}}\;水稳性团聚体)/ > 0.25\;{\rm{mm}}\;机械稳定性团\\ 聚体] \times 100。\end{array} $ |
式中,Wi为各级团聚体的百分含量,mi为各处理中i级(分别为0.25~5 mm大团聚体、0.053~0.25 mm微团聚体和 < 0.053 mm粉黏团聚体3个级别)团聚体质量(g),∑mi为各处理土壤样品总质量(g),Xi为i级范围内团聚体的平均直径(mm)。
土壤T-GRSP、土壤E-GRSP和土壤SOC含量的计算公式为:
| $ \begin{array}{l} 土壤\;{\rm{T - GRSP = (}}\sum {{\rm{T - GRS}}{{\rm{P}}_{\rm{i}}} \cdot } {W_{\rm{i}}})/\sum {{W_{\rm{i}}}} ;\\ 土壤\;{\rm{EE - GRSP = (}}\sum {{\rm{EE - GRS}}{{\rm{P}}_{\rm{i}}} \cdot } {W_{\rm{i}}})/\sum {{W_{\rm{i}}}} ;\\ 土壤\;{\rm{SOC}} = (\sum {{\rm{SO}}{{\rm{C}}_{\rm{i}}} \cdot } {W_{\rm{i}}})/\sum {{W_{\rm{i}}}}。\end{array} $ |
式中,T-GRSPi、EE-GRSPi和SOCi分别为i级土壤的T-GRSP、EE-GRSP和SOC。
AM真菌对土壤SOC的效应,计算公式为:
| $ \begin{array}{l} 接种效应(\% ) = (接种某菌剂\;{\rm{mm}}\;平均含量 - 对照\\ {\rm{mm}}\;平均含量)/对照\;{\rm{mm}}\;平均含量 \times 100 \end{array} $ |
土壤T-GRSP和土壤E-GRSP对土壤SOC的占比,计算公式分别为:
| $ \begin{array}{l} 土壤\;{\rm{T - GRSP}}\;的占比 = 土壤\;{\rm{T - GRSP}}\;含量/土壤\\ {\rm{SOC}}\;含量 \times 100\% ;\\ 土壤\;{\rm{E - GRSP}}\;的占比 = 土壤\;{\rm{E - GRSP}}\;含量/土\\ {\rm{壤}}\;{\rm{SOC}}\;含量 \times 100\% \end{array} $ |
试验采用SPSS 23.0对数据进行单因素方差分析、Duncan多重比较、相关分析; 用SigmaPlot 13.0绘图。采用结构方程模型(Structural equation modeling,SEM)中贝氏估计法解析GRSP和SOC对团聚体形成与稳定性的影响作用,参照吴明隆[19]所述,借助IBM SPSS Amos 21.0执行模型运算,过程如下:
1)根据理论文献绘制假设的因果模型图,即完成模型构建;
2)开启数据文件读入测量指标变量,并界定潜在变量、误差变量的变量名称;
3)根据分析属性选择要呈现的统计量,需增列平均数及截距项的估计,随后选择贝氏估计法工具图像按钮执行贝氏分析操作。
4)当贝氏估计窗口中聚敛统计量(Convergence statistic,C.S.)数值小于1.002时,表示各参数估计值已达到聚敛标准,此时按下“暂停抽样”结束估计程序。
5)根据适配测量值等判别假设模型与数据是否匹配,其中事后预测p值(Posterior predictive p,PPp)合理范围为0.05~0.95之间,而当此值数据介于0.25~0.75时表示假设模型为适配模型。
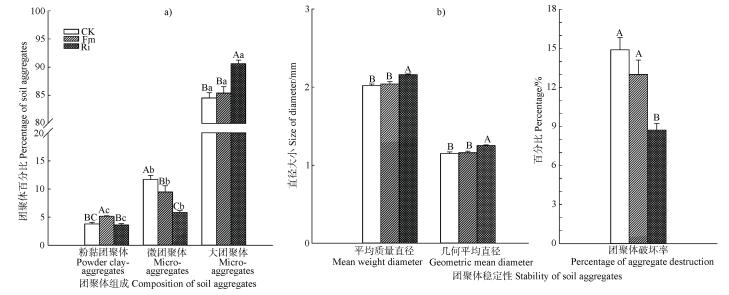
2 结果 2.1 AM真菌侵染率、团聚体粒级分布和稳定性接种AM真菌47 d后,桑树根系镜检可观察到菌丝和泡囊结构,说明AM真菌已成功侵染。其中Fm处理的侵染率(47.53%)显著高于Ri(43.10%),且两者均显著提高桑树的株高和地径(表 1)。图 1a显示,Ri处理大团聚体含量显著增加(增幅为7.20%),Fm和Ri微团聚体含量均显著降低(降幅分别为19.1%和50.4%),Ri的效应更为明显。然而,Fm显著增加 < 0.053 mm粒级团聚体含量(36.4%),而Ri对此没有显著影响。综合而言,各处理不同粒级团聚体的比例由高至低依次为大团聚体、微团聚体、粉黏团聚体,而接种R. intraradices的团聚效应明显优于接种F. mosseae。图 1b发现,与CK对比,接种F. mosseae对MWD、GMD和PAD影响不明显,但接种R. intraradices显著增加MWD和GMD、显著降低PAD。
|
|
表 1 AM真菌侵染率、桑树株高与地径 Table 1 AM infection rate, plant height and stem diameter of mulberry relative to treatment |
|
注:不同大写字母表示不同处理间差异显著(P < 0.05),不同小写字母表示同处理不同粒级间差异显著(P < 0.05)。误差线为标准偏差(n=3)。 Note:Different capital letters indicate significant difference(P < 0.05)among treatments in the same composition of soil aggregates. Different small letters indicate significant different(P < 0.05)among soil compositions in the same treatment. The error bar is standard deviation(n=3). 图 1 不同处理下土壤团聚体组成与稳定性变化 Fig. 1 Composition and stability of soil aggregates relative to treatment |
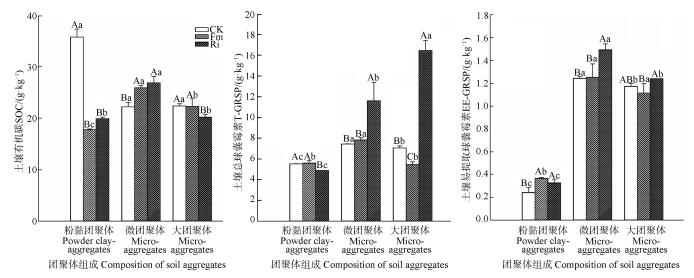
图 2显示,Fm和Ri处理显著增加微团聚体SOC含量,但降低其他粒级SOC含量。与CK相比,Fm显著降低大团聚体T-GRSP含量,对其他粒级影响不显著; 而Ri显著增加大团聚体和微团聚体T-GRSP含量,显著降低粉黏团聚体T-GRSP含量。同一处理各粒级间T-GRSP含量差异显著,其中CK和Fm微团聚体中最高,而Ri表现为大团聚体中最高。接种F. mosseae和R. intraradices显著增加粉黏团聚体EE-GRSP含量,但接种R. intraradices对大团聚体和微团聚体EE-GRSP含量的影响显著大于接种F. mosseae。同一处理均表现为微团聚体中EE-GRSP含量最高,而粉黏团聚体中最低。表 2显示,Fm和Ri对土壤有机碳的效应为负,尤其Ri达-9.17%。土壤T-GRSP的占比在25.5%~76.5%之间,土壤EE-GRSP的占比在4.87%~5.93%之间,并且Ri均高于Fm。
|
注:不同大写字母表示同一粒级不同处理间差异显著(P < 0.05),不同小写字母表示同一处理不同粒级间差异显著(P < 0.05)。误差线为标准偏差(n=3)。 Note:Different capital letters indicate significant difference(P < 0.05)among treatments in the same composition of soil aggregates. Different small letters indicate significant different(P < 0.05)among soil compositions in the same treatment. The error bar is standard deviation(n=3). 图 2 土壤有机碳和GRSP含量 Fig. 2 Contents of soil organic carbon and glomalin-related soil protein relative to treatment |
|
|
表 2 不同处理下土壤有机碳变化及接种效应、土壤球囊霉素占比 Table 2 Soil organic carbon, effects of AM inoculation and proportion of glomalin-related soil protein in soil organic carbon relative to treatment |
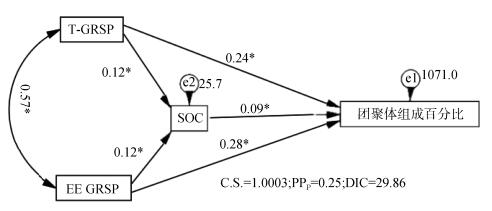
由图 3中聚敛统计量C.S. < 1.002、事后预测p值PPp介于0.05~0.95之间、差异信息准则DIC > 10,说明模型为适配模型。根据标准化路径系数可知,T-GRSP、EE-GRSP和SOC对各粒径组成表现为正向显著影响。效应分析结果表明(表 3),各影响因子总效应表现为EE-GRSP > T-GRSP > SOC,因而EE-GRSP是影响团聚体组成的主要驱动因子。
|
注:图中双向箭头(即T-GRSP与EE-GRSP之间箭头)表示两个变量间为共变关系,单向箭头表示因变量对果变量的直接因果关系,线条旁数据为路径系数(*,P < 0.05)。下同。 Note:In the figure, two-way arrows indicate that the two variables are covariant, and the one-way arrows do they are in direct causal relationship, and the data next to the line is the path factor(*, P < 0.05). The same below. 图 3 GRSP、SOC对团聚体组成影响的结构方程模型 Fig. 3 Structural equation model(SEM)showing effects of GRSP and SOC on soil aggregate composition |
|
|
表 3 GRSP、SOC对土壤团聚体组成的效应分析 Table 3 Effects of GRSP and SOC on soil aggregate composition |
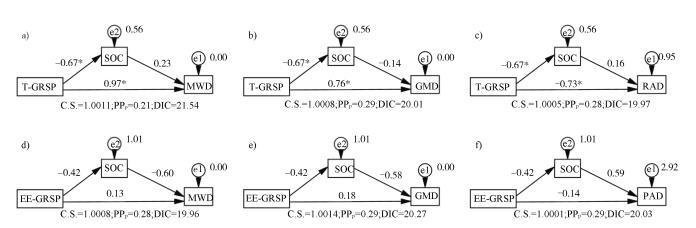
如图 4a ~图 4c所示,T-GRSP显著影响MWD、GMD和PAD,并对SOC有显著的负影响作用,但SOC对各稳定性指标影响不显著。EE-GRSP和SOC对各稳定性指标影响均不显著(图 4d~图 4f)。效应分析结果表明(表 4),T-GRSP是土壤团聚体稳定性的主要影响因子,其总效应最高。
|
注:a-c分别为T-GRSP与SOC对土壤团聚体MWD、GMD和PAD影响; d-f分别为EE-GRSP与SOC对土壤团聚体MWD、GMD和PAD影响。 Note:a-c:Effects of T-GRSP and SOC on MWD, GMD and PAD, respectively; and d-f:Effects of EE-GRSP and SOC on MWD, GMD and PAD, respectively. 图 4 GRSP、SOC对团聚体稳定性影响的结构方程模型 Fig. 4 SEM showing effects of GRSP and SOC on soil aggregate stability |
|
|
表 4 GRSP、SOC对土壤团聚体稳定性的效应分析 Table 4 Effects of GRSP and SOC on soil aggregate stability |
干旱胁迫条件下,AM真菌通过影响土壤大团聚体的形成和水稳性团聚体稳定性调节土壤结构[20]。汪三树等[21]研究表明,石漠化区域桑树地梗土壤粒径大于0.25 mm的水稳性团聚体含量为30.78%~45.19%,湿筛条件下距地埂30 cm处土壤MWD和GMD变化范围分别为0.507~0.785 mm和0.220~0.315 mm。彭思利等[22]通过对小麦接种AM真菌后,利用湿筛法对西南地区中性紫色土土壤团聚体相关指标分析表明,其中接种F. mosseae的菌根室中 > 0.25 mm水稳性团聚体含量、MWD和GMD分别较根室高出15.7%、29.2%和17.9%。本研究发现,接种R. intraradices的桑树根围土壤大团聚体百分含量、MWD和GMD显著提高,而
PAD显著降低,表明AM真菌对土壤团聚体形成及抵抗雨水侵蚀有积极作用。这种作用可能是因为外延菌丝将土壤机械的缠绕在一起,从而影响土壤水稳性大团聚体的形成及稳定性[7-8]。研究表明,AM真菌侵染率与菌丝密度呈正相关关系[16],所接菌剂侵染率高则对土壤团聚体形成与水稳性具有更明显的促进作用。然而,本试验结果与其相反,实际表现为接种R. intraradices侵染率低于接种F. mosseae,但对改善土壤团聚体形成及增强土壤团聚体的水稳定性的效果最为显著。这与植物接种AM真菌菌丝、孢子所释放的GRSP有一定关系[15]。
GRSP广泛存在于自然界,其黏附能力较其他碳水化合物强3倍~10倍,可将土壤细小颗粒胶结成较大的土壤团粒结构,因而被称为“超级胶水”[23]。本研究结果显示,接种R. intraradices菌剂后,土壤大团聚体、微团聚体T-GRSP含量和粉黏团聚体EE- GRSP含量均显著提高,从而说明接种R. intraradices的桑树根围土壤GRSP对大团聚体改善及稳定性有明显的促进作用。AM真菌能够分泌GRSP,其主要成分是蛋白质和碳水化合物,是SOC形成的重要来源,目前已被视为土壤有机碳库的重要组成之一[24]。本研究结果(图 2,表 2)显示,接种AM真菌降低大团聚体却增加微团聚体中SOC含量,并且接种F. mosseae处理中T-GRSP和EE-GRSP含量较低,对SOC占比有所降低,但接种R. intraradices释放的GRSP较多,对SOC占比明显较高。这说明AM真菌与桑树根系短期共生时,大团聚体中SOC易分解,较不稳定,而微团聚体对SOC有重要的物理保护作用,增强了SOC的固持能力。同时,接种AM真菌对SOC的影响,与菌剂类型及其释放的GRSP含量差异显著有关。已有研究发现,AM真菌释放的GRSP含量与根际环境(如土壤含水量)、AM真菌特性(如菌丝密度)密切相关[25],后期可能需要探索不同水分条件下、不同孢子数的菌剂释放GRSP能力,进而对SOC贡献。
3.2 GRSP、SOC对团聚体组成与稳定性的影响机制GRSP和SOC是土壤团聚体形成的重要胶结剂。本研究结果(图 3,表 3)显示T-GRSP、EE-GRSP和SOC对团聚体形成的直接效应均为正,并且对团聚体形成的影响显著,从而解释GRSP与SOC两种胶结物质能够增强土壤团聚体的胶连作用,使微团聚体黏结在一起,进而通过菌丝体缠绕形成大团聚体[26]。并且,T-GRSP和EE-GRSP对SOC产生显著的正效应,表明SOC受GRSP影响。AM真菌产生的GRSP是团聚体中有机碳组成部分之一,其浓度高低影响SOC含量变化,进而通过SOC对团聚体形成产生间接效应[27]。因此,各胶结剂对土壤团聚体形成的影响需要综合直接效应和间接效应进行评价,即讨论总效应,其中T-GRSP、EE-GRSP和SOC所产生的总效应分别为0.25、0.29和0.09,表明AM真菌参与过程中GRSP对团聚体形成起重要作用。这可能是GRSP包含有丰富的官能团、矿物质、Ols、Si2p、Al2p等元素、蛋白质、腐殖酸等有关[28],这些组分是土壤团聚体形成的基础与核心[29]。同时,研究结果显示,微团聚体组成高于粉黏团聚体,且微团聚体中GRSP含量明显较高,表明土壤团聚体形成过程中,作为“超级胶水”的GRSP将土壤粉黏团聚体胶结为微团聚体,进而形成大团聚体[30]。因而,本研究较为支持Tisdall和Oades[31]的观点,即土壤团聚体的形成由小团聚体胶结成大团聚体,下一步研究尚需深入探索具体的形成机制。
土壤团聚体的稳定性是其重要的物理性质,受土壤多糖类物质、有机质等影响。GRSP是AM真菌菌丝分泌的一种糖蛋白,本研究结果(图 4,表 4)显示T-GRSP对MWD和GMD的直接效应大于EE-GRSP,加上通过SOC对各因子的间接效应后,T-GRSP产生的总效应仍大于EE-GRSP。T-GRSP对PAD的直接效应,加上通过SOC对PAD的间接效应,其所产生的总效应小于EE-GRSP。这种因果关系整体反映桑树接种AM真菌后,土壤团聚体稳定性易受T-GRSP影响。本研究支持了吴强盛等[15]研究观点,即T-GRSP和EE-GRSP对团聚体形成与稳定有分工上的差异,且团聚体稳定性主要依赖T- GRSP。与EE-GRSP相比,T-GRSP的性质十分稳定不容易发生改变,从而引起团聚体稳定性较强[32]。同时,研究结果(图 1和图 3)还表明,团聚体稳定性强弱与GRSP分泌受到AM真菌类型影响,接种R. intraradices的效应明显高于接种F. mosseae,因而在将AM真菌用于岩溶区土壤质量环境改善时,有必要筛选较有效的菌种,从而获得更高的效益。
4 结论AM真菌参与下桑树根围土壤团聚体得以改善,且接种R. intraradices易于提高大团聚体与微团聚体中T-GRSP含量,以及粉黏团聚体EE-GRSP含量。AM真菌与桑树根系短期共生时,大团聚体中SOC易分解,较不稳定,而微团聚体对SOC有重要的物理保护作用,增强了SOC的固持能力。同时,接种AM真菌对SOC的影响,与GRSP含量差异相关,其中接种R. intraradices释放的GRSP较多,对SOC占比明显较高。此外,GRSP对土壤团聚体的形成与稳定影响较大,其中土壤团聚体形成主要依赖于EE-GRSP,而稳定性受T-GRSP影响最大。在将AM真菌用于岩溶区土壤质量环境改善时,有必要筛选较有效的菌种,从而获得更高的效益。
| [1] |
熊康宁, 李晋, 龙明忠. 典型喀斯特石漠化治理区水土流失特征与关键问题. 地理学报, 2012, 67(7): 878-888. Xiong K N, Li J, Long M Z. Features of soil and water loss and key issues in demonstration areas for combating Karst rocky desertification (In Chinese). Acta Geographica Sinica, 2012, 67(7): 878-888. (  0) 0) |
| [2] |
陈洪松, 聂云鹏, 王克林. 岩溶山区水分时空异质性及植物适应机理研究进展. 生态学报, 2013, 33(2): 317-326. Chen H S, Nie Y P, Wang K L. Spatio-temporal heterogeneity of water and plant adaptation mechanisms in Karst regions:A review (In Chinese). Acta Ecologica Sinica, 2013, 33(2): 317-326. (  0) 0) |
| [3] |
Barthès B, Roose E. Aggregate stability as an indicator of soil susceptibility to runoff and erosion; validation at several levels . Catena, 2002, 47(2): 133-149.
(  0) 0) |
| [4] |
江春玉, 刘萍, 刘明, 等. 不同肥力红壤水稻土根际团聚体组成和碳氮分布动态. 土壤学报, 2017, 54(1): 138-149. Jiang C Y, Liu P, Liu M, et al. Dynamics of aggregates composition and C, N distribution in rhizosphere of rice plants in red paddy soils different in soil fertility (In Chinese). Acta Pedologica Sinica, 2017, 54(1): 138-149. (  0) 0) |
| [5] |
van der Heijden M G A, Streitwolf-Engel R, Riedl R, et al. The mycorrhizal contribution to plant productivity, plant nutrition and soil structure in experimental grassland . New Phytologist, 2006, 172(4): 739-752.
(  0) 0) |
| [6] |
李涛, 赵之伟. 丛枝菌根真菌产球囊霉素研究进展. 生态学杂志, 2005, 24(9): 1080-1084. Li T, Zhao Z W. Advances in researches on glomalin produced by arbuscular mycorrhizal fungi (In Chinese). Chinese Journal of Ecology, 2005, 24(9): 1080-1084. (  0) 0) |
| [7] |
彭思利, 申鸿, 郭涛. 接种丛枝菌根真菌对土壤水稳性团聚体特征的影响. 植物营养与肥料学报, 2010, 16(3): 695-700. Peng S L, Shen H, Guo T. Influence of mycorrhizal inoculation on water stable aggregates traits (In Chinese). Plant Nutrition and Fertilizer Science, 2010, 16(3): 695-700. (  0) 0) |
| [8] |
冯固, 张玉凤, 李晓林. 丛枝菌根真菌的外生菌丝对土壤水稳性团聚体形成的影响. 水土保持学报, 2001, 15(4): 99-102. Feng G, Zhang Y F, Li X L. Effect of external hyphae of arbuscular mycorrhizal plant on water-stable aggregates in sandy soil (In Chinese). Journal of Soil and Water Conservation, 2001, 15(4): 99-102. (  0) 0) |
| [9] |
Kim J C, Choi Y H, Moon J Y, et al. Growth stimulation of mulberry trees in unsterilized soil under field conditions with VA mycorrhizal inoculation . Korean Journal of Sericultural Science, 1984, 26(2): 7-10.
(  0) 0) |
| [10] |
Zhang Z B, Zhou H, Lin H, et al. Puddling intensity, sesquioxides, and soil organic carbon impacts on crack patterns of two paddy soils . Geoderma, 2016, 262: 155-164.
(  0) 0) |
| [11] |
Zhang S X, Li Q, Lü Y, et al. Contributions of soil biota to C sequestration varied with aggregate fractions under different tillage systems . Soil Biology & Biochemistry, 2013, 62: 147-156.
(  0) 0) |
| [12] |
彭思利, 申鸿, 张宇亭, 等. 不同丛枝菌根真菌侵染对土壤结构的影响. 生态学报, 2012, 32(3): 863-870. Peng S L, Shen H, Zhang Y T, et al. Compare different effect of arbuscular mycorrhizal colonization on soil structure (In Chinese). Acta Ecologica Sinica, 2012, 32(3): 863-870. (  0) 0) |
| [13] |
李安定, 卢永飞, 韦小丽, 等. 花江喀斯特峡谷地区不同小生境土壤水分的动态研究. 中国岩溶, 2008, 27(1): 56-62. Li A D, Lu Y F, Wei X L, et al. Studies on the regime of soil moisture under different microhabitats in Huajiang Karst valley (In Chinese). Carsologica Sinica, 2008, 27(1): 56-62. (  0) 0) |
| [14] |
Phillips J M, Hayman D S. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection . Transactions of the British Mycological Society, 1970, 55(1): 158-161.
(  0) 0) |
| [15] |
吴强盛, 袁芳英, 费永俊, 等. 菌根真菌对白三叶根际团聚体稳定性、球囊霉素相关土壤蛋白和糖类物质的影响. 草业学报, 2014, 23(4): 269-275. Wu Q S, Yuan F Y, Fei Y J, et al. Effects of arbuscular mycorrhizal fungi on aggregate stability, GRSP, and carbohydrates of white clover (In Chinese). Acta Prataculturae Sinica, 2014, 23(4): 269-275. (  0) 0) |
| [16] |
Wright S, Upadhyaya A. A survey of soils for aggregate stability and glomalin, a glycoprotein produced by hyphae of arbuscular mycorrhizal fungi . Plant and Soil, 1998, 198(1): 97-107.
(  0) 0) |
| [17] |
Janos D P, Garamszegi S, Beltran B. Glomalin extraction and measurement . Soil Biology & Biochemistry, 2008, 40(3): 728-739.
(  0) 0) |
| [18] |
鲍士旦. 土壤农化分析. 北京: 中国农业出版社, 2000. Bao S D. Soil and agricultural chemistry analysis (In Chinese). Beijing: China Agriculture Press, 2000. (  0) 0) |
| [19] |
吴明隆. 结构方程模型:AMOS实务进阶. 重庆: 重庆大学出版社, 2013. Wu M L. Structural equation modeling-Practical advancement of AMOS (In Chinese). Chongqing: Chongqing University Press, 2013. (  0) 0) |
| [20] |
叶佳舒, 李涛, 胡亚军, 等. 干旱条件下AM真菌对植物生长和土壤水稳定性团聚体的影响. 生态学报, 2013, 33(4): 1080-1090. Ye J S, Li T, Hu Y J, et al. Influences of AM fungi on plant growth and water-stable soil aggregates under drought stresses (In Chinese). Acta Ecologica Sinica, 2013, 33(4): 1080-1090. (  0) 0) |
| [21] |
汪三树, 黄先智, 史东梅, 等. 基于Le Bissonnais法的石漠化区桑树地埂土壤团聚体稳定性研究. 生态学报, 2013, 33(18): 5589-5598. Wang S S, Huang X Z, Shi D M, et al. Study on soil aggregates stability of mulberry ridge in rocky desertification based on Le Bissonnais method (In Chinese). Acta Ecologica Sinica, 2013, 33(18): 5589-5598. (  0) 0) |
| [22] |
彭思利, 申鸿, 袁俊吉, 等. 丛枝菌根真菌对中性紫色土土壤团聚体特征的影响. 生态学报, 2011, 31(2): 498-505. Peng S L, Shen H, Yuan J J, et al. Impacts of arbuscular mycorrhizal fungi on soil aggregation dynamics of neutral purple soil (In Chinese). Acta Ecologica Sinica, 2011, 31(2): 498-505. (  0) 0) |
| [23] |
Rillig M C, Mummey D L. Mycorrhizas and soil structure . New Phytologist, 2006, 171(1): 41-53.
(  0) 0) |
| [24] |
Rillig M, Wright S, Eviner V T. The role of arbuscular mycorrhizal fungi and glomalin in soil aggregation:Comparing effects of five plant species . Plant and Soil, 2002, 238(2): 325-333.
(  0) 0) |
| [25] |
吴强盛, 夏仁学. VA菌根与植物水分代谢的关系. 中国农学通报, 2004, 20(1): 188-192. Wu Q S, Xia R X. The relation between vesicular- arbuscular mycorrhizae and water metabolism in plants (In Chinese). Chinese Agricultural Science Bulletin, 2004, 20(1): 188-192. (  0) 0) |
| [26] |
Driver J D, Holben W E, Rillig M C. Characterization of glomalin as a hyphal wall component of arbuscular mycorrhizal fungi . Soil Biology & Biochemistry, 2005, 37(1): 101-106.
(  0) 0) |
| [27] |
Wilson G W T, Rice C W, Rillig M C, et al. Soil aggregation and carbon sequestration are tightly correlated with the abundance of arbuscular mycorrhizal fungi:Results from long-term field experiments . Ecology Letters, 2009, 12(5): 452-461.
(  0) 0) |
| [28] |
Gillespie A W, Farrell R E, Walley F L, et al. Glomalin-related soil protein contains non-mycorrhizal- related heat-stable proteins, lipids and humic materials . Soil Biology & Biochemistry, 2011, 43(4): 766-777.
(  0) 0) |
| [29] |
张耀方, 赵世伟, 王子龙, 等. 黄土高原土壤团聚体胶结物质的分布及作用综述. 中国水土保持科学, 2015, 13(5): 145-150. Zhang Y F, Zhao S W, Wang Z L, et al. Distribution and function of cementing materials of soil aggregates on the Loess Plateau, Western China (In Chinese). Science of Soil and Water Conservation, 2015, 13(5): 145-150. (  0) 0) |
| [30] |
王建, 周紫燕, 凌婉婷. 球囊霉素相关土壤蛋白的分布及环境功能研究进展. 应用生态学报, 2016, 27(2): 634-642. Wang J, Zhou Z Y, Ling W T. Distribution and environmental function of glomalin-related soil protein:A review (In Chinese). Chinese Journal of Applied Ecology, 2016, 27(2): 634-642. (  0) 0) |
| [31] |
Tisdall J M, Oades J M. Organic matter and water-stable aggregates in soils . Journal of Soil Science, 1982, 33(2): 141-163.
(  0) 0) |
| [32] |
Lovelock C E, Wright S F, Clark D A, et al. Soil stocks of glomalin produced by arbuscular mycorrhizal fungi across a tropical rain forest landscape . Journal of Ecology, 2004, 92(2): 278-287.
(  0) 0) |
2. Sericultural Institute, Guizhou Academy of Agricultural Sciences, Guiyang 550006, China;
3. College of Agriculture, Guizhou University, Guiyang 550025, China
 2020, Vol. 57
2020, Vol. 57


