2. 江苏省有机固体废弃物资源化协同创新中心, 南京 210095;
3. 南京市蔬菜科学研究所, 南京 210042
设施蔬菜栽培具有土地利用率高、生产周期短、受季节影响较小等优点, 已成为我国公民蔬菜消费和农民收入的重要来源[1]。然而, 由于设施蔬菜作物的连续单一种植、肥料投入量大以及设施环境相对封闭, 造成与土壤相关的障碍问题日益突出, 如土壤酸化和盐渍化、土壤养分失衡、土传病害频发等[2-3]。尤其是根部病虫害的发生直接影响了蔬菜的正常生长发育, 其中, 根结线虫作为设施内普遍发生且危害严重的植物土传病害之一, 已成为限制设施蔬菜生产与可持续发展的重要障碍因子[4]。由于根际是植物和土壤的桥梁, 能够灵敏地反馈植物和土壤的健康状况, 并同时影响土壤和植物的健康。因此, 聚焦根际过程中与根系直接相关的病原物, 了解土壤健康尤其是土壤生物群落与植物健康的关系, 逐渐受到越来越多的土壤学家的关注[5]。有关这方面的知识也会在减少农业化学品施用、保障食品安全及保护农业生态环境等绿色发展中发挥越来越重要的作用[6]。
根结线虫是一类在蔬菜生产中普遍存在的植物寄生性线虫, 其寄主范围广, 对茄科作物危害严重[7]。其二龄幼虫仅感染根系, 受害部位形成瘤状根结, 消耗植物的光合产物和养分, 导致植株对其他病虫害的抵抗力下降, 最终造成巨大的经济损失[8]。当前, 连作过程中过量施用化肥进一步恶化了土壤环境[9], 同时也降低了作物对病虫害的抗性, 促进了根结线虫病害的发生[10]。此外, 根际释放的有机物质影响着植物的根际环境, 进一步反馈给根结线虫并诱导其发生[11]。已有的研究表明, 包括根结线虫在内的地下食根动物对寄主的识别和感染依赖于一些根际信号物质, 如酚酸类、黄酮类、糖类和生物碱类化合物等[12-13]。而根系淀积(rhizodeposition)作为植物向土壤生态系统输入有机物的重要途径之一, 其根系淀积物伴随连作年限的不断延长也会诱发某些病原体的定殖和感染[14], 如连作条件下根系淀积物与根结线虫的关系(图 1)。然而, 由于传统上不同学科的研究相对孤立, 现有连作影响病虫害的研究通常未整合根系淀积物等与根结线虫的关系, 限制了对连作条件下根结线虫病害发生规律和机制的认识。

|
图 1 连作条件下根系淀积物与根结线虫关系的概念思路框架(实线箭头代表正面影响, 虚线箭头代表负面影响) Fig. 1 Conceptual framework showing the relationship between rhizodeposits and root-knot nematodes under continuous monocropping systems(Solid arrow represents positive impact and dotted arrow represents negative impact) |
本研究基于番茄不同连作茬数的田间定位实验, 分析根结线虫危害和根系淀积物组成的差异, 探讨土壤化学性质尤其是根系淀积物与根结线虫的关系。研究结果可进一步加深对连作障碍条件下根结线虫病的认识, 为深入了解蔬菜连作中根结线虫发生的微生态机制及研发蔬菜连作障碍修复措施和防控策略提供科学依据。
1 材料与方法 1.1 样品采集和预处理不同连作茬数番茄的根系和土壤采自南京市蔬菜花卉科学研究所内的田间定位实验田(118°46′36.87″ E, 31°43′11.50″ N)。选择具有同样种植历史(辣椒-番茄-菠菜轮作)的相邻大棚(具有同样的土壤基础性质), 分别从2013年、2014年和2016年开始采用番茄连续单一种植制度, 一年分春茬(3—7月)和秋茬(8—12月)番茄, 在2016年秋茬番茄(分别为第2、6、8茬)收获前统一采样。各棚内的施肥和灌溉措施保持一致。土壤类型为淋溶土, 质地为黏壤土(黏粒229 g·kg-1, 粉粒365 g·kg-1, 砂粒406 g·kg-1)。土壤pH 7.21(水), 有机碳18.2 g·kg-1, 全氮3.27 g·kg-1, 全磷3.58 g·kg-1, 全钾19.2 g·kg-1, 矿质氮(铵态氮和硝态氮之和)140.5 mg·kg-1, 有效磷31.5 mg·kg-1, 速效钾719 mg·kg-1。
供试作物为番茄(世纪红冠), 在番茄定植前两天将有机肥(腐熟的鸡粪75 t·hm-2)作为基肥一次性均匀翻施入耕层土壤中。于2016年10月21日分别从第2、6、8茬番茄棚中选择有机肥处理的小区, 每处理3个小区, 小区面积约为8 m2, 每个小区随机选取3株番茄挖掘根系, 共27株。采用抖根法并用毛刷采集植株根际土壤, 同一小区的土壤样品均匀混合。植株用水洗净后观察其形态。部分土壤样品置于液氮中快速冷冻并储存于-80 ℃冰箱待进行化合物提取和气相色谱-飞行时间质谱(GC/TOF-MS)分析, 其余土壤预处理后用于土壤化学性质的测定。
1.2 根际土壤化合物的提取通过改进Yang等[15]研究中样品的提取方法, 分别对不同连作茬数番茄根际土壤中的化学物质进行萃取和衍生化。化合物萃取:称取1.0 g根际土壤样品置于离心管中, 加入甲醇/氯仿(3︰1 v︰v)提取液和乙酸乙酯进行涡旋; 再加入瓷珠, 研磨并超声(冰水浴), 重复5次; 然后将样本离心后小心移取上清液于离心管中。化合物衍生化:先于真空浓缩器中干燥提取物; 再加入甲氧胺盐试剂并轻轻混匀后放入烘箱中80 ℃培养30 min; 然后向每个样品中加入双(三甲基硅烷基)三氟乙酰胺(BSTFA), 将混合物于70 ℃下培养1.5 h。冷却至室温, 样品采用气相色谱仪(Agilent 7890, 安捷伦科技有限公司)随机顺序上机检测。
1.3 分析方法土壤有机质采用外加热重铬酸钾氧化—容量法测定; 铵态氮和硝态氮采用2 mol·L-1氯化钾浸提后用流动分析仪(SKALAR San++, 荷兰)测定; 可溶性有机碳采用超纯水浸提后用总有机碳(TOC)分析仪(Elementar Vario EL III, 德国)测定; 土壤有效磷采用NaHCO3浸提, 钼锑抗比色法测定[16]; 土壤速效钾采用NH4OAc浸提, 火焰光度法测定; 土壤pH和电导率(EC)测定时水土比为5︰1。
番茄根结线虫病情评估:根结指数=∑(各级病株数×各级代表值)×100/(调查总株数×最高严重度代表值)[17]。
气相色谱-飞行时间质谱联用仪(Agilent 7890, 安捷伦科技有限公司)配有Agilent Rxi-5MS毛细管柱(30 m × 250 μm × 0.25 μm, 美国)。GC/TOF-MS分析条件如下:进样量为1 μL, 分流比10:1, 载气为氦气, 前进样口吹扫流速为3 mL·min-1, 柱流速为1 mL·min-1, 程序升温(50 ℃保持0.5 min, 以15 ℃·min-1的速率上升至320 ℃, 并保持10 min), 前进样口温度为280 ℃, 传输线温度为320 ℃; 离子源温度为230 ℃, 电离电压为-70 eV, 质量范围为50~500 m·z-1, 扫描速率为10 s-1, 溶剂延迟时间为4 min。
1.4 数据分析使用MS-DIAL软件对质谱原始数据进行峰提取、基线矫正、解卷积、峰积分和峰对齐等分析[18]; 使用Fiehn Binbase数据库对物质定性[19], 选用匹配度大于700、保留时间偏差(RI)小于5%的化合物[20]。将化合物的原始数据上传至MetaboAnalyst 4.0进行标准化:中值归一化、对数转换和自动数据缩放[21]。在软件R 3.3.2中对已鉴定化合物进行非度量多维尺度分析(NMDS), 可以直观地体现不同连作茬数番茄之间化合物的差异; 然后进行偏最小二乘法判别分析和t检验, 根据变量投影重要性值(阈值大于1.2)和t检验的P值(P < 0.05)来确定差异性表达的化合物[22]。用Statistics 7.1统计软件对数据进行分析, 采用单因素方差分析并用最小显著差异(LSD)法进行处理之间的差异显著性检验(P < 0.05)。使用R软件对化合物组成及根结指数进行斯皮尔曼(Spearman)相关性分析, 并用Gephi 0.9.2软件和Fruchterman Reingold算法分别对不同连作茬数番茄的根系淀积物组分与土壤化学性质和根结指数的相关性结果进行网络可视化。
2 结果 2.1 连作茬数对根际土壤化学性质的影响连作茬数显著影响了根际土壤养分含量。与连作2茬相比, 连作8茬后土壤铵态氮(NH4+-N)和溶解性有机碳(DOC)含量分别下降了4.31%和15.07%, 差异显著; 随着连作茬数的增加, 土壤有机碳(SOC)含量显著升高, 硝态氮(NO3--N)含量先升高后降低。此外, 土壤pH随着连作茬数的增加而降低(表 1)。
|
|
表 1 不同连作茬数番茄根际土壤化学性质 Table 1 Chemical properties of the rhizosphere of monocropping tomato relative to history of monocropping |
随着连作茬数的增加, 侧根和须根上的根结数越来越多, 并连接成串珠状, 造成根系肿胀、畸形, 在连作8茬番茄中表现最为严重; 相应地, 番茄的根结指数随着连作茬数的增加而增大(图 2)。
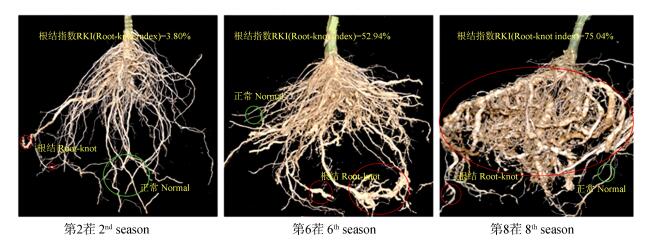
|
注:红色圆圈区域表示根结部位, 绿色圆圈区域表示根系的正常部位。 Note:The red circle indicates the part where root-knots from, and the green circle indicates the part of normal roots. 图 2 不同连作茬数下的番茄根系形态 Fig. 2 Morphology of tomato roots relative to history of monocropping |
从番茄根际土壤中共鉴定出150种化合物, 连作茬数对这些化合物的组分及相对含量有显著影响, 且差异随着连作茬数的增加而增大(图 3)。根系淀积物主要包括醇类、有机酸类、氨基酸类、糖类、萜类、生物碱和甾族化合物等。其中有机酸类化合物的数量最多、相对含量最高, 且在第6茬和第8茬中有机酸种类(51种和52种)显著多于第2茬(46种); 在第2茬处理中未检测到生物碱类物质, 但其相对含量在第6茬和第8茬中较高, 分别为8.96%和9.33%(表 2)。
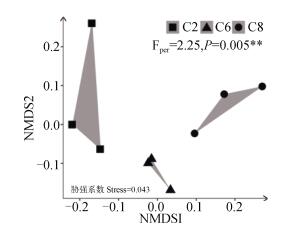
|
注:Per(PerMANOVA):非参数多元方差分析; □ C2代表第2茬番茄; △ C6代表第6茬番茄; ○ C8代表第8茬番茄。下同。 Note:Per(PerMANOVA):Permutational Multivariate Analysis of Variance; □ C2, 2nd season of tomato; △ C6, 6th season of tomato; ○ C8, 8th season of tomato. The same below. 图 3 不同连作茬数番茄根际土壤中化合物的非度量多维尺度分析(NMDS) Fig. 3 Nonmetric multidimensional scaling(NMDS)plot of the compounds in the rhizosphere of the tomato relative to history of monocropping |
|
|
表 2 不同连作茬数下根系淀积物的组分及相对含量 Table 2 Composition and relative contents of its components in the rhizodeposits relative to history of monocropping |
在偏最小二乘法判别分析中, 变量投影重要性值大于1.2的候选差异化合物有25种, 结合t检验确定了在不同连作茬数间具有显著差异(P < 0.05)的11种化合物。其中, D-半乳糖、L-苹果酸和草酸等化合物在第2茬中有较高水平, 而间羟基苯丙酸、百里香酚、月桂酸、水杨酸、琥珀酸和颠茄碱等在第6茬和第8茬中的水平显著高于第2茬(图 4)。
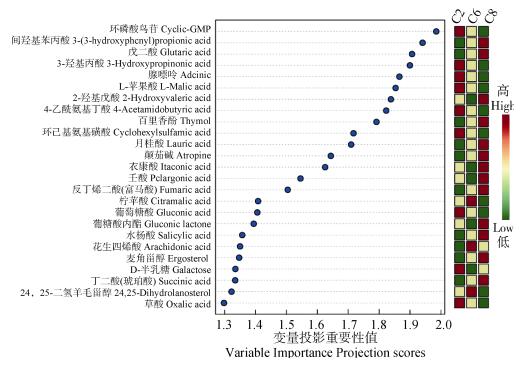
|
注:图右侧的彩色方框表示每个处理中对应化合物的相对含量。 Note:The colored square boxes on the right of figure indicate relative content of the corresponding compounds, relative to treatment. 图 4 不同连作茬数番茄根际差异化合物的变量投影重要性预测值分布 Fig. 4 Distribution of predictions of importance of variable projections of differential compounds in the tomato rhizosphere relative to history of monocropping |
第2茬的网络连接度最高(平均度为9.484), 平均路径长度(5.744)和网络直径(18)最小, 随着连作茬数的增加, 网络连通度降低, 表明连作降低了网络的复杂性; 与第2茬相比, 第6和第8茬网络中的节点数增加, 化合物种类增多; 各网络均达到了模块化程度(模块化指数大于0.44), 连作增加了网络的模块化系数, 表明网络的内部形成不同模块的可能性增加(表 3, 图 5a))。其中, 差异化合物与土壤化学性质和根结指数的关系比较密切, 与土壤pH呈负相关的是间羟基苯丙酸、水杨酸和琥珀酸; 与含量呈正相关是间羟基苯丙酸、水杨酸和颠茄碱; 与AP含量呈负相关的是麦角甾醇。此外, 代表根结指数的节点随着连作茬数的增加其与其他化合物的相关性明显增大, 在第2和第6茬中与月桂酸含量呈正相关; 在第8茬中与月桂酸含量呈负相关, 与土壤含量以及颠茄碱和麦角甾醇的含量呈正相关(图 5b))。
|
|
表 3 不同连作茬数番茄网络拓扑结构指标 Table 3 Network topology structure indices of the tomato relative to history of monocropping |
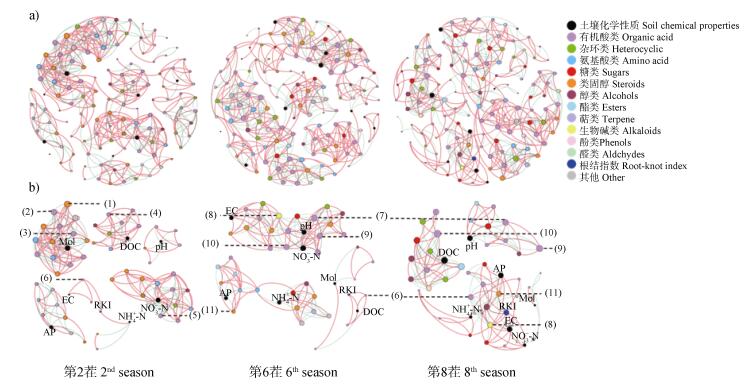
|
注:连线代表相关系数大于0.6(正相关-红线)或小于-0.6(负相关-绿线)和统计学显著性(P < 0.05)。不同颜色的节点表示不同的化合物质、土壤化学性质和根结指数, 并且节点的大小与连接数(度)成正比。差异化合物包括:(1)D-半乳糖; (2)L-苹果酸; (3)草酸; (4)葡萄糖酸; (5)3-羟基丙酸; (6)月桂酸; (7)间羟基苯丙酸; (8)颠茄碱; (9)水杨酸; (10)琥珀酸; (11)麦角甾醇。Moi:土壤湿度; RKI:根结指数。 Note:Continuous lines stand for correlation coefficient > 0.6(positive correlation-red line)or < -0.6(negative correlation-green line)and statistical significance(P < 0.05). Nodes different in color indicate different compounds, soil chemical properties and root-knot index, and size of the node is proportional to degree of the connection(degree). Differential compounds include(1)Galactose, (2)L-Malic acid, (3)Oxalic acid, (4)Gluconic acid, (5)3-Hydroxypropionic acid, (6)Lauric acid, (7)3-(3-hydroxyphenyl)propionic acid, (8)Atropine, (9)Salicylic acid, (10)Succinic acid, and(11)Ergosterol. Moi:soil moisture; and RKI:root-knot index. 图 5 不同连作茬数番茄的根系淀积物、土壤化学性质和根结指数的共现网络 a)根系淀积物中的所有化合物, b)根系淀积物中的差异化合物 Fig. 5 Network co-occurrence analysis of rhizodeposits, soil chemical properties and root-knot index relative to history of monocropping a)All compounds in rhizodeposits, and b)Differential compounds in rhizodeposits |
番茄连茬种植后土壤pH下降, 而硝态氮含量升高, 一方面因为长期高强度单作从土壤中选择性地吸收较多的碱基元素和中微量元素, 导致土壤向酸化方向发展[23]; 另一方面, 棚内施肥量和蒸发量较大, 导致土壤中硝酸盐累积及土壤表层的次生盐渍化[24]。连作对番茄根系淀积物的组分及其相对含量有显著影响, 其中, 有机酸类物质的数量和相对含量伴随连作茬数的增加而增加(表 2), 而多数有机酸类物质被认为是化感物质或自毒物质, 当其积累到一定水平, 能直接影响自身或周围植株的生长, 这是导致作物发生连作障碍的重要原因之一[25]。此外, 连作茬数的增加导致番茄根结指数增大, 这表明根结线虫病情随着连作时间的延长而不断加剧[26]。主要是因为在设施栽培条件下, 连茬种植不仅导致根系淀积物中自毒物质的积累, 而且伴随着根际土壤生物群落结构和多样性的破坏, 如土壤中有益生物减少而有害病原物增多, 抑制植株生长并降低其抗性, 促使根结线虫等土传病害发生[27]。同时, 连茬种植改变了根际土壤的线虫群落结构, 使根结线虫成为优势种群, 且土壤中病虫基数不断增大, 致使根结线虫病害持续流行并逐年加重[28]。此外, 由于连茬种植同种作物, 根系向根际反复释放相似的组分, 不仅改变了根际土壤环境, 还可能诱发根结线虫的发生[29]。
3.2 连作茬数影响下根系淀积物与根结线虫的关系根际是根结线虫的主要活动空间, 根际土壤环境的变化特别是根系淀积物中化合物组分及含量的变化密切联系着根结线虫的生存及活动[11]。本研究发现番茄根系淀积物中的有机酸类物质, 如间羟基苯丙酸、水杨酸、百里香酚、琥珀酸、月桂酸等的相对含量随着连作茬数的增加而不断升高(图 4)。其中, 间羟基苯丙酸和水杨酸等酚酸类化合物被认为是土壤和植物根系分泌物中普遍存在的化感物质[30], 琥珀酸对番茄青枯病有正趋化作用[31], 这些物质在根际中随着连作茬数的增加而不断积累, 间接降低了植株抵抗病虫害的能力, 从而有利于根结线虫的成功侵染。有研究表明, 水杨酸能合成水杨酸甲酯, 这种物质有助于根结线虫二龄幼虫(J2)对宿主的识别行为[32]。此外, 有研究证明根际中的月桂酸在低浓度(0.5~2.0 mmol·L-1)时能吸引根结线虫并使其致死, 高浓度(4.0 mmol·L-1)时能直接趋避根结线虫[33]; 百里香酚作为一种天然杀菌剂对根结线虫的二龄幼虫也有致死作用[34]。根际中这些抗性物质的相对含量随着连作茬数的增加而增加, 说明植株根系受到根结线虫侵染后会分泌一些特异性物质来启动自身的防御机制[35], 而这些化合物对今后开发根结线虫的新型控制策略具有潜在的利用价值。
研究结果发现连作茬数增加后, 根系淀积物中化合物的种类增多, 但由土壤化学性质、根系淀积物和根结指数构成的网络结构图的整体复杂程度略有降低, 模块化程度增加(图 5), 说明连作导致了根际土壤中化合物的不均衡累积。随着连作茬数的增加, 与土壤化学性质和根结指数间关系密切的化合物组分相应改变, 表现为网络中节点的连接度越大, 与其相连组分间的关系越强[36]。网络中与根结指数关系较强的节点随着连作茬数的增加而增多。其中, 月桂酸在低茬番茄中与根结指数呈正相关, 在连作8茬时与根结指数呈负相关, 而月桂酸含量随着连作茬数的增加而升高, 符合前人报道的月桂酸对根结线虫调控的浓度效应[33]。在连作8茬中, 根结指数还与根系淀积物中颠茄碱和麦角甾醇的含量呈正相关, 说明连茬种植后根际中颠茄碱和麦角甾醇含量的增加可能对根结线虫有正趋化作用, 然而这些物质与根结线虫的功能关系尚未见报道。今后进一步的研究可通过分离纯化或合成等途径以揭示特定的化合物在根结线虫-宿主关系中的作用。
此外, 连作条件下番茄根系淀积物的变化与土壤化学性质之间的联系也可影响根结线虫的发生。本研究发现间羟基苯丙酸、水杨酸等有机酸类物质的相对含量与土壤pH呈负相关, 与含量呈正相关(图 5b))。以往的研究主要关注土壤pH的总体变化, 较少地考虑根系淀积物丰富的有机酸类化合物如对羟基苯甲酸、肉桂酸、苯甲酸等的积累是作物连茬种植后土壤pH下降的重要原因[37]。同时, 土壤酸化又是促进根结线虫发生的重要因素[38]。因此, 深入揭示连作对作物病害的影响机制需要同时考虑多种因素的ss综合作用, 今后需要结合多种技术和研究途径才能系统地理解和揭示连作障碍的成因和对策。
4 结论伴随着连作年限的增加, 番茄根结线虫病情加剧, 根际土壤趋于酸化; 且根系淀积物中的化合物种类及含量也相应地改变, 如间羟基苯丙酸、百里香酚、月桂酸、水杨酸、颠茄碱和麦角甾醇等差异化合物不断累积, 并与土壤化学性质、根结指数之间存在密切联系。连作条件下作物根系淀积物的累积与土壤非生物因素的共同作用加重了根结线虫病害的发生。今后应在筛选关键差异化合物的基础上, 通过成分模拟明确根际特殊化合物的功能作用及与生物和非生物因素综合作用对根结线虫发生的影响机制。
致谢 感谢南京农业大学植物保护学院李红梅教授在实验上的指导, 资源与环境科学学院周阳和张宇同学的帮助。
| [1] |
蔡祖聪. 我国设施栽培养分管理中待解的科学和技术问题. 土壤学报, 2019, 56(1): 36-43. Cai Z C. Scientific and technological issues of nutrient management under greenhouse cultivation in China (In Chinese). Acta Pedologica Sinica, 2019, 56(1): 36-43. (  0) 0) |
| [2] |
Han J P, Shi J C, Zeng L Z, et al. Effects of nitrogen fertilization on the acidity and salinity of greenhouse soils . Environmental Science and Pollution Research, 2015, 22(4): 2976-2986.
(  0) 0) |
| [3] |
蔡祖聪, 黄新琦. 土壤学不应忽视对作物土传病原微生物的研究. 土壤学报, 2016, 53(2): 305-310. Cai Z C, Huang X Q. Soil-borne pathogens should not be ignored by soil science (In Chinese). Acta Pedologica Sinica, 2016, 53(2): 305-310. (  0) 0) |
| [4] |
Chen T, Lin S, Wu L K, et al. Soil sickness:Current status and future perspectives . Allelopathy Journal, 2015, 36(2): 167-196.
(  0) 0) |
| [5] |
Philippot L, Raaijmakers J M, Lemanceau P, et al. Going back to the roots:The microbial ecology of the rhizosphere . Nature Reviews Microbiology, 2013, 11(11): 789-799.
(  0) 0) |
| [6] |
孙波, 陆雅海, 张旭东, 等. 耕地地力对化肥养分利用的影响机制及其调控研究进展. 土壤, 2017, 49(2): 209-216. Sun B, Lu Y H, Zhang X D, et al. Research progress on impact mechanisms of cultivated land fertility on nutrient use of chemical fertilizers and their regulation (In Chinese). Soils, 2017, 49(2): 209-216. (  0) 0) |
| [7] |
Seid A, Fininsa C, Mekete T, et al. Tomato(Solanum lycopersicum)and root-knot Nematodes(Meloidogyne spp.)-A century-old battle . Nematology, 2015, 17(9): 995-1009.
(  0) 0) |
| [8] |
Kepenekci I, Hazir S, Oksal E, et al. Application methods of Steinernema feltiae, Xenorhabdus bovienii and Purpureocillium lilacinum to control root-knot nematodes in greenhouse tomato systems . Crop Protection, 2018, 108: 31-38.
(  0) 0) |
| [9] |
高新昊, 张英鹏, 刘兆辉, 等. 种植年限对寿光设施大棚土壤生态环境的影响. 生态学报, 2015, 35(5): 1452-1459. Gao X H, Zhang Y P, Liu Z H, et al. Effects of cultivating years on soil ecological environment in greenhouse of Shouguang City, Shandong Province (In Chinese). Acta Ecologica Sinica, 2015, 35(5): 1452-1459. (  0) 0) |
| [10] |
王小兵, 骆永明, 李振高, 等. 长期定位施肥对红壤地区连作花生生物学性状和土传病害发生率的影响. 土壤学报, 2011, 48(4): 725-730. Wang X B, Luo Y M, Li Z G, et al. Effects of long-term stationary fertilization experiment on incidence of soil-borne diseases and biological characteristics of peanut in continuous monocropping system in red soil area (In Chinese). Acta Pedologica Sinica, 2011, 48(4): 725-730. (  0) 0) |
| [11] |
Čepulytė R, Danquah W B, Bruening G, et al. Potent attractant for root-knot Nematodes in exudates from seedling root tips of two host species . Scientific Reports, 2018, 8: Article number 10847.
(  0) 0) |
| [12] |
Johnson S N, Rasmann S. Root-feeding insects and their interactions with organisms in the rhizosphere . Annual Review of Entomology, 2015, 60(1): 517-535.
(  0) 0) |
| [13] |
van Dam N M, Bouwmeester H J. Metabolomics in the rhizosphere:Tapping into belowground chemical communication . Trends in Plant Science, 2016, 21(3): 256-265.
(  0) 0) |
| [14] |
艾超, 孙静文, 王秀斌, 等. 植物根际沉积与土壤微生物关系研究进展. 植物营养与肥料学报, 2015, 21(5): 1343-1351. Ai C, Sun J W, Wang X B, et al. Advances in the study of the relationship between plant rhizodeposition and soil microorganism (In Chinese). Journal of Plant Nutrition and Fertilizer, 2015, 21(5): 1343-1351. (  0) 0) |
| [15] |
Yang X, Feng L, Zhao L, et al. Effect of Glycine nitrogen on lettuce growth under soilless culture:A metabolomics approach to identify the main changes occurred in plant primary and secondary metabolism . Journal of the Science of Food and Agriculture, 2018, 98(2): 467-477.
(  0) 0) |
| [16] |
鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科学技术出版社, 2000. Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. (  0) 0) |
| [17] |
Jiang C H, Xie P, Li K, et al. Evaluation of root-knot nematode disease control and plant growth promotion potential of biofertilizer Ning shield on Trichosanthes kirilowii in the field . Brazilian Journal of Microbiology, 2018, 49(2): 232-239.
(  0) 0) |
| [18] |
Tsugawa H, Cajka T, Kind T, et al. MS-DIAL:Data-independent MS/MS deconvolution for comprehensive metabolome analysis . Nature Methods, 2015, 12(6): 523-526.
(  0) 0) |
| [19] |
Kind T, Wohlgemuth G, Lee D Y, et al. FiehnLib:mass spectral and retention index libraries for metabolomics based on quadrupole and time-of-flight gas chromatography/mass spectrometry . Analytical Chemistry, 2009, 81(24): 10038-10048.
(  0) 0) |
| [20] |
Yang X, Wei S W, Liu B, et al. A novel integrated non-targeted metabolomic analysis reveals significant metabolite variations between different lettuce(Lactuca sativa. L)varieties . Horticulture Research, 2018, 5: Article number 33.
(  0) 0) |
| [21] |
Chong J, Soufan O, Li C, et al. MetaboAnalyst 4.0:Towards more transparent and integrative metabolomics analysis . Nucleic Acids Research, 2018, 46(W1): W486-W494.
(  0) 0) |
| [22] |
Wiklund S, Johansson E, Sjö strö m L, et al. Visualization of GC/TOF-MS-based metabolomics data for identification of biochemically interesting compounds using OPLS class models . Analytical Chemistry, 2008, 80(1): 115-122.
(  0) 0) |
| [23] |
Han J P, Luo Y H, Yang L P, et al. Acidification and salinization of soils with different initial pH under greenhouse vegetable cultivation . Journal of Soils and Sediments, 2014, 14(10): 1683-1692.
(  0) 0) |
| [24] |
Sun H W, Wei C, Xu W S, et al. Characteristics of salt contents in soils under greenhouse conditions in China . Environmental Science and Pollution Research, 2019, 26(4): 3882-3892.
(  0) 0) |
| [25] |
刘苹, 赵海军, 仲子文, 等. 三种根系分泌脂肪酸对花生生长和土壤酶活性的影响. 生态学报, 2013, 33(11): 3332-3339. Liu P, Zhao H J, Zhong Z W, et al. The effects of three root exudated fatty acids on peanut(Arachis hypogaea L.)growth and soil enzymes activities (In Chinese). Acta Ecologica Sinica, 2013, 33(11): 3332-3339. (  0) 0) |
| [26] |
Li X Y, Lewis E E, Liu Q Z, et al. Effects of long-term continuous cropping on soil nematode community and soil condition associated with replant problem in strawberry habitat . Scientific Reports, 2016, 6: Article number 30466.
(  0) 0) |
| [27] |
Li X G, Ding C F, Zhang T L, et al. Fungal pathogen accumulation at the expense of plant-beneficial fungi as a consequence of consecutive peanut monoculturing . Soil Biology and Biochemistry, 2014, 72: 11-18.
(  0) 0) |
| [28] |
马媛媛, 李玉龙, 来航线, 等. 连作番茄根区病土对番茄生长及土壤线虫与微生物的影响. 中国生态农业学报, 2017, 25(5): 730-739. Ma Y Y, Li Y L, Lai H X, et al. Effect of sick rhizosphere soil under tomato continuous cropping on soil Nematodes, microbes and tomato growth (In Chinese). Chinese Journal of Eco-Agriculture, 2017, 25(5): 730-739. (  0) 0) |
| [29] |
Dutta T K, Powers S J, Gaur H S, et al. Effect of small lipophilic molecules in tomato and rice root exudates on the behaviour of Meloidogyne incognita and M. Graminicola . Nematology, 2012, 14(3): 309-320.
(  0) 0) |
| [30] |
van de Voorde T F J, Ruijten M, van der Putten W H, et al. Can the negative plant-soil feedback of Jacobaea vulgaris be explained by autotoxicity? . Basic and Applied Ecology, 2012, 13(6): 533-541.
(  0) 0) |
| [31] |
房志颖.解淀粉芽孢杆菌SQY162防控土传番茄青枯病效果及其机理研究[D].南京: 南京农业大学, 2016. Fang Z Y. The effects and mechanisms of Bacillusamyloliquefacien strain SQY162 on biological control of bacterial wilt of tomato[D]. Nanjing: Nanjing Agricultural University, 2016. (  0) 0) |
| [32] |
Kihika R, Murungi L K, Coyne D, et al. Parasitic nematode Meloidogyne incognita interactions with different Capsicum annum cultivars reveal the chemical constituents modulating root herbivory . Scientific Reports, 2017, 7: Article number 2903.
(  0) 0) |
| [33] |
Dong L L, Li X L, Huang L, et al. Lauric acid in crown daisy root exudate potently regulates root-knot nematode chemotaxis and disrupts Mi-flp-18 expression to block infection . Journal of Experimental Botany, 2014, 65(1): 131-141.
(  0) 0) |
| [34] |
Nahar K, Kyndt T, de Vleesschauwer D, et al. The jasmonate pathway is a key player in systemically induced defense against root knot Nematodes in rice . Plant Physiology, 2011, 157(1): 305-316.
(  0) 0) |
| [35] |
Manosalva P, Manohar M, von Reuss S H, et al. Conserved nematode signalling molecules elicit plant defenses and pathogen resistance . Nature Communications, 2015, 6: Article number 7795.
(  0) 0) |
| [36] |
Hu C Y, Shi J X, Quan S, et al. Metabolic variation between japonica and indica rice cultivars as revealed by non-targeted metabolomics . Scientific Reports, 2015, 4: Article number 5067.
(  0) 0) |
| [37] |
赵宽, 周葆华, 马万征, 等. 不同环境胁迫对根系分泌有机酸的影响研究进展. 土壤, 2016, 48(2): 235-240. Zhao K, Zhou B H, Ma W Z, et al. The influence of different environmental stresses on root-exuded organic acids:A review (In Chinese). Soils, 2016, 48(2): 235-240. (  0) 0) |
| [38] |
Wang C L, Lower S, Williamson V M. Application of pluronic gel to the study of root-knot nematode behaviour . Nematology, 2009, 11(3): 453-464.
(  0) 0) |
2. Jiangsu Collaborative Innovation Center for Solid Organic Waste Resource Utilization, Nanjing 210095, China;
3. Nanjing Institute of Vegetable Science, Nanjing 210042, China
 2020, Vol. 53
2020, Vol. 53


