2. 长江大学农学院, 湖北荆州 434025
2. College of Agriculture, Yangtze University, Jingzhou, Hubei 434025, China
根系是作物吸收水分和养分的主要部位,其生长状态和分布情况是反映作物生长发育的重要标志。土壤盐分胁迫抑制作物根系组织生长和分化,引起作物生理干旱,影响作物养分吸收和产量的形成。研究发现,随着土壤盐含量的增加,作物根深、根长和根量呈显著降低趋势,严重阻碍其正常生长发育,甚至造成作物死亡[1-5]。因此,盐胁迫下对作物根系生长和分布状况进行动态监测,对作物生产管理具有重要意义[6]。
土壤是作物的主要生长基质,同时也给根系生长的观测研究带来诸多困难,为了解决这一问题,研究者们提出了一系列根系观测方法。目前,植物根系观测主要采用土钻法、挖掘法等破坏性观测方法,以及微根管法、容器法等非破坏性观测方法[7]。然而就观测方法的精确性和便利性而言,微根管法被认为是根系生长发育动态监测的较好方法。而且随着微根管技术的不断改进,该方法逐渐成为获取植物根系参数最合适的研究方法,它能够实现单个根系或者某个根系片段生长发育变化趋势的长期监测,以进行植物根系生长、死亡和分解等特征的详细研究[8-10]。微根管法的优势在于它能够实现在多个时间段内原位、重复、无损观测根系的生长发育。
利用微根管技术还能够实现作物根系生长动态的可视化,且运用图像处理分析技术易于获取根系的量化信息。目前,微根管法已被广泛应用于农作物[10-12]、草地[13-15]、森林[16-17]等根系研究中。国内外学者利用微根管技术对小根系的研究也已取得一定进展。Box和Ramsuer [9]通过比较微根管法和土钻法获得的小麦细根参数发现,小麦根重密度与根长、根长密度均具有显著正相关关系。Herrera等[18]利用微根管技术监测氮和基因型对小麦根系生长的影响,发现氮是影响小麦根系生长和生存的主要因素。Rose等[19]利用微根管技术观测浅层地下盐水灌溉小麦根系生长和分布状况,发现根长密度随土壤深度的增加而递减,且与盐水浓度呈显著负相关关系。廖荣伟等[20]利用这一技术研究了华北平原小麦根系在土壤中的分布状况,结果表明土壤水分影响小麦根系的生长,充足的土壤水分环境有利于根系的生长,使表层根系增多;轻度干旱有利于根系在中下层的生长延伸。因此,微根管技术的应用,为植物根系生长及其功能的研究提供了有效途径。
国内外学者基于微根管技术对小麦根系的研究已开展了一定工作,但有关利用微根管技术观测盐胁迫下小麦根系生长的研究相对较少。我国土壤盐渍化区域面积广泛[21],且小麦是盐渍化区域重要的栽培作物。因此,本研究通过桶栽实验,设计不同土壤盐分处理,利用微根管技术对盐胁迫下小麦根系的生长进行重复动态监测,以期为盐渍化区域农作物生产的科学管理提供理论依据和技术支持。
1 材料与方法 1.1 实验设计本实验采用桶栽方法,于2013—2014年在中国科学院南京土壤研究所进行。试验点位于118°48′E,32°04′N,海拔12.03 m,属北亚热带湿润气候,四季分明,雨水充沛,年均温15.4℃,年降水量1 106 mm。供试土壤采自中国科学院南京分院东台滩涂研究院试验田。该土壤为潮盐土亚类,母质为近代泥沙沉积物,属粉砂质壤土,土壤呈弱碱性,养分含量较低,含盐量为0.61 g·kg–1,已基本脱盐(表 1)。填装土为经自然风干并过5目筛的土壤,实验桶为直径50 cm、高55 cm的塑料桶。
|
|
表 1 供试土壤基本理化性质 Table 1 Basic physic-chemical properties of the tested soil |
本实验共设6个盐分梯度,土壤含盐量分别为0.61(CK)、1.61(S1)、2.61(S2)、3.61(S3)、4.61(S4)以及5.61 g·kg–1(S5),分别属于非盐渍化土壤、轻盐渍化土壤、中盐渍化土壤、中盐渍化土壤、重盐渍化土壤和盐土[22]。每个浓度水平4个重复(其中2个用于微根管观测,2个用于破坏性取样),共24个实验桶。由于供试土壤已基本脱盐,为获取不同含盐量水平的盐渍土,按不同的盐土比分别向供试土壤中加入相应质量的NaCl。土壤经充分混匀后装入实验桶内,按容重进行压实(容重为1.2 g·cm–3),每桶干土质量约为70.0 kg。每桶加蒸馏水使土壤含水量达田间持水量的75%,以使各处理的最初土壤含水量保持一致,待其稳定3 d后进行播种。供试小麦品种为扬麦16,播种日期为2013年11月20日,每桶播种64株,播种方式为行播。采用常规施肥管理方法施肥,小麦生长期按约225 kg·hm–2的纯氮施入土壤表层,其中基肥和追肥按6︰4比例分别于播种时(复合肥)和拔节期(尿素)施入。小麦生长期间除恶劣天气外均在室外进行,如遇大风大雨天气,则将其移至遮雨棚(图 1a))。根据其需要定量浇水,除草、除虫等按常规高产管理要求进行。

|
图 1 桶栽实验环境(a))及实验设计(b))示意图 Fig. 1 Environment(a))and schematic diagram(b))of the pot in the culture experiment |
本实验采用微根管技术重复观测小麦在不同生长期、不同土壤含盐量下的根系长势状况。微根管技术是指在土壤中埋设透明玻璃管或塑料管,利用照相机通过管与土壤界面对根系生长状况进行非破坏性观察,其最大优点是在不显著影响根系生长的前提下,实时监测植物根系生长的动态变化[9]。本实验微根管的安装方法是在每个盐分梯度中随机选取2个实验桶安装透明的75 cm长、6 cm粗的硬质聚氯乙烯(Polyvinyl chloride,PVC)管,并使其位于2行小麦中间。每根管倾斜45°埋入土壤中,其中埋入70 cm,露出5 cm,且埋在土壤内的底端封死(图 1b))。为避免光照对根系生长的影响,将露出土壤的部分全部涂成黑色,管口用盖子封住避光[23]。
本研究采用“双筒式植物根系原位观测系统装置”[23],利用微型相机(Firefly MV,Point Grey,加拿大)进行根系图像采集。观测时将相机由USB连接线连接至电脑,通过图像数据采集软件FlyCap2(Point Grey,加拿大)显示根系图像,并在图像采集前检查图像,以保证图像质量。数据采集时每隔1 cm土层深度采样一次,每次从0°到360°旋转摄像头,获取18~20张根系图片,图片大小为1 328×1 048像素,以JPG格式存储。
1.3 根系样品采集分别于2014年1月7日(分蘖期)、2014年2月21日(返青期)、2014年3月15日(拔节期)和2014年4月15日(孕穗期)采集样品数据。在进行微根管观测的同时,利用土钻法采集小麦根系作为对照。在未埋设微根管的实验桶内进行破坏性取样,用直径为6 cm土钻分层采集土壤样品(0~10、10~20、20~30、30~40和40~50 cm)。每次在桶内小麦行上和行间取两个点,每层取两个样品,将相同盐分梯度下同一土层深度的样品混合为一个土壤样品[20]。每次取样后均填回等质量、等含盐量的土壤。本实验中所用实验桶相对较大,因此,根系样品采集时上一次取样对下一次取样造成的影响忽略不计。本试验最后获得的根系样品个数为120个。将所采集的根系样品进行清洗,获得干净的小麦根系。
1.4 根系参数获取对根系样品中的粗根长度直接进行测量;细根先用电子天平称量其总质量,再选出一部分测量其长度,计算其根质量/长度比例,并按该比例换算出细根总长度[20]。粗根和细根长度的总和为该样品的根系长度。
根长密度是指单位土壤体积内的根长。基于土钻法的根长密度计算公式为:
| $ {\rho _{\rm{L}}} = {L_1}/V $ | (1) |
式中,ρL为根长密度,cm·cm–3;L1为10 cm厚的土壤体积中的总根长,cm;V为含有根系的土壤样品体积,cm3。
对于微根管法,为了精确地从根系图像中提取根系信息,本研究基于Matlab R2009b(Mathworks,Natick,MA,美国)和ArcGIS10.2(ESRI,Redlands,CA,美国)等图像处理软件,对根系图像进行拼接、灰度图转化、增强对比度、二值化及中值滤波去除噪声等预处理[20]。图 2显示的是基于微根管技术观测的返青期S2处理小麦根系在土壤中10 cm的原始图像(a))、灰度图(b))、二值化图(c))及去噪声后的图像(d))。在根系图像处理中,图像拼接是将一组具有相互间重叠部分的图像序列进行空间匹配、对准、重采样合成后形成一幅包含各图像序列信息的新图像的技术,是根系图像处理质量的关键。本研究进行根系图像拼接主要包括以下步骤:1)图像预处理:对图像进行插值缩放,以消除图像上的弧面误差,其中弧面误差计算为:单个平面像素对应的弧面像素大小=arcsin(单个CCD像素大小÷镜头至微根管外壁半径)×π×镜头到微根管外壁半径÷180。2)图像对齐配准:先选取两幅图像的配准控制点,然后自动校正重叠部分的几何差异,找出特征点,并按照特征点匹配法进行图像配准。3)图像融合:采用图像融合功能将配准后图像中的有用信息融合表达成一副图像。由此可以看出,图像间重叠度越高,特征点越多,拼接效果越好,但重叠度太高势必会加大数据冗余量。因此,本研究在根系图像采集过程中每隔1 cm获取18~20张图片,以使图像横向重叠和纵向重叠的重叠度分别在60%左右和15%~40%。

|
图 2 基于微根管技术观测的小麦根系原始图像(a))、灰度图(b))、二值化图(c))及去噪声后的图像(d)) Fig. 2 Original image of wheat root at the reviving stage obtained with the minirhizotron method(a))and its grayscale image(b)), binary image(c))and denoising image(d)) |
对处理好的根系图像进行识别并分层计算小麦根长及根长密度。为更好地描述根系生长状况以及与土钻法获得的数据进行比较,在利用微根管技术获得根系参数时,常将面积单位转换成体积单位[24]。根系长度的计算公式为:
| $ {L_2} = \left( {M \times S} \right)/\left( {N \times W} \right) $ | (2) |
式中,L2为基于微根管法计算的根系长度,cm;M为根系所占像素数;S为单个像素所占面积,cm2;N为根系平均直径所占像素数;W为单个像素宽度,cm。其中,本实验根系图像中单个像素大小3.36 μm×3.36 μm。
根长密度的计算公式[25]为:
| $ {\rho _{\rm{L}}} = {L_2}/\left( {A \times {\rm{DOF}}} \right) $ | (3) |
式中,A为微根管观察的面积,cm2;DOF(Depth of field)为微根管至周围土壤的距离,cm。其中,DOF一般取值为0.2~0.3 cm[24],本研究实际计算时取值为0.25 cm。
2 结果 2.1 不同时期小麦根系图像的直观比较图 3为S5处理的12 cm深度土层某断面的四个生长期小麦根系监测图像。通过对比可以发现,随着小麦的生长,根系数量持续增加,形态也有所变化。分蘖期和返青期,小麦根系呈透明色,根毛较多(图 3a)、图 3b)),说明根系生长旺盛,活力较强;从返青期至孕穗期,有些根系颜色开始变暗,活力减弱(图 3c)),但新根系均有不同程度的增加(图 3d))。由此可见,基于微根管技术可直观反映小麦根系的生长发育过程。
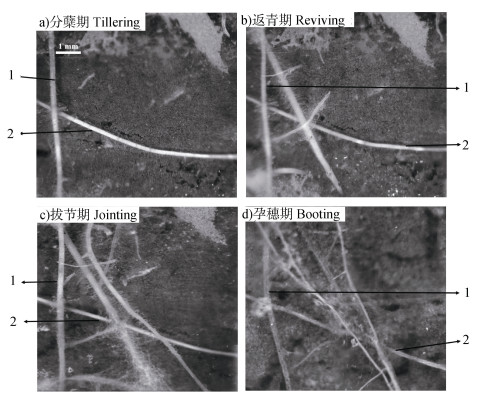
|
注:图中1、2分别表示两条参考根系。 Note: The digit 1 and 2 in the figure represents two reference roots respectively. 图 3 基于微根管技术观测的同一位置不同生长期的小麦根系图像 Fig. 3 Wheat roots in soils observed with the minirhizotron at the same site relative to stage |
对基于微根管法和土钻法获得的小麦根长密度进行对比分析(图 4)。由于小麦生长早期深部土层尚无根系分布,因此数据处理时忽略了根系参数为零的数据,最终用于对比分析的样本数为98个。从图 4中可以看出,基于两种方法获得的根长密度值均匀分布在1︰1线两侧,相关系数r为0.91,呈极显著正相关关系。按小麦生长时期分别进行对比分析发现,两种方法结果之间均呈极显著正相关关系,相关系数分别为0.87、0.88、0.93和0.94(图 5)。结果表明,在不同生长期,微根管法均可获得很好的监测结果,且在拔节期和孕穗期监测效果最好。因此,微根管法能够应用于小麦根系生长发育状况的长期定点监测。

|
注:图中实线为回归线,虚线为1︰1线。下同。 Note: The black solid and dashed lines represent regression line and 1︰1 line, respectively. The same below. 图 4 基于微根管法获得的小麦根长密度与土钻法所得结果的比较 Fig. 4 Comparison of root length density obtained by the minirhizotron technique with that by the soil drilling method |
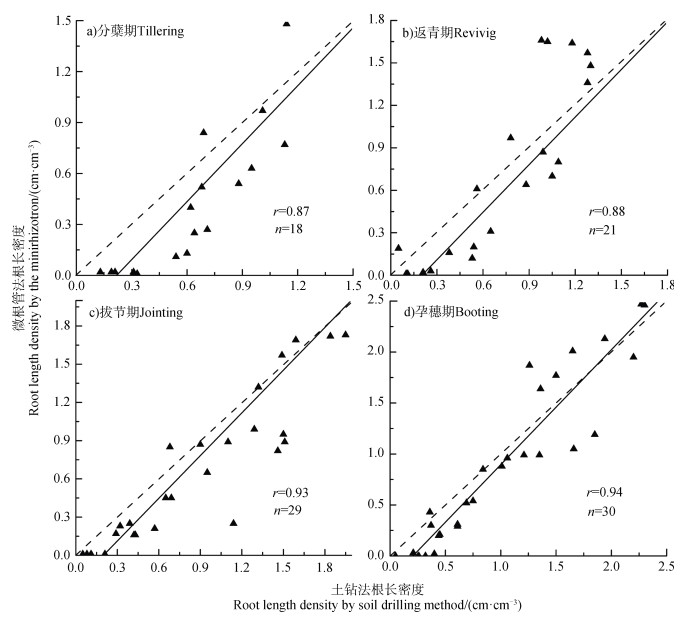
|
图 5 不同生长期基于微根管法和土钻法所获得的小麦根长密度比较 Fig. 5 Comparison of the root length density obtained by the minirhizotron technique and that by the soil drilling method relative to wheat growth stage |
本研究基于微根管法分别获取了不同生长期小麦根长密度在0~10、10~20、20~30、30~40、40~50 cm土层中的分布状况(图 6)。由图 6可见,所有处理下的小麦根长密度均在0~10 cm土层最大,且随着土层深度的加深而递减;同时,随着小麦的生长,小麦根系深度逐渐向下推移。以CK为例,在分蘖期,小麦根系生长深度可达30 cm土层,而至小麦孕穗期,根系生长深度最大,可达50 cm土层。其他处理均有类似规律,这与前人结果[20]一致。
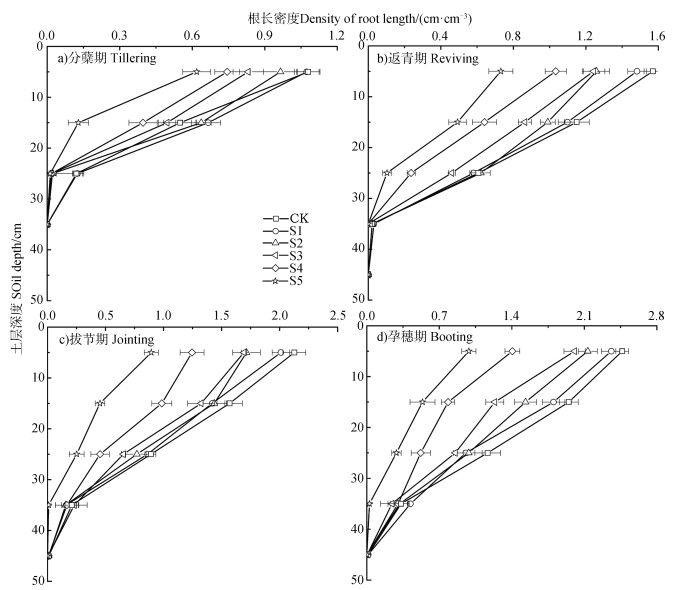
|
注:图中CK、S1、S2、S3、S4、S5的土壤含盐量分别为0.61、1.61、2.61、3.61、4.61和5.61 g·kg–1。下同。 Note: The soil salt content in treatment CK, S1, S2, S3, S4 and S5 was set as 0.61, 1.61, 2.61, 3.61, 4.61 and 5.61 g·kg–1 respectively. The same below. 图 6 不同生长期基于微根管法获得的根长密度在土壤中的分布 Fig. 6 Distribution of root length density in the soil relative to wheat growth stage obtained by the minirhizotron technique |
由6种土壤盐分处理下的根长密度分布图可知(图 6),由于受到土壤盐胁迫的影响,小麦根长密度分布基本上随土壤含盐量的增加而减小。在0~10 cm土层,S5的根长密度最小,在分蘖期、返青期、拔节期和孕穗期分别为0.62、0.64、0.89和0.99 cm·cm–3,明显低于CK的小麦根长密度。此外,在同一生长期,不同盐分处理下小麦根系生长深度不同。在返青期,S3、S4和S5的小麦根系深度达到30 cm,而其他盐处理的根系深度达到40 cm(图 6b)),S5的小麦根深直至孕穗期才达到40 cm(图 6d))。
为进一步比较不同盐分处理下小麦根系长度,将小麦根系长度单位转换成地表单位面积内的根系长度(km·m–2)。由图 7可以看出,非盐渍化土壤下(CK)生长的小麦根系长度最大。在分蘖期,CK、S1和S2的小麦根长差异不明显,但随着小麦的生长,不同土壤盐分处理下的小麦根系长度差异越来越明显:在分蘖期,盐土环境下(土壤含盐量6.61 g·kg–1)的小麦根系长度(0.72 km·m–2)不足非盐渍化土壤小麦根系长度(1.75 km·m–2)的1/2;至孕穗期差异最大,此时S5的根长达到最大(1.76 km·m–2),但也仅为CK根长(5.83 km·m–2)的1/3。

|
图 7 不同时期的小麦根系长度 Fig. 7 Length of wheat root relative to wheat growth stage |
此外,不同盐分处理下,从分蘖期至孕穗期根系增量差异较大,并随着土壤盐含量的增加,根系长度增量减少。且当土壤含盐量超过3 g·kg–1时(S3、S4和S5),小麦根系增量明显减少。其中,S5的根长增加最少,从分蘖期至孕穗期仅增加了1.03 km·m–2,而CK的根系长度增加最多,增量为4.08 km·m–2。
3 讨论植物根系的生长发育是一个动态的过程。根长密度作为研究根系的一个基本参数,不仅反映了作物根系生长发育状况,还反映了作物对土壤中水分和养分吸收利用情况,同时也是众多根系吸收模型中的必要参数[26]。盐胁迫下,小麦根系细胞质膜将最先受到伤害,导致细胞质膜选择透性被破坏,细胞代谢失调,致使小麦正常的生长发育受到影响[27-28]。已有研究表明,土壤盐分显著抑制作物组织器官的生长、分化,加速其衰老,且其影响程度随生长时期的不同而不同[29]。由不同生长时期的小麦根长密度分布(图 6)和根系长度变化(图 7)也可看出,S3、S4和S5的小麦根长密度和根系长度增长速度较慢,且从拔节期至孕穗期小麦根系长度增加较少,这与Rose等[19]的研究结果一致。此外,根据微根管法获得的根系图像发现,在小麦孕穗期,当土壤含盐量超过3 g·kg–1时,小麦根系中锈根、死根增多(图 2d)和图 8),且土壤含盐量越高,这种现象越明显;同时,在这一生育期不同盐分处理下的根系长度差异也最大(图 7)。苗果园等[30]研究发现,在拔节期至孕穗期间,为冬小麦主根深扎的第二个盛期,同时伴随侧根的大量发生,可见在孕穗期,小麦根系生长受盐分胁迫的累积影响最为严重。

|
注:垂直土壤深度10 cm。 Note: The soil depth is 10 cm. 图 8 在小麦拔节期和孕穗期基于微根管技术观测的S4处理小麦根系图像 Fig. 8 Images of wheat roots in treatment S4 obtained by the minirhizotron technique at the jointing and booting growth stages |
本研究对比分析了不同生长期基于微根管法和土钻法所获得的小麦根长密度,两种方法结果之间均呈极显著正相关关系(图 4)。但是,当小麦根长密度较小时(接近0 cm·cm–3),基于两种方法获得的结果偏差相对较大,不能均匀分布在1︰1线两侧,且基于微根管法得到的根长密度基本均小于土钻法得到的结果。这主要是由于当小麦根量较少时,在微根管壁上可能无或较少生长根系[24],直接造成所获得的根系图像中根系信息较少,致使得到的根长密度一般会小于土钻法获得的结果。因此,利用微根管技术进行研究时,在保证微根管正确安装的同时,可根据观测时期、观测深度来选择合适的安装角度和微根管数量,以提高其监测精度。
目前,中国有约占可耕地面积20%的盐碱地和盐渍化土壤,盐渍土分布广、类型多,已成为影响中国农作物高产和增加经济效益不可避免的困扰因素。小麦作为我国主要的粮食作物,是盐渍化土壤区重要的栽培作物。因此,本研究利用微根管技术的原位、重复、无损、可视化观测的特点,获取盐胁迫下小麦根系图像,并进行盐胁迫下不同生育期的小麦根系生长的直观分析及其根系参数的估算,明确了盐胁迫下小麦根长密度随土壤深度的增加而递减,随土壤盐含量的增加而减小的生长分布规律。研究结果与土钻法所得结果一致,且两种方法所得的根长密度具有显著正相关关系,相关系数达到0.91(图 4),表明利用微根管技术可进行小麦根系生长发育的可视化动态监测,且方便可行,为土壤盐渍化区域进行小麦根系的研究奠定了一定基础。尽管与其他方法相比,微根管方法节省了大量人力物力,但大量根系图片的后期分析方法仍有进一步改善的空间,尤其是盐胁迫下小麦根系形态、根毛信息的提取[31-33]。因此,及时利用新技术、新方法对现有技术进行升级改造,提高数据分析效率和精度,推进微根管技术在区域尺度研究的应用,是今后微根管技术发展的主要目标。
4 结论基于微根管技术获取小麦四个生育期的根系图像,分析并研究了土壤盐胁迫下根系生长及其分布状况。结果表明:1)微根管法能够准确地实现对盐胁迫下小麦根系生长无损动态监测,并可获取直观可视的根系图像和准确的数据信息,且在小麦拔节期和孕穗期效果较好。2)土壤盐胁迫对小麦根系生长具有明显的抑制作用,随着土壤盐含量的增加,小麦根系减少,根深变浅,且至孕穗期盐胁迫程度最严重。当土壤中盐含量超过3 g·kg–1时(S3、S4和S5),小麦根系生长速率明显降低,至孕穗期,盐土(S5)环境下的小麦根系长度(1.76 km·m–2)达到最大,但也仅为非盐渍化土壤(CK)下(5.83 km·m–2)的1/3。此外,通过根系图像中根的颜色变化、根毛增减程度等信息,可直观地判断出根系活力及其功能状况。将微根管技术应用于作物根系生长监测中,可充分发挥该技术原位、可重复、无干扰、可视化的优势。本研究利用微根管技术有效解决了盐胁迫下小麦根系生长监测困难的问题,为盐渍化区域精准农业发展提供理论依据和技术支持。
致谢 感谢中国土壤数据库提供的数据支持。
| [1] |
Parida A K, Das A B. Salt tolerance and salinity effects on plants: A review[J]. Ecotoxicology and Environmental Safety, 2005, 60(3): 324-349. DOI:10.1016/j.ecoenv.2004.06.010
(  0) 0) |
| [2] |
Xie W J, Zhang Y P, Zhang M, et al. Relationships between soil physicochemical properties and wheat production in coastal saline soil (In Chinese)[J]. Acta Pedologica Sinica, 2015, 52(2): 461-466. [谢文军, 张衍鹏, 张淼, 等. 滨海盐渍化土壤理化性质与小麦生产间的关系[J]. 土壤学报, 2015, 52(2): 461-466.]
(  0) 0) |
| [3] |
Smith T E, Grattan S R, Grieve C M, et al. pH dependent salinity-boron interactions impact yield, biomass, evapotranspiration and boron uptake in broccoli(Brassica oleracea L.)[J]. Plant and Soil, 2013, 370(1/2): 541-554.
(  0) 0) |
| [4] |
Yao R J, Yang J S, Wu D H, et al. Evaluation of pedotransfer functions for estimating saturated hydraulic conductivity in coastal salt-affected mud farmland[J]. Journal of Soils and Sediments, 2015, 15(4): 902-916. DOI:10.1007/s11368-014-1055-5
(  0) 0) |
| [5] |
Thorup-Kristensen K, Dresbøll D B, Kristensen H L. Crop yield, root growth, and nutrient dynamics in a conventional and three organic cropping systems with different levels of external inputs and N re-cycling through fertility building crops[J]. European Journal of Agronomy, 2012, 37(1): 66-82. DOI:10.1016/j.eja.2011.11.004
(  0) 0) |
| [6] |
Palta J A, Yang J C. Crop root system behaviour and yield[J]. Field Crops Research, 2014, 165: 1-4. DOI:10.1016/j.fcr.2014.06.024
(  0) 0) |
| [7] |
Maeght J L, Rewald B, Pierret A. How to study deep roots-and why it matters[J]. Frontiers in Plant Science, 2013, 4: 299.
(  0) 0) |
| [8] |
Amato M, Lupo F, Bitella G, et al. A high quality low-cost digital microscope minirhizotron system[J]. Computers and Electronics in Agriculture, 2012, 80: 50-53. DOI:10.1016/j.compag.2011.10.014
(  0) 0) |
| [9] |
Box J E, Ramsuer E L. Minirhizotron wheat root data: Comparisons to soil core root data[J]. Agronomy Journal, 1993, 85(5): 1058-1060. DOI:10.2134/agronj1993.00021962008500050019x
(  0) 0) |
| [10] |
Gray S B, Strellner R S, Puthuval K K, et al. Minirhizotron imaging reveals that nodulation of field-grown soybean is enhanced by free-air CO2 enrichment only when combined with drought stress[J]. Functional Plant Biology, 2013, 40(2): 13-147.
(  0) 0) |
| [11] |
Taylor B N, Beidler K V, Strand A E, et al. Improved scaling of minirhizotron data using an empirically-derived depth of field and correcting for the underestimation of root diameters[J]. Plant and Soil, 2014, 374(1/2): 941-948. DOI:10.1007/s11104-013-1930-7
(  0) 0) |
| [12] |
Rowland D L, Smith C, Cook A M, et al. Visualization of peanut nodules and seasonal nodulation pattern in different tillage systems using a minirhizotron system[J]. Peanut Science, 2015, 42(1): 1-10. DOI:10.3146/0095-3679-42.1.1
(  0) 0) |
| [13] |
Balogianni V G, Wilson S D, Farrell R E, et al. Rapid root decomposition decouples root length from increased soil C following grassland invasion[J]. Ecosystems, 2015, 18(8): 1307-1318. DOI:10.1007/s10021-015-9900-y
(  0) 0) |
| [14] |
Bonin C L, Flores J P C, Lal R, et al. Root characteristics of perennial warm-season grasslands managed for grazing and biomass production[J]. Agronomy, 2013, 3(3): 508-523. DOI:10.3390/agronomy3030508
(  0) 0) |
| [15] |
Arnone J A, Zaller J G. Earthworm effects on native grassland root system dynamics under natural and increased rainfall[J]. Frontiers in Plant Science, 2014, 5: 152.
(  0) 0) |
| [16] |
Tierney G L, Fahey T J. Fine root turnover in a northern hardwood forest: A direct comparison of the radiocarbon and minirhizotron methods[J]. Canadian Journal of Forest Research, 2002, 32(9): 1692-1697. DOI:10.1139/x02-123
(  0) 0) |
| [17] |
Tierney G L, Fahey T J. Evaluating minirhizotron estimates of fine root longevity and production in the forest floor of a temperate broadleaf forest[J]. Plant and Soil, 2001, 229(2): 167-176. DOI:10.1023/A:1004829423160
(  0) 0) |
| [18] |
Herrera J M, Noulas C, Feil B, et al. Nitrogen and genotype effects on root growth and root survivorship of spring wheat[J]. Journal of Plant Nutrition and Soil Science, 2013, 176(4): 561-571. DOI:10.1002/jpln.201100334
(  0) 0) |
| [19] |
Rose D, Ghamarnia H M, Gowing J W. Development and performance of wheat roots above shallow saline groundwater[J]. Soil Research, 2010, 48(8): 659-667. DOI:10.1071/SR09163
(  0) 0) |
| [20] |
Liao R W, Liu J M, An S Q, et al. Monitor of corn root growth in soil based on minirhizotron technique (In Chinese)[J]. Transactions of the Chinese Society of Agricultural Engineering, 2010, 26(10): 156-161. DOI:10.3969/j.issn.1002-6819.2010.10.026 [廖荣伟, 刘晶淼, 安顺清, 等. 基于微根管技术的玉米根系生长监测[J]. 农业工程学报, 2010, 26(10): 156-161.]
(  0) 0) |
| [21] |
Yang J S. Development and prospect of the research on salt-affected soils in China (In Chinese)[J]. Acta Pedologica Sinica, 2008, 45(5): 837-845. DOI:10.3321/j.issn:0564-3929.2008.05.010 [杨劲松. 中国盐渍土研究的发展历程与展望[J]. 土壤学报, 2008, 45(5): 837-845.]
(  0) 0) |
| [22] |
Wang Z Q, Zhu S Q, Yu R P. Salt-affected soil of China (In Chinese). Beijing: Science Press, 1993. [王遵亲, 祝寿泉, 俞仁培. 中国盐渍土[M]. 北京: 科学出版社, 1993.]
(  0) 0) |
| [23] |
潘贤章, 李燕丽. 双筒式植物根系原位观测系统装置: CN 205679254 U[P]. 2016-11-09. Pan X Z, Li Y L. A double tube observation system for plant root in situ: CN 205679254 U[P]. 2016-11-09. (  0) 0) |
| [24] |
Bai W M, Cheng W X, Li L H. Applications of minirhizotron techniques to root ecology research (In Chinese)[J]. Acta Ecologica Sinica, 2005, 25(11): 3076-3081. DOI:10.3321/j.issn:1000-0933.2005.11.039 [白文明, 程维信, 李凌浩. 微根窗技术及其在植物根系研究中的应用[J]. 生态学报, 2005, 25(11): 3076-3081.]
(  0) 0) |
| [25] |
Merrill S D, Upchurch D R. Converting root numbers observed at minirhizotrons to equivalent root length density[J]. Soil Science Society of America Journal, 1994, 58(4): 1061-1067. DOI:10.2136/sssaj1994.03615995005800040009x
(  0) 0) |
| [26] |
Huang T X, Wang X G, Wu H, et al. Effects of drought and waterlogging stress on root growth of cotton (In Chinese)[J]. Chinese Journal of Ecology, 2018, 37(7): 2020-2029. [黄韬幸, 王修贵, 吴灏, 等. 旱涝胁迫对棉花根系生长的影响[J]. 生态学杂志, 2018, 37(7): 2020-2029.]
(  0) 0) |
| [27] |
Wen P, Chen X B, Zhang L L, et al. Effects of salt and drought on winter wheat in seedling stage under different nitrogen rates (In Chinese)[J]. Soils, 2019, 51(2): 324-329. [文佩, 陈小兵, 张乐乐, 等. 盐旱交叉胁迫对各施氮水平下小麦苗期的影响[J]. 土壤, 2019, 51(2): 324-329.]
(  0) 0) |
| [28] |
Zhang Q, He M R, Chen W F, et al. Effects of extraneous nitric oxide and salicylic acid on physiological properties of wheat seedlings under salt stress (In Chinese)[J]. Acta Pedologica Sinica, 2018, 55(5): 1254-1263. [张倩, 贺明荣, 陈为峰, 等. 外源-氧化氮与水杨酸对盐胁迫下小麦幼苗生理特性的影响[J]. 土壤学报, 2018, 55(5): 1254-1263.]
(  0) 0) |
| [29] |
Wang S F, Hu Y X, Sun H J, et al. Effects of salt stress on growth and root development of two oak seedlings (In Chinese)[J]. Acta Ecologica Sinica, 2014, 34(4): 1021-1029. [王树凤, 胡韵雪, 孙海菁, 等. 盐胁迫对2种栎树苗期生长和根系生长发育的影响[J]. 生态学报, 2014, 34(4): 1021-1029.]
(  0) 0) |
| [30] |
Miao G Y, Zhang Y T, Yin J, et al. A study on the development of root system in winter wheat under unirrigated conditions in semi-arid loess plateau (In Chinese)[J]. Acta Agronomica Sinica, 1989, 15(2): 104-115. DOI:10.3321/j.issn:0496-3490.1989.02.002 [苗果园, 张云亭, 尹钧, 等. 黄土高原旱地冬小麦根系生长规律的研究[J]. 作物学报, 1989, 15(2): 104-115.]
(  0) 0) |
| [31] |
Wang T, Rostamza M, Song Z H, et al. SegRoot: A high throughput segmentation method for root image analysis[J]. Computers and Electronics in Agriculture, 2019, 162: 845-854. DOI:10.1016/j.compag.2019.05.017
(  0) 0) |
| [32] |
Shi J W, Yu S Q, Yu L Z, et al. Application of minirhizotron in fine root studies (In Chinese)[J]. Chinese Journal of Applied Ecology, 2006, 17(4): 715-719. DOI:10.3321/j.issn:1001-9332.2006.04.031 [史建伟, 于水强, 于立忠, 等. 微根管在细根研究中的应用[J]. 应用生态学报, 2006, 17(4): 715-719.]
(  0) 0) |
| [33] |
Niu X L, Nan Z B. Review of minirhizotron applications for study of fine roots in grassland (In Chinese)[J]. Acta Prataculturae Sinica, 2017, 26(11): 205-215. DOI:10.11686/cyxb2017041 [牛学礼, 南志标. 运用微根管技术研究草地植物细根的进展[J]. 草业学报, 2017, 26(11): 205-215.]
(  0) 0) |
 2021, Vol. 58
2021, Vol. 58


