2. 中国农业科学院农业环境与可持续发展研究所, 北京 100081
2. Institute of Environment and Sustainable Development in Agriculture, Chinese Academy of Agricultural Science, Beijing 100081, China
磷是作物生长、发育不可缺少的大量营养元素。长期以来,农业生产的快速发展依赖磷肥的大量施用,由于磷素的土壤固定性强,磷肥的当季利用率仅10%~30%。为保障粮食安全,多年持续过量施肥导致土壤磷素累积,这部分累积的磷称为土壤遗留磷(Legacy phosphorus)[1]。土壤遗留磷不仅造成资源浪费,在磷资源危机的大背景下威胁粮食生产安全,还会通过径流、淋溶等途径流失进入周围水体,引发水体富营养化。为实现农业绿色发展和资源永续利用,农业农村部出台《到2020年化肥使用量零增长行动方案》,2020年中央一号文件再次指出要持续推进化肥减量增效。探求农学利用率高、环境风险低的农田磷肥管理措施是推进我国化肥减量、增效,实现农业高质、高效、绿色可持续发展的关键。
1 农田土壤磷形态研究:从分级组分到分子形态受成土母质、风化程度及施肥管理等因素影响,土壤全磷含量一般100~3 000 mg·kg–1,磷的赋存形态多样,且各形态之间通过物理、化学、生物作用相互转化,始终处于动态平衡中(图 1)[2]。大多数无机磷以吸附或沉淀作用被铁、铝、钙等土壤矿物固定,矿物吸附态磷解吸或含磷矿物溶解转化为土壤溶液中的正磷酸盐才可被作物直接吸收或被微生物固持;正磷酸盐经过一系列生物化学过程与有机碳基团结合形成有机磷,可通过作物、微生物残体形式再次进入土壤;被微生物固持的磷可通过矿化作用再次释放成为作物有效磷。土壤矿物的吸附、沉淀作用同样控制着土壤有机磷的化学反应,例如,植酸的矿物结合能力较强,故而在土壤中普遍累积,通常是土壤有机磷的重要赋存形态。但大多数有机磷与土壤固相的亲和力较无机磷更低[3],各种有机磷在相应磷酸酶的水解作用下转化为正磷酸盐可补给作物有效磷。相比于目前研究较多的无机磷,土壤有机磷形态更为复杂,尤其一些高分子有机磷的结构尚不清楚。可见,磷的赋存形态决定其在土壤系统中的转化、迁移和归趋过程,进而影响其供给能力及环境风险[3-4]。仅通过全磷或有效磷含量并不能全面、准确、长效地评估土壤磷的养分供应能力和生态环境风险,探索可持续的农田磷素管理措施迫切需要能够准确认识、科学表征土壤磷形态的技术方法。
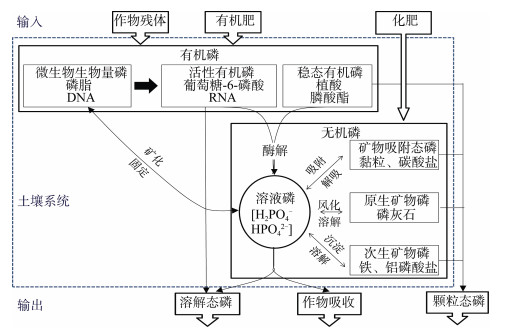
|
图 1 土壤磷形态及转化示意图(根据文献[2]修改所得) Fig. 1 Soil phosphorus species and its transformation(Revised according to Reference [2]) |
一直以来,土壤组分结构的复杂性和空间异质性限制了土壤磷形态的直接、准确表征。近年来,先进技术的发展使得农田土壤磷形态研究从基于传统连续提取法的组分分级向基于先进光谱技术的分子形态表征迈进(图 2)。关于土壤磷化学形态的简单认识始于有机磷、无机磷的划分,多年来人们习惯采用钼蓝比色法测定无机磷,但实际上,所得结果严格意义上应称为钼酸盐反应磷(Molybdate reactive P),这种方法得到的仅是正磷酸盐,并不包括无机的焦磷酸盐、多聚磷酸盐。所以,通常造成无机磷的低估,由此基于差减法得到的有机磷也常被高估[5]。在过去的几十年里,被广泛应用的连续提取法根据磷与不同土壤组分的化学结合能力将土壤磷分成多种组分(Fraction或者Pool),该方法自Chang和Jackson[6]提出之后也出现了多种改进的提取方法[7-8],迄今沿用较多的Hedley法将土壤磷分组为活性磷、中等活性磷及非活性磷等[9]。但这些方法得到的结果仅具有操作意义,并非真实的化学形态(Speciation)[10-11]。近来,随着分子土壤科学的发展及前沿光谱技术的突破,从分子水平上认识土壤磷的形态转化与周转机制成为新兴热点,液相磷-31核磁共振(P-NMR)技术及基于同步辐射的X射线吸收近边结构谱(P-XANES)技术成为当前主流的两大土壤磷分子形态表征技术[12-13]。前者兴起于20世纪80年代,特别擅长土壤正磷酸盐、多聚磷酸盐等无机磷及膦酸酯、正磷酸单酯、正磷酸二酯等有机磷形态分析[3,14],而后者兴起于20世纪90年代末21世纪初,尤其擅长对土壤铁、铝、钙等结合的无机磷形态进行定性和定量分析[15-16]。而上述两种方法也有各自的局限性,其中P-XANES技术依托于大科学装置,机时少并且难以获取,同时测试过程可能受到大科学装置稳定性的影响,而P-NMR测试则较容易获取机时,但需要前提取过程,同时仅能得到样品的平均形态信息。
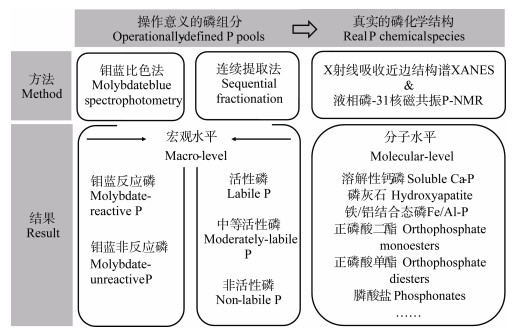
|
图 2 土壤磷形态表征发展示意图 Fig. 2 Sketch of the development of soil phosphorus characterization |
本研究以“soil phosphorus”为标题,以“speciation or XANES or NMR”为主题,在Web of Science核心合集数据库检索1990—2020年间的发表文献,并排除湿地、湖泊、海洋等非农田土壤研究,收集到相关文献235篇。以此为文献集合,利用Histcite引文网络分析工具理清该领域的发展脉络。相比于总引用频次(Global citation score,GCS),在相关文献集合内部本地被引次数(Local citation score,LCS)较高的文献被认为是经过小同行专家评议的关键文献,因此选取LCS排名前25篇文献(约分析文献的前10%)进行可视化,得到图 3。图中每个圆圈代表一篇文献,圆圈越大,代表LCS越高,是该领域的重要文献。圆圈内文献编号对应表 1中的序号,连线代表文献之间的引用关系,箭头指向被引文献。总体而言,农田土壤磷分子形态研究最初主要借助核磁共振技术,侧重有机磷分子形态表征,而后过渡至与同步辐射技术相结合,实现了土壤磷分子形态的全面认识(图 3)。
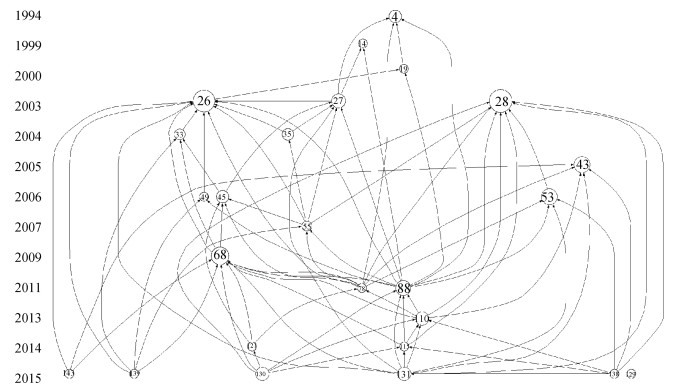
|
注:图片左侧数据代表文献发表年,图中圆圈内数字对应表 1中的文献编号。 Note: The digits on the left side of the figure represent publication years of the papers, and numbers in the circles correspond to the Reference No. in Table 1. 图 3 农田土壤磷分子形态研究领域本地被引次数前25篇文献的引文编年图 Fig. 3 Historigram of the top 25 papers in local citation scores in the field of molecular speciation of phosphorus in agricultural soils |
2.1 P-NMR在土壤磷形态中的初始应用
核磁共振,尤其具有高分辨率的液相P-NMR技术,是迄今甄别土壤磷形态研究中应用最为广泛的谱学技术。例如,在表 1中所列LCS前25篇文献中多达20篇是P-NMR的相关研究。1980年,Newman和Tate[17]首次以0.5 mol·L–1 NaOH提取新西兰草地土壤,通过提取物的加标实验检测出正磷酸盐、焦磷酸盐和多聚磷酸盐,此外,在1 mol·L–1 NaOH及D2O溶液中加标识别出植酸磷、磷酸胆碱和2-氨基乙基膦酸酯,同时基于文献报道鉴别出烃基膦酸酯[18]、磷脂[19]及脱氧核糖核酸[20],自此掀开了P-NMR技术应用于土壤磷形态研究的序幕。1994年,Bedrock等[21]针对不同农艺措施下泥炭土与农田矿质土壤及腐殖酸中磷形态进行了对比研究,该研究是P-NMR技术在农田土壤上的早期典型应用,其图谱解析主要参考磷化合物在0.5 mol·L–1 NaOH的加标实验结果以及文献报道[22]。1999年,Zhang等[23]针对长期定位施肥试验样点采用NaHCO3、NaOH连续浸提,探讨了两种前提取组分中磷的分子形态受长期施肥管理的影响,而该研究仅对正磷酸单酯、正磷酸二酯、焦磷酸盐、多聚磷酸盐等磷形态进行了大致归类,并未解析正磷酸单酯和正磷酸二酯中的具体形态。此外,P-NMR也应用于土壤腐殖酸的磷形态分析,其中以Mahieu等[24]的报道较为典型,是早期较有影响力的代表性研究;该研究基于不同施肥处理的稻田长期定位试验,比较了游离腐殖酸和钙结合腐殖酸中正磷酸单酯、正磷酸二酯等的赋存形态。综上,P-NMR在土壤磷形态中的初始应用拉开了土壤磷分子形态研究的序幕,实现了对土壤有机磷中正磷酸单酯、正磷酸二酯以及无机多聚磷酸盐、焦磷酸盐的有效表征。
2.2 前提取方法的优化完善了P-NMR的应用由于P-NMR在测试前需对供试土壤磷进行前提取,为更大程度地提取可供NMR分析的磷且尽量降低提取过程中的样品形态变化,早期的相关研究中出现了多种不同的前提取方法。1996年,Cade-Menun和Preston[25]研究发现,相比其他四种提取剂,0.25 mol·L–1 NaOH + 0.05 mol·L–1 Na2EDTA对土壤全磷有最大提取率(71%~90%),且可获得更多种类的磷形态,由于提取剂影响NMR后续的磷形态分析,采用统一的提取方法对提高不同研究组结果之间的可比性至关重要,自此以后的研究大多沿用NaOH-EDTA作为P-NMR的前提取剂,而由于该研究供试土壤为森林土壤,故未出现在图 3中。在前提取方法得以完善和标准化之后,多数研究在磷形态的识别上仍然基于早期文献报道[17]或直接按几个大类形态分组[23]。例如,2003年,Turner等[5]以P-NMR分析了18种钙质农田土壤有机磷形态组成及其与气候、土壤性质的关系,在土壤有机磷的分析方法上,通过对比分析实证了灼烧法、比色法可导致土壤有机磷含量被高估,而NaOH-EDTA前提取结合P-NMR得到的土壤有机磷含量更为可靠;此外结合酶水解法发现NaHCO3组分中有机磷含量虽不高,但水解性较强,生物有效性不可忽视。然而,磷化合物的化学位移受磷原子核周围的分子环境影响,随样品离子强度、pH、温度、顺磁离子等化学环境的改变而改变,为此,Turner等[26]基于标准化的NaOH-EDTA土壤浸提方法开展了正磷酸单酯、正磷酸二酯、膦酸酯等34种磷标准样品的化学位移分析,相比之前基于1 mol·L–1 NaOH等化学溶液开展的加标研究[17],该结果更接近实际土壤样品化学环境,为后续土壤P-NMR的形态识别提供了更为科学的重要参考。可见,前提取方法的标准化显著提升了P-NMR技术表征土壤有机磷的准确性,推动了其在土壤磷微观分子结构表征中的应用,自此,NaOH-EDTA前提取结合P-NMR在土壤有机磷形态解析中的主流地位愈加凸显。
2.3 P-NMR技术的进一步发展与应用在前提取方法得以完善的基础上,解谱技术及测试条件进一步发展。2004年,Turner和Richardson[27]识别了土壤提取剂中scyllo-肌醇磷酸盐的化学位移,并通过次溴酸钠氧化法去除样品中除肌醇磷酸盐以外的有机质,再进行P-NMR分析加以验证,而在此之前,该特征峰一直被误认为是磷酸胆碱[26],从而对这两种有机磷形态NMR特征图谱的认识得以修正。2005年,Turner等[28]针对土壤有机磷提取方法,从定量分析、形态解析及生物有效性评价方法等方面进行了全面综述。次年,在测试条件方面,McDowell等[29]分析了八种土壤、三种粪肥和一种附生苔藓中磷形态的自旋晶格弛豫时间,发现通过NaOH-EDTA提取液中磷、铁、锰含量估算弛豫时间的方法,并提出在采集P-NMR图谱时要特别注意设置合适的弛豫时间才能有效地对磷形态进行定量分析。之后,解谱技术上又有一些探索和推进[30-31],例如,2009年,Doolette等[32]向八种土壤NaOH-EDTA提取液中加入六种磷标准物质,分析发现α、β-甘油磷酸盐的化学位移与之前Turner等[26]所报道的植酸磷的两个峰位置极其相似,由于P-NMR图谱中化学位移对样品化学环境非常敏感,早期研究可能因为加标量太大改变样品本身pH、离子浓度,进而改变磷形态的化学位移,这种情况下借助加标图谱来识别样品磷形态时就可能带来偏差,尤其对于峰型复杂重叠的正磷酸单酯类形态;由此提出单纯借助文献报道进行图谱解析很有可能并不科学,而应借助合理的加标实验帮助图谱解析。
随着测试分析技术完善,分析精度和准确度显著提高,应用研究也有进一步拓展:例如,借助早期磷标准样品的化学位移[26-27],Hansen等[33]结合连续提取及P-NMR研究了分别经堆储及厌氧氧化塘处理的粪肥中磷的赋存形态,以及长期施用粪肥土壤的磷形态转化,为粪便处理方式的优化提供理论指导。Leytem等[34]研究了粪肥中植酸磷对钙质土壤磷形态及化学活性的影响。Koopmans等[35]研究了长期施用粪肥的非钙质砂土不同深度剖面中磷的赋存形态,由此预测不同磷形态的下渗风险。Abdi等[36]利用P-NMR研究了耕作措施及施磷量对土壤磷形态及剖面分布的影响,解析出的磷形态种类更加多样。McLaren等[37]首次将土壤NaOH-EDTA浸提液进行分级,利用P-NMR分析发现粒径大于10 kDa的组分主要由大分子量的正磷酸单酯组成,而正磷酸盐和肌醇六磷酸盐通常存在于小于10 kDa的组分中。经过上述技术发展,P-NMR技术进一步增进了对土壤有机磷各类赋存形态(如植酸磷异构体)在不同环境条件影响下转化、周转及归趋机制的认识。
2.4 XANES技术在土壤磷形态中的应用1999年,Hesterberg等[38]首次将P-XANES技术引入土壤研究,率先在分子水平上实现了土壤典型无机磷库(铁磷、铝磷和钙磷)形态表征,二十余年来该技术逐渐成为土壤磷形态研究领域的热点。例如,2003年,Beauchemin等[39]联合传统的化学连续提取法及P-XANES对理化性质不同的五种长期施肥的富磷土壤中磷形态进行研究,并借助线性拟合(LCF)对土壤磷形态组成进行定量,发现该技术可直接识别供试土壤中钙结合态磷,而对铁氧化物吸附态磷与铝氧化物吸附态磷,因难以有效区分而统一归为铁/铝氧化物吸附态磷;鉴于XANES-LCF在定量上存在不确定性,且该技术对有机磷形态识别能力有限,由此提出通常P-XANES的结果需要结合连续提取法提供相关数据加以补充。基于P-XANES技术,土壤磷,尤其是无机磷,分子形态表征得到广泛研究,更多的进展可参考已发表的综述文章[13,15]。通过Histcite软件分析,近期P-XANES技术在土壤磷分子形态认识上的推进主要体现在XANES- X射线荧光光谱(XRF)技术联用及XANES-LCF分析流程优化方面。例如,2006年,Lombi等[40]为探究高钙质土壤中液态磷肥及颗粒磷肥的肥效机制,利用nano-XRF及nano-XANES对比分析了两种磷肥施肥点附近土壤磷的赋存形态,首次展示了具有空间分辨率的XRF及纳米探针技术在微区土壤磷形态表征中的重要应用。随着P-XANES应用愈加广泛,探讨基于XANES-LCF定量分析精准性及优化方法的研究相继出现,例如Werner和Prietzel[41]建立了XANES-LCF分析的标准流程,并以铝磷、铁磷、羟基磷灰石及植酸磷模拟的十六种三元磷形态组合加以验证,发现该流程较常规流程可降低拟合误差6%。该技术的发展显著提升了其在非均相土壤中磷形态表征的准确性,促进了农田土壤磷在分子水平上的认识,尤其是无机磷的形态转化及周转机理。
2.5 多谱学技术联合表征土壤磷形态2011年,Doolette和Smernik[42]从样品制备、技术灵敏度、分辨率及定性分析四个角度对土壤有机磷形态表征的三种谱学技术(液相P-NMR、固相P-NMR、XANES)的优缺点及适用性开展了详尽综述,为土壤磷形态研究的技术选用提供了重要参考。同年,Kizewski等[12]对P-XANES、NMR、傅里叶红外光谱、拉曼光谱四种谱学方法在土壤及其他环境介质中磷形态研究中的应用进行了综述,指出P-XANES通常仅能分辨出至多四种土壤磷形态;P-NMR虽擅长有机磷形态表征,但需特别注意前提取的选择性及提取、分析过程中可能存在的形态改变,目前仅这两种技术可用于组成复杂的土壤系统,而基质的复杂性通常降低了分析技术的分辨率,提高了分析结果的不确定性,依靠单一技术并不能全面表征土壤磷形态。在以上理论基础上,Liu等[43]最早联合P-XANES、P-NMR、连续提取三种技术[44],以不同土地利用类型的土壤比较研究了各技术在磷形态研究中的异同,发现虽然P-NMR在有机磷定量上优势突出,但其结果的准确性很大程度上受前提取过程的可靠程度影响,且需要校正有机磷可能的水解产物才能得到更可信的结果;P-XANES可在无损条件下对样品直接分析,但对有机磷的分析能力有限;连续提取虽简单易行,但结果存在较大不确定性,实例证明了多技术联用的必要性和可行性。2014年,Liu等[45]将P-NMR和P-XANES联合应用到土壤胶体细颗粒上,首次获得了土壤水分散性胶体中磷的分子形态及其与土体土壤磷分子形态的差异,丰富了对土壤细颗粒结合态磷迁移及生物有效性的认识。2015年,Liu等[46]结合以上三种技术,针对长期施肥累积的土壤遗留磷,借助长期定位试验首次在分子水平上揭示了土壤遗留磷形态长期演变特征及小麦供给机制,为节肥增效提供了前瞻性理论依据。同年,Kruse等[47]综述了形态表征等土壤磷研究方法的前沿技术,指出磷氢二维核磁共振技术可借助氢分子的结构差异进一步区分一维磷谱相互重叠的磷形态,从而提高分辨率,同时,磷的L边XANES技术可一定程度上弥补K边XANES技术在有机磷分析上的缺陷[48],但L边XANES通常需要较高的土壤磷含量,因而,目前在土壤上的应用仍以液相P-NMR和K边XANES技术为主;此外,X射线微探针技术光斑尺度可达到微米级别,甚至是50 nm的分辨率,非常适合研究关键微域土壤磷形态的转化过程,同时也可与常规XANES相结合,有助于降低LCF分析中标样选择的不确定性。例如,Rivard等[49]综合利用连续提取及K边XANES与µ-XRF/µ-XANES技术发现土壤磷主要与有机黏土矿物复合体结合,且根系对土壤磷形态无显著影响;Liu等[50-51]综合利用P-NMR、K边XANES与µ-XRF/µ-XANES技术揭示了黑土和潮土中遗留磷形态演变的分子机制,发现长期不施肥条件下,黑土中作物吸收导致羟基磷灰石结合态钙磷降低,但在潮土中羟基磷灰石结合态钙磷则无显著变化;两种土壤中正磷酸二酯在不施肥条件下均可作为活性磷源供给作物。自此,多技术联合全面表征土壤磷形态的实例研究更加丰富[52-54],尤其在针对非均相土壤样品实现了微纳米级的空间分辨,显著提升了原位表征结果的准确性,从而全面推进了在分子水平上认识土壤磷形态分布、转化、周转及归趋的机制。
此外,也不乏两种技术结合的应用研究实例,例如,Abdala等[55]以连续提取及P-XANES技术研究了高度风化土壤中磷形态对长期施用粪肥的响应,结合铁的K边扩展X射线吸收精细结构谱技术发现长期施用粪肥促进了土壤铁磷由晶型向非晶型的转化。Annaheim等[56]结合P-NMR和酶水解法分析发现,虽然牛粪、堆肥、污泥三种有机肥中有机磷形态迥异,但经过62年的长期定位施肥处理后,除污泥添加处理的土壤以外,大部分处理土壤有机磷形态基本上无明显差异。
3 农田土壤磷分子形态研究展望在农田土壤磷形态研究领域,依靠单一连续提取法的相关研究逐渐被取代,结合磷-核磁共振技术(P-NMR)、基于同步辐射的X射线吸收近边结构谱技术(P-XANES)、X-射线荧光光谱技术(XRF)等多种谱学技术在分子水平上更全面、更可靠地获取磷形态信息成为发展趋势。针对土壤无机磷形态解析,可通过采用具有空间分辨率的微探针技术,例如µ-XANES,以提高异质性土壤样品分析的灵敏度,同时为线性拟合(LCF)分析结果提供必要支撑,以提高定量准确性[12,50,57]。此外,同步辐射软X射线光谱技术的发展提供了新的分析平台,该技术可利用P的L边XANES谱解析不同有机磷的分子形态[48],虽然该技术的检测限在目前条件下尚难以满足实际土壤环境样品的分析,有待于进一步完善。基于上述技术平台,多技术联用有望突破多年来土壤磷形态解析的瓶颈,在分子水平上全面揭示土壤磷素的形态、分布、转化及归趋机制。未来土壤磷形态的表征有必要结合长期定位试验在不同时间尺度上加以探究,并考察作物生育期和产量变化特征,从而将土壤磷形态表征与其动态变化和农学效应有机结合,进而为农田土壤磷素的施肥管理及作物有效性调控提供理论依据。
| [1] |
Sharpley A, Jarvie H P, Buda A, et al. Phosphorus legacy: Overcoming the effects of past management practices to mitigate future water quality impairment[J]. Journal of Environmental Quality, 2013, 42(5): 1308-1326. DOI:10.2134/jeq2013.03.0098
(  0) 0) |
| [2] |
Condron L M, Turner B L, Cade-Menun B J. Chemistry and dynamics of soil organic phosphorus[M]//Agronomy Monographs. Madison, WI, USA: American Society of Agronomy, Crop Science Society of America, and Soil Science Society of America, 2015: 87-121.
(  0) 0) |
| [3] |
George T S, Giles C D, Menezes-Blackburn D, et al. Organic phosphorus in the terrestrial environment: A perspective on the state of the art and future priorities[J]. Plant and Soil, 2018, 427(1/2): 191-208. DOI:10.1007/s11104-017-3391-x
(  0) 0) |
| [4] |
Menezes-Blackburn D, Giles C, Darch T, et al. Opportunities for mobilizing recalcitrant phosphorus from agricultural soils: A review[J]. Plant and Soil, 2018, 427(1/2): 5-16.
(  0) 0) |
| [5] |
Turner B L, Cade-Menun B J, Westermann D T. Organic phosphorus composition and potential bioavailability in semi-arid arable soils of the western United States[J]. Soil Science Society of America Journal, 2003, 67(4): 1168-1179. DOI:10.2136/sssaj2003.1168
(  0) 0) |
| [6] |
Chang S C, Jackson M L. Fractionation of soil phosphorus[J]. Soil Science, 1957, 84(2): 133-144. DOI:10.1097/00010694-195708000-00005
(  0) 0) |
| [7] |
Gu Y C, Jiang B F. Methods of determination of inorganic phosphorus fractionation in calcareous soil (In Chinese)[J]. Soils, 1990, 22(2): 101-102, 110. [顾益初, 蒋柏藩. 石灰性土壤无机磷分级的测定方法[J]. 土壤, 1990, 22(2): 101-102, 110.]
(  0) 0) |
| [8] |
Williams J D H, Syers J K, Walker T W. Fractionation of soil inorganic phosphate by a modification of Chang and Jackson's procedure[J]. Soil Science Society of America Journal, 1967, 31(6): 736-739. DOI:10.2136/sssaj1967.03615995003100060012x
(  0) 0) |
| [9] |
Hedley M J, Stewart J W B, Chauhan B S. Changes in inorganic and organic soil phosphorus fractions induced by cultivation practices and by laboratory incubations1[J]. Soil Science Society of America Journal, 1982, 46(5): 970-976. DOI:10.2136/sssaj1982.03615995004600050017x
(  0) 0) |
| [10] |
Cross A F, Schlesinger W H. A literature review and evaluation of the. Hedley fractionation: Applications to the biogeochemical cycle of soil phosphorus in natural ecosystems[J]. Geoderma, 1995, 64(3/4): 197-214.
(  0) 0) |
| [11] |
Negassa W, Leinweber P. How does the Hedley sequential phosphorus fractionation reflect impacts of land use and management on soil phosphorus: A review[J]. Journal of Plant Nutrition and Soil Science, 2009, 172(3): 305-325. DOI:10.1002/jpln.200800223
(  0) 0) |
| [12] |
Kizewski F R, Liu Y, Morris A, et al. Spectroscopic approaches for phosphorus speciation in soils and other environmental systems[J]. Journal of Environmental Quality, 2011, 40(3): 751-766. DOI:10.2134/jeq2010.0169
(  0) 0) |
| [13] |
Wang T, Zhou J M, Wang H Y. Methods for analysis of phosphorus forms in biosolids and soils (In Chinese)[J]. Acta Pedologica Sinica, 2011, 48(1): 185-191. [王涛, 周健民, 王火焰. 固体废弃物及土壤中磷的形态分析技术[J]. 土壤学报, 2011, 48(1): 185-191.]
(  0) 0) |
| [14] |
Cade-Menun B J. Characterizing phosphorus in environmental and agricultural samples by 31P nuclear magnetic resonance spectroscopy[J]. Talanta, 2005, 66(2): 359-371. DOI:10.1016/j.talanta.2004.12.024
(  0) 0) |
| [15] |
Liu J, Yang J J, Liang X Q, et al. Applications of synchrotron-based X-ray absorption near-edge structure spectroscopy in identifying solid state phosphorus speciation: A review (In Chinese)[J]. Chinese Journal of Applied Ecology, 2011, 22(10): 2757-2764. [刘瑾, 杨建军, 梁新强, 等. 同步辐射X射线吸收近边结构光谱技术在磷素固相形态研究中的应用[J]. 应用生态学报, 2011, 22(10): 2757-2764.]
(  0) 0) |
| [16] |
Zhou S W, Ma Y B, Xu M G, et al. Application of X-ray absorption fine structure spectroscopy to soil science (In Chinese)[J]. Acta Pedologica Sinica, 2008, 45(1): 155-164. DOI:10.3321/j.issn:0564-3929.2008.01.021 [周世伟, 马义兵, 徐明岗, 等. X射线吸收精细结构光谱在土壤中的应用[J]. 土壤学报, 2008, 45(1): 155-164.]
(  0) 0) |
| [17] |
Newman R H, Tate K R. Soil phosphorus characterisation by 31P nuclear magnetic resonance[J]. Communications in Soil Science and Plant Analysis, 1980, 11(9): 835-842. DOI:10.1080/00103628009367083
(  0) 0) |
| [18] |
Glonek T, Henderson T O, Hilderbrand R L, et al. Biological phosphonates: Determination by phosphorus-31 nuclear magnetic resonance[J]. Science, 1970, 169(3941): 192-194. DOI:10.1126/science.169.3941.192
(  0) 0) |
| [19] |
Henderson T O, Glonek T, Myers T C. Phosphorus-31 nuclear magnetic resonance spectroscopy of phospholipids[J]. Biochemistry, 1974, 13(3): 623-628. DOI:10.1021/bi00700a034
(  0) 0) |
| [20] |
Hanlon S, Glonek T, Chan A. Comparison of the phosphorus magnetic resonance and circular dichroism properties of calf Thymus DNA and chromatin[J]. Biochemistry, 1976, 15(17): 3869-3875. DOI:10.1021/bi00662a034
(  0) 0) |
| [21] |
Bedrock C N, Cheshire M V, Chudek J A, et al. Use of 31P-NMR to study the forms of phosphorus in peat soils[J]. Science of the Total Environment, 1994, 152(1): 1-8. DOI:10.1016/0048-9697(94)90545-2
(  0) 0) |
| [22] |
Hawkes G E, Powlson D S, Randall E W, et al. A 31P nuclear magnetic resonance study of the phosphorus species in alkali extracts of soils from long-term field experiments[J]. Journal of Soil Science, 1984, 35(1): 35-45. DOI:10.1111/j.1365-2389.1984.tb00257.x
(  0) 0) |
| [23] |
Zhang T, MacKenzie A F, Sauriol F. Nature of soil organic phosphorus as affected by long-term fertilization under continuous corn(Zea mays L.): A 31P NMR study[J]. Soil Science, 1999, 164(9): 662-670. DOI:10.1097/00010694-199909000-00006
(  0) 0) |
| [24] |
Mahieu N, Olk D C, Randall E W. Analysis of phosphorus in two humic acid fractions of intensively cropped lowland rice soils by 31P-NMR[J]. European Journal of Soil Science, 2000, 51(3): 391-402.
(  0) 0) |
| [25] |
Cade-Menun B J, Preston C M. A comparison of soil extraction procedures for 31P NMR spectroscopy[J]. Soil Science, 1996, 161(11): 770-785. DOI:10.1097/00010694-199611000-00006
(  0) 0) |
| [26] |
Turner B L, Mahieu N, Condron L M. Phosphorus-31 nuclear magnetic resonance spectral assignments of phosphorus compounds in soil NaOH-EDTA extracts[J]. Soil Science Society of America Journal, 2003, 67(2): 497-510. DOI:10.2136/sssaj2003.4970
(  0) 0) |
| [27] |
Turner B L, Richardson A E. Identification of scyllo-inositol phosphates in soil by solution phosphorus-31 nuclear magnetic resonance spectroscopy[J]. Soil Science Society of America Journal, 2004, 68(3): 802-808. DOI:10.2136/sssaj2004.8020
(  0) 0) |
| [28] |
Turner B L, Cade-Menun B J, Condron L M, et al. Extraction of soil organic phosphorus[J]. Talanta, 2005, 66(2): 294-306. DOI:10.1016/j.talanta.2004.11.012
(  0) 0) |
| [29] |
McDowell R W, Stewart I, Cade-Menun B J. An examination of spin-lattice relaxation times for analysis of soil and manure extracts by liquid state phosphorus-31 nuclear magnetic resonance spectroscopy[J]. Journal of Environmental Quality, 2006, 35(1): 293-302. DOI:10.2134/jeq2005.0285
(  0) 0) |
| [30] |
McDowell R W, Cade-Menun B J, Stewart I. Organic phosphorus speciation and pedogenesis: Analysis by solution 31P nuclear magnetic resonance spectroscopy[J]. European Journal of Soil Science, 2007, 58(6): 1348-1357. DOI:10.1111/j.1365-2389.2007.00933.x
(  0) 0) |
| [31] |
Smernik R J, Dougherty W J. Identification of phytate in phosphorus-31 nuclear magnetic resonance spectra: The need for spiking[J]. Soil Science Society of America Journal, 2007, 71(3): 1045-1050. DOI:10.2136/sssaj2006.0295
(  0) 0) |
| [32] |
Doolette A L, Smernik R J, Dougherty W J. Spiking improved solution phosphorus-31 nuclear magnetic resonance identification of soil phosphorus compounds[J]. Soil Science Society of America Journal, 2009, 73(3): 919-927. DOI:10.2136/sssaj2008.0192
(  0) 0) |
| [33] |
Hansen J C, Cade-Menun B J, Strawn D G. Phosphorus speciation in manure-amended alkaline soils[J]. Journal of Environmental Quality, 2004, 33(4): 1521-1527. DOI:10.2134/jeq2004.1521
(  0) 0) |
| [34] |
Leytem A B, Smith D R, Applegate T J, et al. The influence of manure phytic acid on phosphorus solubility in calcareous soils[J]. Soil Science Society of America Journal, 2006, 70(5): 1629-1638. DOI:10.2136/sssaj2006.0003
(  0) 0) |
| [35] |
Koopmans G F, Chardon W J, McDowell R W. Phosphorus movement and speciation in a sandy soil profile after long-term animal manure applications[J]. Journal of Environmental Quality, 2007, 36(1): 305-315. DOI:10.2134/jeq2006.0131
(  0) 0) |
| [36] |
Abdi D, Cade-Menun B J, Ziadi N, et al. Long-term impact of tillage practices and phosphorus fertilization on soil phosphorus forms as determined by 31P nuclear magnetic resonance spectroscopy[J]. Journal of Environmental Quality, 2014, 43(4): 1431-1441. DOI:10.2134/jeq2013.10.0424
(  0) 0) |
| [37] |
McLaren T I, Smernik R J, McLaughlin M J, et al. Complex forms of soil organic phosphorus-A major component of soil phosphorus[J]. Environmental Science & Technology, 2015, 49(22): 13238-13245.
(  0) 0) |
| [38] |
Hesterberg D, Zhou W, Hutchison K J, et al. XAFS study of adsorbed and mineral forms of phosphate[J]. Journal of Synchrotron Radiation, 1999, 6(Pt 3): 636-638.
(  0) 0) |
| [39] |
Beauchemin S, Hesterberg D, Chou J W, et al. Speciation of phosphorus in phosphorus-enriched agricultural soils using X-ray absorption near-edge structure spectroscopy and chemical fractionation[J]. Journal of Environmental Quality, 2003, 32(5): 1809-1819. DOI:10.2134/jeq2003.1809
(  0) 0) |
| [40] |
Lombi E, Scheckel K G, Armstrong R, et al. Speciation and distribution of phosphorus in a fertilized soil: A synchrotron-based investigation[J]. Soil Science Society of America Journal, 2006, 70(6): 2038-2048. DOI:10.2136/sssaj2006.0051
(  0) 0) |
| [41] |
Werner F, Prietzel J. Standard protocol and quality assessment of soil phosphorus speciation by P K-edge XANES spectroscopy[J]. Environmental Science & Technology, 2015, 49(17): 10521-10528.
(  0) 0) |
| [42] |
Doolette A L, Smernik R J. Soil organic phosphorus speciation using spectroscopic techniques[M]//Phosphorus in action. Soil Biology. Berlin, Heidelberg: Springer. 2011, 26: 3-36.
(  0) 0) |
| [43] |
Liu J, Yang J J, Cade-Menun B J, et al. Complementary phosphorus speciation in agricultural soils by sequential fractionation, solution P nuclear magnetic resonance, and phosphorus K-edge X-ray absorption near-edge structure spectroscopy[J]. Journal of Environmental Quality, 2013, 42(6): 1763-1770. DOI:10.2134/jeq2013.04.0127
(  0) 0) |
| [44] |
Acksel, Baumann, H u, et al. A look into the past: Tracing ancient sustainable manuring practices by thorough P speciation of northern European[J]. Soil Systems, 2019, 3(4): 72. DOI:10.3390/soilsystems3040072
(  0) 0) |
| [45] |
Liu J, Yang J, Liang X Q, et al. Molecular speciation of phosphorus present in readily dispersible colloids from agricultural soils[J]. Soil Science Society of America Journal, 2014, 78(1): 47-53. DOI:10.2136/sssaj2013.05.0159
(  0) 0) |
| [46] |
Liu J, Hu Y F, Yang J J, et al. Investigation of soil legacy phosphorus transformation in long-term agricultural fields using sequential fractionation, P K-edge XANES and solution P NMR spectroscopy[J]. Environmental Science & Technology, 2015, 49(1): 168-176.
(  0) 0) |
| [47] |
Kruse J, Abraham M, Amelung W, et al. Innovative methods in soil phosphorus research: A review[J]. Journal of Plant Nutrition and Soil Science, 2015, 178(1): 43-88. DOI:10.1002/jpln.201400327
(  0) 0) |
| [48] |
Colocho Hurtarte L C, Santana Amorim H C, Kruse J, et al. A novel approach for the quantification of different inorganic and organic phosphorus compounds in environmental samples by P L2, 3-edge X-ray absorption near-edge structure(XANES) spectroscopy[J]. Environmental Science & Technology, 2020, 54(5): 2812-2820.
(  0) 0) |
| [49] |
Rivard C, Lanson B, Cotte M. Phosphorus speciation and micro-scale spatial distribution in North-American temperate agricultural soils from micro X-ray fluorescence and X-ray absorption near-edge spectroscopy[J]. Plant and Soil, 2016, 401(1/2): 7-22. DOI:10.1007/s11104-015-2494-5
(  0) 0) |
| [50] |
Liu J, Yang J, Cade-Menun B J, et al. Molecular speciation and transformation of soil legacy phosphorus with and without long-term phosphorus fertilization: Insights from bulk and microprobe spectroscopy[J]. Scientific Reports, 2017, 7(1): 1-12. DOI:10.1038/s41598-016-0028-x
(  0) 0) |
| [51] |
Liu J, Sui P, Cade-Menun B J, et al. Molecular-level understanding of phosphorus transformation with long-term phosphorus addition and depletion in an alkaline soil[J]. Geoderma, 2019, 353: 116-124. DOI:10.1016/j.geoderma.2019.06.024
(  0) 0) |
| [52] |
Koch M, Kruse J, Eichlerl-Lobermann B, et al. Phosphorus stocks and speciation in soil profiles of a long-term fertilizer experiment: Evidence from sequential fractionation, P K-edge XANES, and 31P NMR spectroscopy[J]. Geoderma, 2018, 316: 115-126. DOI:10.1016/j.geoderma.2017.12.003
(  0) 0) |
| [53] |
Liu J, Cade-Menun B J, Yang J J, et al. Long-term land use affects phosphorus speciation and the composition of phosphorus cycling genes in agricultural soils[J]. Frontiers in Microbiology, 2018, 9: 1643. DOI:10.3389/fmicb.2018.01643
(  0) 0) |
| [54] |
Weyers E, Strawn D G, Peak D, et al. Phosphorus speciation in calcareous soils following annual dairy manure amendments[J]. Soil Science Society of America Journal, 2016, 80(6): 1531-1542. DOI:10.2136/sssaj2016.09.0280
(  0) 0) |
| [55] |
Abdala D B, da Silva I R, Vergütz L, et al. Long-term manure application effects on phosphorus speciation, kinetics and distribution in highly weathered agricultural soils[J]. Chemosphere, 2015, 119: 504-514. DOI:10.1016/j.chemosphere.2014.07.029
(  0) 0) |
| [56] |
Annaheim K E, Doolette A L, Smernik R J, et al. Long-term addition of organic fertilizers has little effect on soil organic phosphorus as characterized by 31P NMR spectroscopy and enzyme additions[J]. Geoderma, 2015, 257/258: 67-77. DOI:10.1016/j.geoderma.2015.01.014
(  0) 0) |
| [57] |
Vogel C, Rivard C, Tanabe I, et al. Microspectroscopy-promising techniques to characterize phosphorus in soil[J]. Communications in Soil Science and Plant Analysis, 2016, 47(18): 2088-2102. DOI:10.1080/00103624.2016.1228942
(  0) 0) |
 2021, Vol. 58
2021, Vol. 58

