2. 中国科学院南京土壤研究所, 南京 210008
2. Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China
目前,中国是世界第二大水稻生产国及最大水稻消费国[1],水稻生产在一定程度上影响着中国的粮食安全问题。氮肥的施用在水稻增产起到了至关重要的作用,但是当前氮肥利用率低下,造成大量的氮肥流失[2-3]。其中,氨挥发损失是稻田氮肥损失的主要途径之一,施用到农田中的肥料和动物粪便中的氮中约有10%至29%会以氨气挥发的形式流失[4-5]。当NH3进入大气时,不仅会改变全球气候变化并加剧温室效应,而且会部分氧化为氮氧化物,并以干湿沉降回到地面,从而引起环境问题,例如土壤酸化和水体富营养化[6]。氨挥发是在土壤的固-液-气相上发生的连续反应,因此,外部环境因素(气候条件,土壤,植被等)的变化将对氨的挥发产生显著的影响,已有研究表明,土壤和田间水的pH和
周丛生物是普遍生长的稻田水-土界面的一种由微藻、细菌、真核微生物、原生动物、后生动物以及其他自养和异养微生物组成的微生物聚集体[13]。现有研究发现,周丛生物对于调控氮、磷等养分在水土之间的迁移和转化方面发挥着重要作用[14]。微生物吸收氮和磷以使其生长,并保留营养物质作为其生物质的一部分[15-16],而微生物死亡后,氮将作为有机肥料释放回土壤中。研究表明,许多蓝细菌物种能够通过固氮提高农业领域的氮利用率[17],这种养分利用效率的提高,有效减少了因农田径流、挥发或者是下渗损失的养分。周丛生物中的藻类是其在氮素循环中起到关键作用的成分,藻类在一定程度上会增加水体中的pH,这可能会促进水体中的尿素水解,尤其是在添加高浓度氮素的情况下[18-19]。周丛生物可以在一定程度上减少水体和土壤中的氮素浓度,另一方面又会促进水体pH和尿素的水解,增加水体中的氮浓度,因此,周丛生物在对氨挥发上的作用是促进还是抑制尚不明确。基于以上研究背景,本研究拟通过大田微区实验揭示以下问题:(1)周丛生物能否影响稻田氨挥发;(2)周丛生物影响稻田氨挥发的驱动因素与潜在机制,以期寻找新的能够有效抑制稻田氨挥发的技术突破口,助力水稻生产的可持续发展。
1 材料与方法 1.1 研究区概况试验点位于辽宁省沈阳市苏家屯区十里河镇沈阳生态实验站(北纬41°31′,东经123°24′),平均海拔41 m,属温带半湿润大陆性季风气候,四季分明,雨热同期。年均温7~8 ℃,大于10 ℃的年活动积温3 100~3 400 ℃,年总辐射量120~135 Kcal·cm–2,无霜期147~164 d,年降水量650~700 mm。土壤基础理化性质为全氮(TN)1.6± 0.0 g·kg–1、全磷(TP)0.7±0.0 g·kg–1、全钾(TK)10.0±0.2 g·kg–1、总有机碳(TOC)17.2±0.4 g·kg–1。
1.2 试验设计2019年于水稻试验田中设置面积为1 m×1 m的微区,各微区随机排列。试验共设置2个处理:(1)周丛生物正常生长(WB);(2)添加特丁净(C10H19N5S)改变周丛生物生长处理(IB)。以上两个处理各设置3个重复,共6个微区;此外,设置2个微区用于生物量的破坏性采集,整个实验共设置8个微区。水稻品种采用当地品种,6月6日施用基肥(N肥144.0 kg·hm–2,P肥66.5 kg·hm–2,K肥94.2 kg·hm–2),7月11日施用分蘖肥(N 72.0 kg·hm–2),8月25日施用穗肥(N 24.0 kg·hm–2)。特丁净(C10H19N5S)每次施肥后施加,施用量为10 mg·m–2。
1.3 样品采集与理化性质分析每次施肥后的第2天开始测定氨挥发,测定方法采用连续气流密闭法[20],以每天7:00~9:00和15:00~17:00的平均通量值代表日氨挥发通量,持续测定至无明显氨挥发(7~10 d左右)。水稻生长全期(除施肥期)每10天采集一次周丛生物样品,以及对应时期周丛生物生物量样品。施肥期间每2天收集一次周丛生物样品。使用刮铲从稻田表面取出周丛生物,测定微生物组成。田面水采样时间和频率同周丛生物,采集完成后根据常规方法测定pH、TN、
试验期间气象信息列于表 1。
|
|
表 1 试验期间地面气象日变化数据[24] Table 1 Meteorological data during the experiment |
取周丛生物样品5~10 g,保存于无菌离心管中,液氮运回实验室,置于–80℃保存。通过对(16S/18S)的PCR扩增产物进行高通量测序,分析周丛生物中微生物群落多样性和分布规律,扩增子实验分析如下:(1)DNA提取:根据样本对应的DNA提取试剂盒(FastDNA® Spin Kit For Soil,USA)进行基因组DNA抽提后,使用1%琼脂糖凝胶电泳检测DNA的完整性和纯度,NanoDrop One检测DNA的浓度和纯度;(2)PCR扩增及产物电泳检测:以基因组DNA为模板,根据测序区域的选择,使用带barcode的引物及Premix Taq(TaKaRa)进行PCR扩增,16S V4区引物(515F和806R)以鉴定细菌多样性,18S V4区引物(528F和706R)以鉴定真核微生物多样性;(3)Pooling及切胶纯化:使用GeneTools Analysis Software(Version4.03.05.0,SynGene)对PCR产物进行浓度对比后,按照等质量原则计算各样品所需体积,将各PCR产物进行混合,使用E.Z.N.A. ® Gel Extraction Kit凝胶回收试剂盒回收PCR混合产物,TE缓冲液洗脱回收目标DNA片段。
扩增子实验分析完成后,按照NEBNext ® UltraTM DNA Library Prep Kit for Illumina ®标准流程进行建库操作,使用Illumina Hiseq 2500平台对构建的扩增子文库进行PE250测序。原始测序数据处理流程如下:(1)Paired-end raw reads数据过滤:使用Trimmomatic软件V0.33分别对双端的Raw Reads数据进行质量过滤,过滤含N的reads、质量值低于20及过滤后序列长度低于100bp的reads。同时,根据序列首尾两端的barcode和引物信息等,利用Mothur软件V1.35.1将序列分配至相应的样品中去除barcode和引物,得到质控后的paired-endclean reads;(2)Paired-end clean reads拼接:对于双端测序数据,根据PE reads之间的overlap的关系,利用FLASH V1.2.11软件对每对PE reads进行拼接,将成对的reads拼成一条序列,最小overlap长度设置为10bp,拼接序列的overlap区允许的最大错配比率为0.1,过滤不符合的Tags,获得原始的拼接序列(raw tags);(3)Raw Tags序列质量过滤:利用Mothur软件对拼接后的序列进行质量控制及过滤,得到有效的拼接片段(Clean Tags)。
1.5 数据分析氨气挥发通量的计算:
| $ F = 6 \times {10^{-2}} \times {\text{ }}(C \times V)/(\pi \times {r^2}) $ | (1) |
式中,F 为氨气的挥发通量(以N计kg·hm–2·d–1);C 为氨吸收液回收液中
氨挥发累计量计算:
| ${F_{{\rm{sum}}}} = \sum\nolimits_1^n {{F_n}} $ | (2) |
式中,
氨挥发损失率计算:
| ${F_{{\rm{loss}}}} = {F_{{\rm{sum}}}}/{M_{{\rm{urea}}}} \times 100\% $ | (3) |
式中,
使用Execl处理原始数据,SPSS进行单因素方差分析(ANOVA)、多重比较和相关性分析,显著性水平为0.05,Origin和Rstudio进行绘图。
2 结果 2.1 周丛生物对氨挥发的影响由图 1所示,在水稻不同生育期,尿素施用1~2 d内氨挥发通量达到最大值,后期逐渐减少。其中,对照处理中的基肥、分蘖肥、穗肥最大挥发量为8.5、3.6、0.2 kg·hm–2·d–1;使用C10H19N5S改变稻田周丛生物后,基肥施加期间,减少周丛生物生物量,可将氨挥发通量峰值由8.5降至5.1 kg·hm–2·d–1,降低了39.9%;而分蘖肥施加C10H19N5S,可将最大的氨挥发通量由3.6降低至2.0 kg·hm–2·d–1,降低了46%;穗肥添加后的氨挥发通量由2.0降低至1.2 kg·hm–2·d–1,实验组较对照组降低了40%。综上,添加C10H19N5S改变稻田周丛生物的生长可显著降低稻田氨挥发。
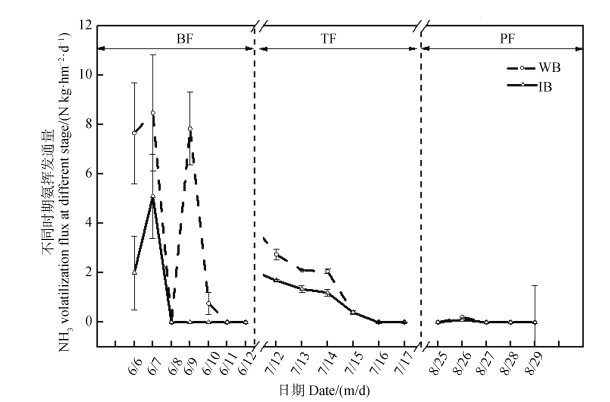
|
注:WB:对照组,周丛生物正常生长;IB:实验组,用C10H19N5调控周丛生物生长。BF:基肥;TF:分蘖肥;PF:穗肥。 Note: WB: periphyton growing normally; IB: periphyton treated with C10H19N5S. BF: Basal fertilizer; TF: Tillering fertilizer; PF: Panicle fertilizer. 图 1 改变周丛生物后在基肥期、分蘖肥期和穗肥期的NH3挥发通量 Fig. 1 Effects of addition of C10H19N5S on NH3 volatilization flux in the paddy soil after application of base, tillering and panicle fertilizer |
如表 2所示,对照组基肥时期氨挥发总量为24.8 kg·hm–2,分蘖期为10.9 kg·hm–2,穗肥期为0.2 kg·hm–2,整个水稻生长期的氨挥发总量为35.9 kg·hm–2,占总施氮肥量的14.9%;相比较而言,添加C10H19N5S调控周丛生物生长的处理组中不同时期的氨挥发量均受到明显抑制,基肥期和分蘖肥期分别降低17.6和10.9 kg·hm–2,穗期降低0.1 kg·hm–2,累计排放量减少至13.9 kg·hm–2,施肥后的氨挥发损失率减少至5.8%。添加C10H19N5S改变了周丛生物,进而减少了稻田氨挥发。
|
|
表 2 改变周丛生物对氨挥发累积量及氨挥发损失率的影响 Table 2 Effect of addition of C10H19N5S on accumulated ammonia volatilization and ammonia loss rate via volatilization |
稻田周丛生物在不同时期对田间水中氮含量也有一定影响。不同处理下的总体表现为施肥后水中氮含量增加,分蘖肥期最明显,然后逐渐降低。从图 2中可以看出,添加C10H19N5S改变生物被膜可以显着降低水中
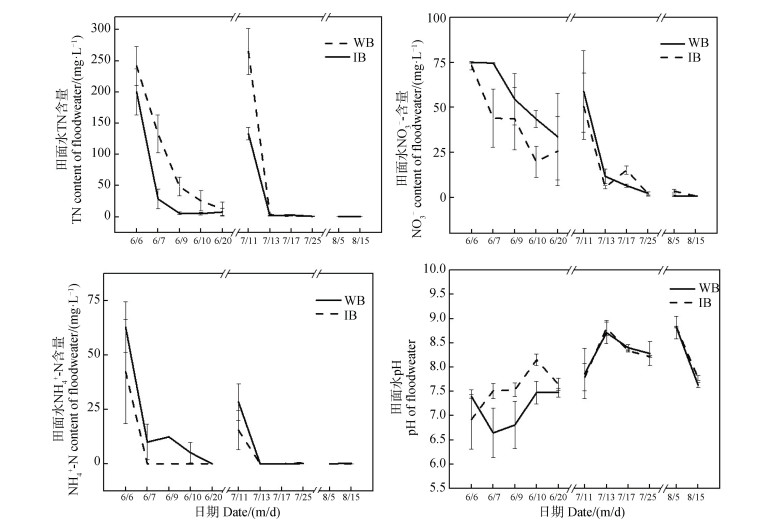
|
图 2 不同施肥期周丛生物对田面水中氮素含量和pH的影响 Fig. 2 Effects of periphyton on NO3–-N, NH4+-N, TN, and pH in the floodwater at different fertilization periods |
从图 2中可以看出,添加C10H19N5S对水体pH变化有一定影响,尤其以基肥期较为显著。基肥期间,添加C10H19N5S改变周丛生物处理下初期田面水pH较正常生长状态下降低了0.5,在基肥施加的中后期田面水pH逐渐增大,最高达到8.2,较周丛生物正常生长状态下田面水pH高出0.7。而在分蘖肥与穗肥期间,不同处理下的田面水pH差异不大。从整体上来看,前期控制周丛生物生长一定程度上促进了pH,在添加C10H19N5S改变周丛生物后期的pH相对周丛生物正常生长有所降低。
2.3 C10H19N5S对周丛生物生物量的影响周丛生物正常生长状态下,生物量峰值达79.9 g·m–2,施肥后明显增加,以基肥施加后最为显著,分蘖肥施加后一周生物量逐渐降低,最低16.9 g·m–2。C10H19N5S的添加对周丛生物生物量有明显的抑制作用(图 3),从基肥施加后的第2天开始,周丛生物的生物量最低达到19.7 g·m–2。分蘖肥施加期间,周丛生物的生物量整体有所增高,但是添加C10H19N5S的实验组生物量仍较对照组(WB)低了1.7~5 g·m–2。穗肥添加期间,两组处理下生物量在水稻全期中均最低,这是由水稻生长旺盛,水层和土壤层中光照不充足,同时随着温度的降低,周丛生物的生长受到这两个关键因素的抑制从而减缓[20]。
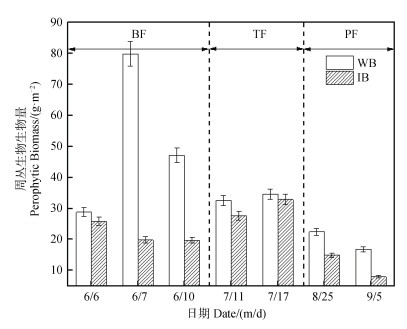
|
图 3 添加C10H19N5S对不同时期周丛生物生物量的影响 Fig. 3 Effect of addition of C10H19N5S on periphytic biomass in different fertilization periods |
从图 4a可以看出,真核微生物群落结构中以淡色藻门Ochrophyta(8.1%~67.6%)、隐真菌门Cryptomycota(3.9%~54.8%)、线虫动物Nematoda(0.6%~42.6%)为优势微生物。在这三种优势菌中,隐真菌门Cryptomycota在基肥施加后占比最高,而淡色藻门Ochrophyta在分蘖期和穗期有明显增高。C10H19N5S的添加对隐真菌门Cryptomycota有明显的影响,在水稻生长全期降低了5.3%~30.3%,而淡色藻门Ochrophyta的丰度在不同时期均表现出先增高后降低的趋势。在水稻分蘖前(6月10日—7月11日),C10H19N5S的添加对线虫动物Nematoda促进作用显著,最高增加了12.5%。
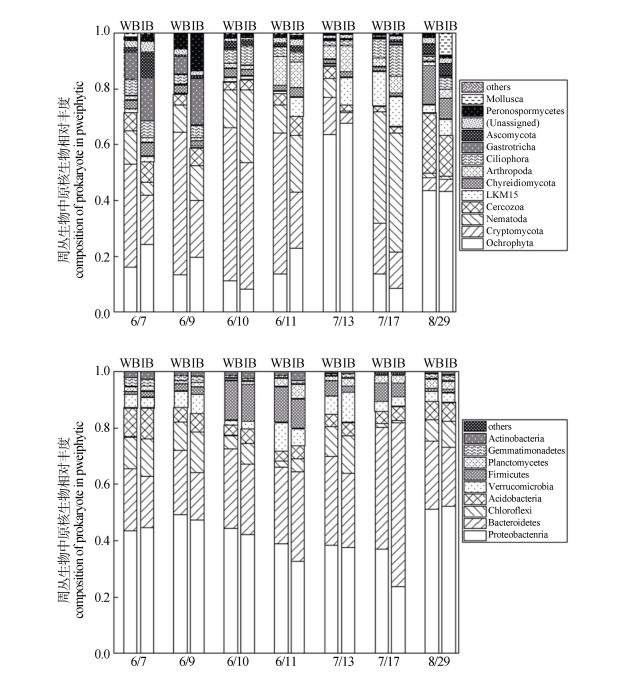
|
图 4 C10H19N5S在施肥期对周丛生物中真核生物(a)以及原核生物(b)群落结构丰度的影响 Fig. 4 Effect of addition of C10H19N5S on compositions of eukaryote (a) and prokaryote (b) in periphyton in different fertilization periods |
添加C10H19N5S的添加后不同时期周丛生物中的细菌群落结构丰度(图 4b)从整体上看以变形菌门Proteobacteria(52.1%~23.7%)、拟杆菌门Bacteroidetes(58.1%~16.8%)、绿湾菌门Chloroflexi(14.6%~0.8%)、酸杆菌门Acidobacteria(11.0%~3.3%)为优势菌种。基肥施加后期(6月10日)和分蘖肥施加前期(7月11日),厚壁菌门Firmicutes丰度明显增大至10.7%~14.4%。C10H19N5S添加后变形菌门Proteobacteria丰度在分蘖期降低了0.7%~13.5%,拟杆菌门Bacteroidetes丰度在苗期降低了3.4%~6.2%。相反,绿湾菌门Chloroflexi和酸杆菌门Acidobacteria的丰度均明显增加,最高增加了4.5%和1.3%。
2.5 周丛生物介导的氨挥发影响因子将不同时期田间氨挥发与周丛生物影响下的田面水理化性质、周丛生物中的群落结构进行相关性分析,并筛选相关性较好的因子(P < 0.1)作为能够有效影响周丛生物介导的氨挥发过程的潜在因素。如图 5所示,不同时期,周丛生物的生物量与氨挥发呈显著正相关(r=0.526,P=0.053),即氨挥发通量随着周丛生物生物量的增加而增大。然而,周丛生物细菌门上仅芽孢单菌门Gemmatimonadetes的相对丰度与氨挥发通量显著相关,占优势的几种细菌和真核微生物并无显著相关,推测周丛生物中是稀有物种主导氨挥发。对于田面水中的理化性质,
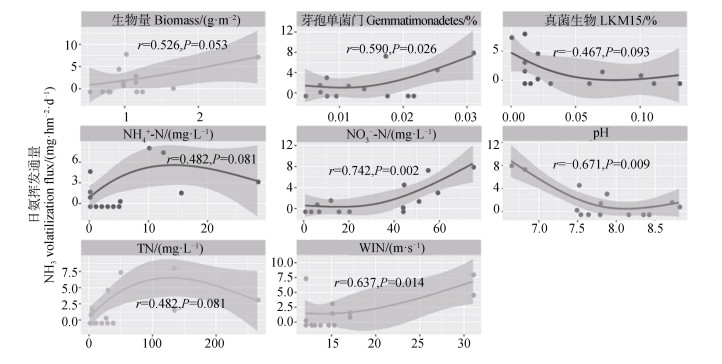
|
图 5 稻田土壤氨挥发通量与田间关键因子的相关性分析 Fig. 5 Correlation analysis of ammonia volatilization flux with key factors in the field. |
将显著相关的微生物以及理化因子作为自变量,不同处理瞬时氨挥发量作为因变量,建立多元线性逐步回归分析,进行模型拟合,可以基于稻田周丛生物预测稻田氨挥发通量。根据表公式(4)可知:以
| $\begin{gathered} y\left( {{\rm{N}}{{\rm{H}}_3}} \right) = - 6.581 + 0.360{\rm{NO}}_{\rm{3}}^ - \\ - {\rm{N + 0}}{\rm{.281WIN + 2}}{\rm{.816Biomass}} \\ \end{gathered} $ | (4) |
氨挥发是发生在稻田气层、水层以及土壤层上的相对复杂的物理化学反应过程,主要是由尿素施入土壤后水解,形成碳酸铵,然后分解产生铵离子、氨气、二氧化碳和氢氧根,一般在施肥后的7~10 d左右发生。本实验中氨挥发通量在施肥后的2~4 d为峰值[25],5 d后开始下降。已有研究表明施氮量的增加会提高田面水中pH以及
在添加特丁净后,稻田不同时期的氨挥发量出现了明显的降低,氨挥发损失率降低了9.1%,表明使用特丁净调控周丛生物生长能够显著影响稻田氨挥发。C10H19N5S常作为田间除草剂,在除草的同时可以抑制藻类的光合作用,降低藻类浓度,短时间抑制田面水pH升高[31-32],已有研究表明C10H19N5S在伴随着脲酶抑制的使用效果显著[33]。基于C10H19N5S对田间藻类以及pH的作用,以及对稻田中较小的毒性,本实验选用低浓度的C10H19N5S改变周丛生物结构,降低周丛生物中的藻类活性,以减少藻类通过光合作用引法的氨挥发加速。从结果看,添加C10H19N5S后周丛生物中的生物量出现了降低,同时,在相关性分析中稻田周丛生物生物量与氨挥发也有显著的正相关。C10H19N5S可以通过抑制光系统Ⅱ(PSII)来干扰藻类的光合作用[34],它与PSII的QB位点特异性结合,减少电子向质体醌库的转移[35],抑制光合作用氧气的释放[36]。Brust等[37]研究表明C10H19N5S对附生藻类的抑制作用是周丛生物生物量减少的直接原因。与对照组(周丛生物正常生长)相比,添加C10H19N5S后周丛生物量减少,并且田面水
通过构建模型发现,相比于田面水NO3--N含量和地面风速两个因素,周丛生物的生物量变化对氨挥发有更大的影响作用,日氨挥发通量在周丛生物生物量减少的情况下减少,而田面水NH4+-N浓度的降低是周丛生物影响氨挥发的直接原因。
4 结论田面水氮素含量、地面风速、周丛生物生物量是影响氨挥发通量的三个关键因子。其中周丛生物对稻田氨挥发有一定促进作用,添加C10H19N5S抑制周丛生物生长后可以降低田间9.1%的氨挥发损失率,但是这种抑制作用并不是通过降低田面水pH实现的,而是通过改变周丛生物的生物量及其微生物组成以及降低田面水中氮素含量产生作用,添加C10H19N5S能够降低稻田周丛生物生物量,改变周丛生物微生物群落结构,抑制富营养化微生物(拟杆菌门Bacteroidetes、变形菌门Proteobacteria)的丰度,增加贫营养化微生物(酸杆菌门Acidobacteria)的丰度,进而以低成本、高效的技术降低氨挥发累积量,缓解稻田温室气体排放带来的环境压力。
| [1] |
Zhao Y L, Li S, Huang Z H, et al. Study on performance and cultivation techniques of hybrid rice Chunyou 927 in Dongyang (In Chinese)[J]. Journal of Zhejiang Agricultural Sciences, 2018, 59(6): 898-899. [赵永良, 李珊, 黄志海, 等. 水稻春优927在东阳的试种表现及栽培技术[J]. 浙江农业科学, 2018, 59(6): 898-899.]
(  0) 0) |
| [2] |
Zhu Z L, Chen D L. Nitrogen fertilizer use in China-Contributions to food production, impacts on the environment and best management strategies[J]. Nutrient Cycling in Agroecosystems, 2002, 63(2/3): 117-127. DOI:10.1023/A:1021107026067
(  0) 0) |
| [3] |
Stevens C J, Dise N B, Mountford J O, et al. Impact of nitrogen deposition on the species richness of grasslands[J]. Science, 2004, 303(5665): 1876-1879. DOI:10.1126/science.1094678
(  0) 0) |
| [4] |
Bouwman A F, Boumans L J M, Batjes N H. Estimation of global NH3 volatilization loss from synthetic fertilizers and animal manure applied to arable lands and grasslands[J]. Global Biogeochemical Cycles, 2002, 16(2): 8-1-8-14. DOI:10.1029/2000GB001389
(  0) 0) |
| [5] |
Tian G M, Cai Z C, Cao J L, et al. Ammonia volatilization from paddy field and its affecting factors in Zhenjiang hilly region (In Chinese)[J]. Acta Pedologica Sinica, 2001, 38(3): 324-332. DOI:10.3321/j.issn:0564-3929.2001.03.012 [田光明, 蔡祖聪, 曹金留, 等. 镇江丘陵区稻田化肥氮的氨挥发及其影响因素[J]. 土壤学报, 2001, 38(3): 324-332.]
(  0) 0) |
| [6] |
Cameron K C, Di H J, Moir J L. Nitrogen losses from the soil/plant system: A review[J]. Annals of Applied Biology, 2013, 162(2): 145-173. DOI:10.1111/aab.12014
(  0) 0) |
| [7] |
Han W J, Chen H X, Zou C Y, et al. Study on the progress of farmland ammonia volatilization (In Chinese)[J]. Journal of Green Science and Technology, 2015(7): 199-200. DOI:10.3969/j.issn.1674-9944.2015.07.089 [韩蔚娟, 陈海潇, 邹春野, 等. 农田氨挥发的进展研究[J]. 绿色科技, 2015(7): 199-200.]
(  0) 0) |
| [8] |
Sun H J, Min J, Shi W M, et al. Effects of nitrification inhibitor on rice production and ammonia volatilization in paddy rice field (In Chinese)[J]. Soils, 2015, 47(6): 1027-1033. [孙海军, 闵炬, 施卫明, 等. 硝化抑制剂施用对水稻产量与氨挥发的影响[J]. 土壤, 2015, 47(6): 1027-1033.]
(  0) 0) |
| [9] |
Yu Q G, Fu J R. Ammonia volatilization loss character of urea with DMPP addition and its controlling strategy (In Chinese)[J]. Journal of Agro-Environment Science, 2009, 28(4): 744-748. DOI:10.3321/j.issn:1672-2043.2009.04.019 [俞巧钢, 符建荣. 含DMPP抑制剂尿素的氨挥发特性及阻控对策研究[J]. 农业环境科学学报, 2009, 28(4): 744-748.]
(  0) 0) |
| [10] |
Zhang X L, Sun Y, Zhang S Q, et al. Effects of biochar on N2O emission from four typical soils in the North China Plain (In Chinese)[J]. Environmental Science, 2019, 40(11): 5173-5181. [张秀玲, 孙贇, 张水清, 等. 生物质炭对华北平原4种典型土壤N2O排放的影响[J]. 环境科学, 2019, 40(11): 5173-5181.]
(  0) 0) |
| [11] |
Sun A W, Shi Y L, Zhang D S, et al. Application of nitrification-urease inhibitors in agriculture (In Chinese)[J]. Chinese Journal of Soil Science, 2004, 35(3): 357-361. DOI:10.3321/j.issn:0564-3945.2004.03.027 [孙爱文, 石元亮, 张德生, 等. 硝化/脲酶抑制剂在农业中的应用[J]. 土壤通报, 2004, 35(3): 357-361.]
(  0) 0) |
| [12] |
Turner D A, Edis R B, Chen D, et al. Determination and mitigation of ammonia loss from urea applied to winter wheat with N-(n-butyl)thiophosphorictriamide[J]. Agriculture, Ecosystems & Environment, 2010, 137(3/4): 261-266.
(  0) 0) |
| [13] |
Wu Y. Periphyton: Functions and application in environmental remediation[EB/OL]. 2016
(  0) 0) |
| [14] |
Yang Y, Chen W, Yi Z Y, et al. The integrative effect of periphyton biofilm and tape grass(Vallisneria natans)on internal loading of shallow eutrophic lakes[J]. Environmental Science and Pollution Research International, 2018, 25(2): 1773-1783. DOI:10.1007/s11356-017-0623-9
(  0) 0) |
| [15] |
Liu J Z, Vyverman W. Differences in nutrient uptake capacity of the benthic filamentous algae Cladophora sp., Klebsormidium sp. and Pseudanabaena sp. under varying N/P conditions[J]. Bioresource Technology, 2015, 179: 234-242. DOI:10.1016/j.biortech.2014.12.028
(  0) 0) |
| [16] |
Liu J Z, Wu Y H, Wu C X, et al. Advanced nutrient removal from surface water by a consortium of attached microalgae and bacteria: A review[J]. Bioresource Technology, 2017, 241: 1127-1137. DOI:10.1016/j.biortech.2017.06.054
(  0) 0) |
| [17] |
Pereira I, Ortega R, Barrientos L, et al. Development of a biofertilizer based on filamentous nitrogen-fixing cyanobacteria for rice crops in Chile[J]. Journal of Applied Phycology, 2009, 21(1): 135-144. DOI:10.1007/s10811-008-9342-4
(  0) 0) |
| [18] |
Rodriguez Castro M C, Urrea G, Guasch H. Influence of the interaction between phosphate and arsenate on periphyton's growth and its nutrient uptake capacity[J]. Science of the Total Environment, 2015, 503/504: 122-132. DOI:10.1016/j.scitotenv.2014.06.094
(  0) 0) |
| [19] |
Su J, Kang D, Xiang W, et al. Periphyton biofilm development and its role in nutrient cycling in paddy microcosms[J]. Journal of Soils and Sediments, 2017, 17(3): 810-819. DOI:10.1007/s11368-016-1575-2
(  0) 0) |
| [20] |
Murphy D V, MacDonald A J, Stockdale E A, et al. Soluble organic nitrogen in agricultural soils[J]. Biology and Fertility of Soils, 2000, 30(5/6): 374-387.
(  0) 0) |
| [21] |
Wu Y P, Li Y J, Zhao L H, et al. Determination of total phosphorus content and total potassium content in soil with continuous flow analytical method (In Chinese)[J]. Southwest China Journal of Agricultural Sciences, 2013, 26(5): 1941-1945. [吴玉萍, 李应金, 赵立红, 等. 连续流动分析法测定土壤中全磷、全钾的含量[J]. 西南农业学报, 2013, 26(5): 1941-1945.]
(  0) 0) |
| [22] |
Zhou W, Tian Y H, Yin B. Ammonia volatilization and nitrogen balance after topdressing fertilization in paddy fields of Taihu Lake region (In Chinese)[J]. Chinese Journal of Eco-Agriculture, 2011, 19(1): 32-36. [周伟, 田玉华, 尹斌. 太湖地区水稻追肥的氨挥发损失和氮素平衡[J]. 中国生态农业学报, 2011, 19(1): 32-36.]
(  0) 0) |
| [23] |
Wu L, Ma Y H, Fu B Y, et al. Reviews on agricultural nonpoint source pollution monitoring techniques and methods (In Chinese)[J]. Agricultural Science & Technology, 2014, 15(12): 2214-2217. DOI:10.3969/j.issn.1009-4229.2014.12.038 [吴靓, 马友华, 付碧玉, 等. 农田面源污染监测技术与方法[J]. 农业科学与技术, 2014, 15(12): 2214-2217.]
(  0) 0) |
| [24] |
国家气象科学数据中心. 中国地面气候资料日值数据集(V3.0)[EB/OL]. 2019. National Meteorological Data Center. http://data.cma.cn/. [EB/OL]. 2019. (  0) 0) |
| [25] |
Su C G, Yin B, Zhu Z L, et al. Ammonia volatilization loss of nitrogen fertilizer from rice field and wet deposition of atmospheric nitrogen in rice growing season (In Chinese)[J]. Chinese Journal of Applied Ecology, 2003, 14(11): 1884-1888. DOI:10.3321/j.issn:1001-9332.2003.11.016 [苏成国, 尹斌, 朱兆良, 等. 稻田氮肥的氨挥发损失与稻季大气氮的湿沉降[J]. 应用生态学报, 2003, 14(11): 1884-1888.]
(  0) 0) |
| [26] |
Lin D X, Fan X H, Hu F, et al. Ammonia volatilization and nitrogen utilization efficiency in response to urea application in rice fields of the Taihu Lake region, China[J]. Pedosphere, 2007, 17(5): 639-645. DOI:10.1016/S1002-0160(07)60076-9
(  0) 0) |
| [27] |
He T H, Liu D Y, Yuan J J, et al. A two years study on the combined effects of biochar and inhibitors on ammonia volatilization in an intensively managed rice field[J]. Agriculture, Ecosystems & Environment, 2018, 264: 44-53.
(  0) 0) |
| [28] |
Ju X T, Xing G X, Chen X P, et al. Reducing environmental risk by improving N management in intensive Chinese agricultural systems[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(9): 3041-3046. DOI:10.1073/pnas.0813417106
(  0) 0) |
| [29] |
Liu J G, Diamond J. China's environment in a globalizing world[J]. Nature, 2005, 435(7046): 1179-1186. DOI:10.1038/4351179a
(  0) 0) |
| [30] |
Liu X J, Ju X T, Zhang Y, et al. Nitrogen deposition in agroecosystems in the Beijing area[J]. Agriculture, Ecosystems & Environment, 2006, 113(1/2/3/4): 370-377.
(  0) 0) |
| [31] |
Bowmer K H, Muirhead W A. Inhibition of algal photosynthesis to control pH and reduce ammonia volatilization from rice floodwater[J]. Fertilizer Research, 1987, 13(1): 13-29. DOI:10.1007/BF01049799
(  0) 0) |
| [32] |
Vlek P L G, Stumpe J M, Byrnes B H. Urease activity and inhibition in flooded soil systems[J]. Fertilizer Research, 1980, 1(3): 191-202. DOI:10.1007/BF01053131
(  0) 0) |
| [33] |
Chaiwanakupt P, Freney J R, Keerthisinghe D G, et al. Use of urease, algal inhibitors, and nitrification inhibitors to reduce nitrogen loss and increase the grain yield of flooded rice(Oryza sativa L.)[J]. Biology and Fertility of Soils, 1996, 22(1/2): 89-95. DOI:10.1007/BF00384438
(  0) 0) |
| [34] |
Broser M, Glöckner C, Gabdulkhakov A, et al. Structural basis of cyanobacterial photosystem Ⅱ inhibition by the herbicide terbutryn[J]. Journal of Biological Chemistry, 2011, 286(18): 15964-15972. DOI:10.1074/jbc.M110.215970
(  0) 0) |
| [35] |
Xiong J, Hutchison R S, Sayre R T, et al. Modification of the photosystem Ⅱ acceptor side function in a D1 mutant(arginine-269-glycine)of Chlamydomonas reinhardti[J]. Biochimica et Biophysica Acta, 1997, 1322(1): 60-76. DOI:10.1016/S0005-2728(97)00063-7
(  0) 0) |
| [36] |
Zimmermann K, Heck M, Frank J, et al. Herbicide binding and thermal stability of photosystem Ⅱ isolated from Thermosynechococcus elongatus[J]. Biochimica et Biophysica Acta—Bioenergetics, 2006, 1757(2): 106-114. DOI:10.1016/j.bbabio.2005.12.002
(  0) 0) |
| [37] |
Brust K, Licht O, Hultsch V, et al. Effects of terbutryn on aufwuchs and Lumbriculus variegatus in artificial indoor streams[J]. Environmental Toxicology and Chemistry, 2001, 20(9): 2000. DOI:10.1002/etc.5620200919
(  0) 0) |
| [38] |
Hahm M S, Son J S, Kim B S, et al. Comparative study of rhizobacterial communities in pepper greenhouses and examination of the effects of salt accumulation under different cropping systems[J]. Archives of Microbiology, 2017, 199(2): 303-315. DOI:10.1007/s00203-016-1304-7
(  0) 0) |
| [39] |
Clark C M, Tilman D. Loss of plant species after chronic low-level nitrogen deposition to prairie grasslands[J]. Nature, 2008, 451(7179): 712-715. DOI:10.1038/nature06503
(  0) 0) |
 2021, Vol. 58
2021, Vol. 58


