第5次全国监测数据显示,我国沙化土地面积达到172.12万km2,占国土面积的17.93%[1]。沙化土地主要集中在我国北方地区,对当地经济和社会的发展,人们的生活以及生态平衡影响巨大。长久以来,我国一直致力于沙化土地生态恢复治理,尤其在沙漠与人类生活区域交界处,进行了大量的沙漠治理,阻止了沙漠对人类生存环境的进一步侵袭。在已使用的治沙方法中,生物土壤结皮(biological soil crusts)是其中效果明显的一种。它是土壤碳氮循环的重要组成部分,不仅能提高土壤的稳定性、抗风蚀和保持水分的能力,还能增加土壤肥力,提高植物吸收营养元素的能力,在沙漠生态系统中占有重要地位[2-6]。生物土壤结皮组成复杂,具有耐干旱和高温等特点,其中尤属苔藓结皮的抗机械干扰、固沙和蓄水能力最强。
微生物是土壤活性的重要组成部分,国内外学者对生物土壤结皮的微生物群落特性进行了研究。Maier等[7]对西班牙塔伯纳斯盆地的生物土壤结皮进行研究发现,蓝藻门(Cyanobacteria)在结皮层中丰度高而在结皮下方土壤中丰度低;相反地,结皮下方土壤中酸杆菌门(Acidobacteria)、疣微菌门(Verrucomicrobia)、芽单胞菌门(Gemmatimonadetes)、浮霉菌门(Planctomycetes)、装甲菌门(Armatimonadetes)的含量明显更高。科罗拉多高原地衣结皮中真菌多样性明显高于之前蓝藻结皮中测定的结果;和采样地对应的细菌相比真菌的生物量更少,多样性更低;真菌多样性和人为干扰呈负相关,和地衣结皮覆盖呈正相关[8]。腾格里沙漠苔藓结皮中的微生物生物量和微生物磷脂脂肪酸浓度高于蓝藻-地衣结皮,生物土壤结皮的发育年龄与微生物生物量和微生物磷脂脂肪酸浓度呈正相关,并且显著影响0~20 cm土壤层的微生物生物量碳和氮;生物土壤结皮在沙丘地带的定殖和发育有益于植被恢复区的土壤微生物特性和土壤质量[9]。贾丽娟等[10]研究发现,与周围临近裸土相比,中央戈壁石下生物土壤结皮细菌群落结构和多样性明显不同,生物结皮和临近裸土中的细菌最优势菌门分别为Cyanobacteria和Actinobacteria,生物结皮中的优势属为Trichocoleus、Chroococcidiopsis和Cyanobacteria纲的1个未知属,临近裸土中的优势属为Arthrobacter、Rubrobacter和3个属于Actinobacteria门和Acidobacteria门的未知属;与临近裸土相比,生物结皮中有效磷、速效氮和叶绿素a的含量均明显升高,而pH则略微降低。目前有关生物结皮对土壤微生物群落影响的研究,多集中在生物结皮本身,或将生物结皮与周围裸地进行横向比较,或与结皮下层土壤间进行纵向比较,或将不同类型结皮(藻结皮、地衣结皮和苔藓结皮)之间进行比较。故样品采集多集中于生物结皮层、结皮下方土壤以及裸地土壤,而作为对照的裸地土壤并未区分表层和下层,缺乏对生物结皮层与同厚度裸地表层之间以及它们各自下方土壤之间的微生物群落组成与多样性方面的细致比较与分析。本研究采集毛乌素沙地苔藓结皮层和结皮下方土壤,以及裸沙地的相应表层和下层土壤,通过综合分析更加细致地研究了生物结皮对土壤细菌群落及其生存环境的影响。研究结果为固沙治理和荒漠生态恢复提供理论依据。
1 材料与方法 1.1 土壤样品采集样地选在毛乌素沙地东南缘神木县圪丑沟(38°53'44″~38°53'49″N,109°53'43″~109°53'46″E)。选取3块油蒿周围地面长有苔藓结皮的样地,分别采集结皮层(0~1.5 cm)和结皮层下方沙土(1.5~11.5 cm)的样品;并且选取3块同一区域的裸沙地作为对照,分别采集表层(0~1.5 cm)和下层(1.5~11.5 cm)的土样。每块样地的大小为0.5 m×0.5 m,用铲子沿对角线取3次混匀后作为一个样品。苔藓结皮3块样地呈直线分布,相互之间距离为10~15 m(裸沙样地情况一样)。不同土壤类型的命名分别为结皮层(Biological soil crusts,BC),结皮下方土壤(Layer beneath biological soil crusts,LBBC),裸沙表层土壤(Surface soil,SS),裸沙下层土壤(Layer beneath surface soil,LBSS)。采集的土壤样品于采样途中低温保存,后续用于微生物多样性测定的样品于–80℃下保存;用于理化性质测定的样品自然风干后过60目筛。
1.2 土壤理化性质测定采用pH计(OHAUS STARTER2100酸度计)法测定土壤pH,碳酸氢钠浸提—钼锑抗分光光度法(Alpha-1506紫外可见分光光度计)测定土壤有效磷(AP),重铬酸钾容量法测定土壤有机质(OM),碱解扩散法测定土壤有效氮(AN),硝酸钠浸提—四苯硼钠比浊法测定土壤速效钾(AK),过硫酸盐消化法测定土壤全氮(TN)、全磷(TP)。
土壤粒度测定:称量3 g土样于100 mL烧杯中,加入10% H2O2 20 mL,于通风橱内控温电热板上加热,温度为80~120℃(最佳温度90℃),H2O2耗尽时继续加入H2O2,直至不再有气泡。再加入10% HCl 10 mL,耗尽时继续加入HCl至不再有气泡。加满蒸馏水静置一夜,抽滤出水,除过量酸,如此反复数次,直至呈中性。抽滤出去水后,加入10 mL(NaPO3)6溶液,超声震荡10 min,用激光粒度仪(Mastersizer2000激光粒度分析仪)测定土壤粒度。具体指标包括粗砂(CS)、细砂(FS)、粗粉砂(CST)、粉粒(ST)和黏粒(CY)。
1.3 土壤样品16S rRNA基因扩增子高通量测序土壤样本采集后送上海美吉生物医药科技有限公司进行16S rRNA基因扩增子高通量测序。具体过程为:采用通过引物338F(5′-ACTCCTACGGGA GGCAGCAG-3′)和806R(5′-GGACTACHVGGG TWTCTAAT-3′)[11]对V3-V4可变区进行PCR扩增。PCR产物用2%琼脂糖凝胶回收纯化,用Tris-HCl洗脱后,用2%琼脂糖电泳检测。利用QuantiFluorTM-ST(Promega,USA)进行定量检测。根据Illumina MiSeq平台(Illumina,SanDiego,USA)标准操作规程将纯化后的扩增片段构建PE 2×300的文库。运用Illumina公司的Miseq PE300平台进行测序。测序完成后,数据上传美吉云平台。登录平台(https://cloud.majorbio.com/)后,先进行基础分析以获得OUT丰度表,具体过程为:使用Trimmomatic软件对原始测序序列进行质量控制,并用FLASH软件进行拼接。使用UPARSE软件(version 7.1 http://drive5.com/uparse/),以97%的相似度为依据,对序列进行OTU聚类;并用UCHIME软件提出嵌合体。利用RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对Silva数据库(SSU123),将比对阈值设为70%。随后在美吉云平台进行交互分析,包括在OTU水平进行的排序分析和VPA分析,在门水平和属水平进行的细菌群落组成分析,在属水平进行的组间物种差异分析、相关性热图分析和共现性网络分析。采用Spearman相关系数进行环境因子与物种之间的相关性Heatmap分析、Network网络分析以及两组组间物种差异显著性Student’s T检验。
1.4 荧光定量PCR扩增荧光定量PCR采用同上高通量测序的引物。20 μL反应体系为:10 μL 2 X ChamQ SYBR Color qPCR Master Mix,上下游引物(5 μmol·L–1)各0.8 μL,2 μL模板,0.4 μL 50 X ROX Reference Dye 1,6 μL ddH2O。扩增程序为:95℃预变性3 min;95℃变性5 s,58℃退火30 s,72℃延伸1 min。使用ABI7300型荧光定量PCR仪(Applied Biosystems,USA)进行扩增。每个样品设置3个重复,以土壤干重计算最终基因丰度。
1.5 试验数据统计分析通过Excel2003和SPSS19.0对试验数据进行统计分析。
2 结果 2.1 结皮对土壤理化性质的影响BC样本组的各项土壤化学指标均总体上高于其他三个土壤样本组(表 1)。BC中有效磷、速效钾、有效氮含量均显著高于SS中的含量,可见结皮层能够有效富集这些速效养分;相比于LBSS,LBBC中有效磷、速效钾、有效氮的含量有升高趋势。BC中全氮和有机质的含量显著高于SS中的含量,LBBC中全磷和有机质含量高于LBSS。在4个样本组中,BC的pH最低,其土壤略呈酸性。
|
|
表 1 不同样本组的土壤化学性质 Table 1 Soil chemical properties of different sample groups |
土壤结皮显著改变了沙地土壤颗粒组成(表 2),其中BC和LBBC相比于SS和LBSS有黏粒出现,其组成比率分别为2.75%和0.18%;BC和LBBC中的粉粒含量分别为7.57%和5.04%,粗粉砂含量分别为42.28%和48.77%,2个指标均显著高于SS和LBSS;而细砂的含量则显著低于SS和LBSS,可见BC和LBBC的土壤样本中颗粒粒径有明显变小的趋势。生物结皮的形成显著增加了土壤中细颗粒物含量。
|
|
表 2 不同样本组的土壤颗粒组成 Table 2 Soil particle composition of different sample groups (%) |
荧光定量PCR试验结果显示,BC、LBBC、SS、LBSS四个土壤样本组的16S rRNA基因丰度的均值分别为1.79×1010 copies·g–1干土、2.43×109 copies·g–1干土、1.99×107 copies·g–1干土、4.55×106 copies·g–1干土。将基因丰度取对数作图(图 1),可见BC和LBBC样本组的细菌丰度均显著高于SS和LBSS样本组,并且BC样本组也显著高于LBBC样本组。
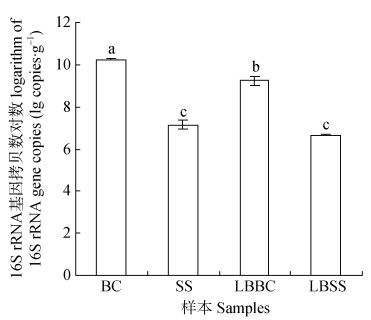
|
注:不同字母表示差异显著(P < 0.05)。 Note: Different letters mean significant difference (P < 0.05). 图 1 苔藓结皮对细菌丰度的影响 Fig. 1 Effects of moss crust on the abundance of bacteria |
样本高通量测序稀释曲线皆趋于平缓,测序深度合理。LBBC的香农指数和辛普森指数值在四组样本中最大,其微生物多样性在四组样本中最高。LBSS的香农指数和辛普森指数值居中。BC和SS的多样性指数值非常接近,均低于LBBC和LBSS土壤样本组(表 3)。
|
|
表 3 不同样本组的多样性指数 Table 3 Diversity indexes of different sample groups |
在门(phylum)水平上绘制细菌群落组成柱形图(图 2),将相对丰度小于0.01归为others(图中显示相对丰度前13的细菌门)。各样本组相对丰度排在前5的细菌门分别为:BC样本组中,Actinobacteria(38.52%)、Proteobacteria(26.01%)、Acidobacteria(8.59%)、Cyanobateria(8.12%)、Chloroflexi(7.66%);SS样本组中,Actinobacteria(32.22%)、Proteobacteria(27.18%)、Bacteroidetes(15.62%)、Acidobacteria(8.08%)、Chloroflexi(6.10%);LBBC样本组中,Actinobacteria(31.01%)、Proteobacteria(23.72%)、Acidobacteria(16.20%)、Chloroflexi(13.43%)、Gemmatimonadetes(4.18%);LBSS样本组中,Actinobacteria(33.40%)、Proteobacteria(30.84%)、Acidobacteria(10.00%)、Chloroflexi(8.94%)、Bacteroidetes(5.92%)。
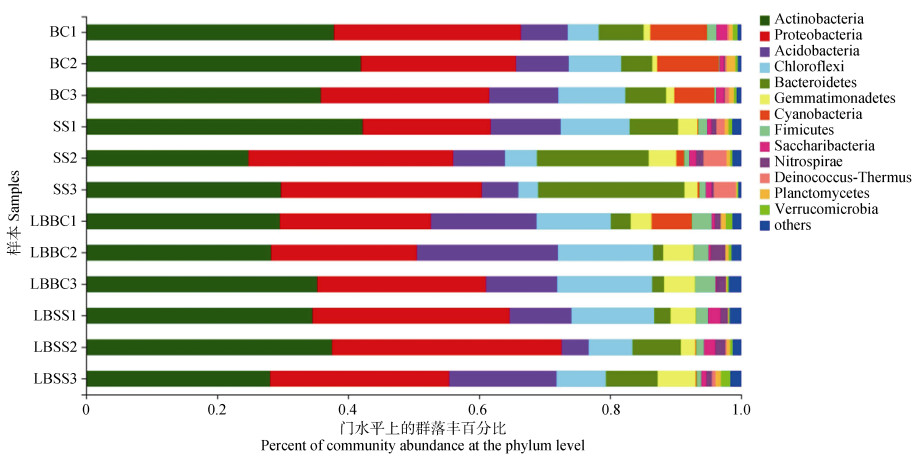
|
图 2 门水平上土壤样本细菌群落组成 Fig. 2 Bacterial community composition of soil samples at the phylum level |
在属(genus)水平上绘制细菌群落组成柱形图(图 3),将相对丰度小于0.04归为others(图中显示相对丰度前15的细菌属)。各样本组相对丰度排在前5的细菌属分别为:BC样本组中,unclassifiled_f__Micromonosporaceae(11.58%)、norank_c__Cyanobacteria(7.13%)、RB41(4.35%)、unclassified_o__Sphigomonoadales(3.18%)、Roseiflexus(3.16%);SS样本组中,Hymenobacter(10.22%)、norank_o__Frankiales(4.72%)、RB41(4.25%)、Methylobacterium(3.91%)、Sphingomonas(3.22%);LBBC样本组中,norank_c__Acidobacteria(7.59%)、RB41(5.30%)、Rubrobacter(3.38%)、norank_c__Actinobacteria(2.84%)、Roseiflexus(2.77%);LBSS样本组中,Sphingomonas(3.84%)、norank_o__Acidimicrobiales(3.54%)、RB41(3.51%)、Streptomyces(3.00%)、unclassified_f__ Micrococcaceae(2.70%)。
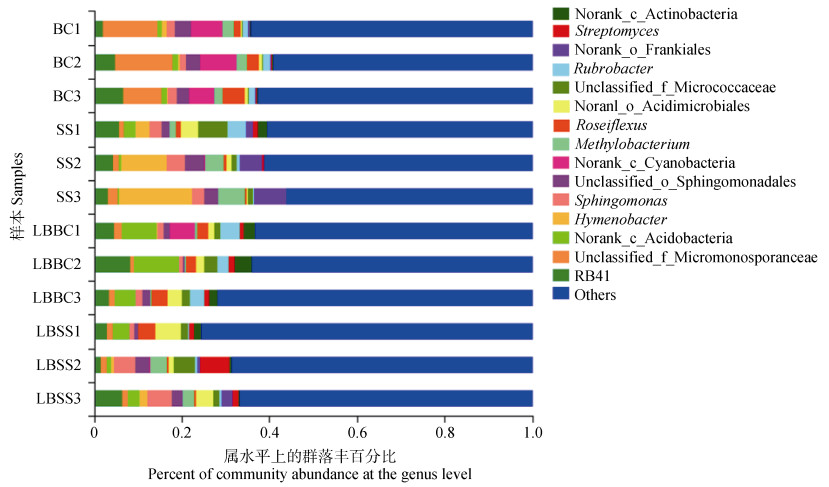
|
图 3 属水平上土壤样品细菌群落组成 Fig. 3 Bacterial community composition of soil samples at the genus level |
在PCA(Principal component analysis)分析中PC1轴和PC2轴的贡献率分别为41.23%和27.73%,两者贡献率之和为68.96%。由于4个样本组在PCA分析中的排序结果与RDA分析(图 4)相比没有差异,故PCA分析排序结果参见图 4。BC在PC1轴上与其他三个土壤样本组能够区分明晰,表示BC与其他三个土壤样本组的细菌群落组成存在明显差异。BC与SS之间间隔最远,两者之间群落组成差异最大;LBBC与LBSS的样本点分布分别呈两个方向,说明在BC的影响下,LBBC的细菌群落组成与LBSS相比出现差异。
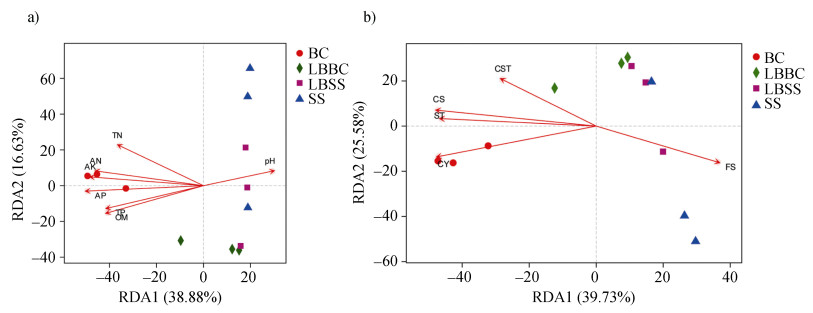
|
图 4 细菌群落组成与土壤化学性质(a)和土壤颗粒组成(b)的RDA分析 Fig. 4 Redundancy analysis of bacterial community composition and soil chemical properties (a)and soil particle composition (b) |
图 4a为土壤化学性质与细菌群落组成之间的RDA(Redundancy analysis)分析图,RDA1轴和RDA2轴的解释度分别为38.88%和16.63%,两者之和的解释度为55.51%。各环境因子对样本细菌群落组成的影响程度为有效磷、速效钾、有效氮的影响最大;有机质、全磷和全氮影响次之;pH影响最小。图 4b为土壤颗粒组成与细菌群落组成之间的RDA分析图,RDA1轴的解释度为39.73%,RDA2轴的解释度为25.58%,两者之和的解释度为65.31%。土壤颗粒组成对样本细菌群落组成的影响程度为粉砂、黏粒、粗砂的影响最大,细砂次之,粗粉砂最小。
在图 4a和图 4b中样本点均分布在两个区域,Ⅰ区为RDA1正半轴部分,SS和LBSS样本点在此分布;Ⅱ区为RDA1负半轴部分,BC样本点在此分布;LBBC样本点在Ⅰ区和Ⅱ区都有分布。在图 4a中,Ⅰ区分布的SS和LBSS样本组的细菌群落组成除与pH呈正相关外,与其他因子均呈负相关;Ⅱ区分布的BC样本组的细菌群落组成除与pH值呈负相关外,与其他因子均呈正相关。在图 4b中,Ⅰ区分布的SS和LBSS样本组的细菌群落组成与粗粉砂、粗砂、粉粒、黏粒呈负相关,与细砂呈正相关;Ⅱ区分布的BC样本组的细菌群落组成与粗粉砂、粗砂、粉粒、黏粒呈正相关,与细砂呈负相关。
对与BC样本组细菌群落组成呈正相关的土壤化学因子(有效磷、速效钾、有效氮、全磷、全氮、有机质)和土壤颗粒组成(粗砂、粗粉砂、粉粒、黏粒)之间进行VPA分析,结果显示土壤颗粒组成的单独解释度为0.075,高于土壤化学因子的单独解释度0.057。对与BC样本组细菌群落组成呈负相关的土壤化学因子(pH)和土壤颗粒组成(细砂)之间进行VPA分析,结果显示细砂的单独解释度为0.238,高于pH的单独解释度0.078。综合来看,在微生物组成影响方面,土壤颗粒组成的影响权重高于土壤化学因子。
2.7 组间物种差异选取属水平上相对丰度前15的物种进行组间差异性分析。图 5a为BC和SS样本组之间物种差异分析。可看出BC与SS比较中在unclassifiled_f__Micromonosporaceae(属于小单孢菌科的1个未知属),norank_c__Cyanobacteria(属于蓝藻纲的1个未知属)以及Pseudonocardia(假诺卡氏菌属)方面存在极显著差异,且均为BC中的相对丰度高于SS中的相对丰度。由图 5b可知,LBBC与LBSS两个样本组之间在Rubrobacter(红色杆菌属)存在极显著差异,在norank_c__Acidobacteria(属于酸杆菌纲的1个未知属)存在显著差异,且均为LBBC中的相对丰度高于LBSS中的相对丰度。

|
图 5 属水平上BC与SS(a)和LBBC与LBSS(b)的组间物种差异分析 Fig. 5 Analysis of bacterial types differences between BC and SS (a) and between LBBC and LBSS (b) at the genus level |
选取属水平上相对丰度前18的物种与土壤化学性质绘制相关性Heatmap图。如图 6a所示,与SS相比在BC中相对丰度有显著优势的unclassifiled_f__Micromonosporaceae、norank_c__ Cyanobacteria和Pseudonocardia均与AP、OM、AK、AN、TP、TN呈正相关,都与pH呈负相关。其中,unclassifiled_f__Micromonosporaceae与TN呈极显著正相关,与AP呈显著正相关;norank_ c__Cyanobacteria与AP、AK、TP、TN均呈极显著正相关;Pseudonocardia与AP呈极显著正相关,与AK、AN呈显著正相关。与LBSS相比在LBBC中相对丰度有显著优势的norank_c__Acidobacteria,除与OM呈正相关外,与其他测定的土壤养分,包括AP、AK、AN、TP、TN,均呈负相关;Rubrobacter除与TN呈负相关外,与AP、OM、AK、AN、TP均呈正相关。
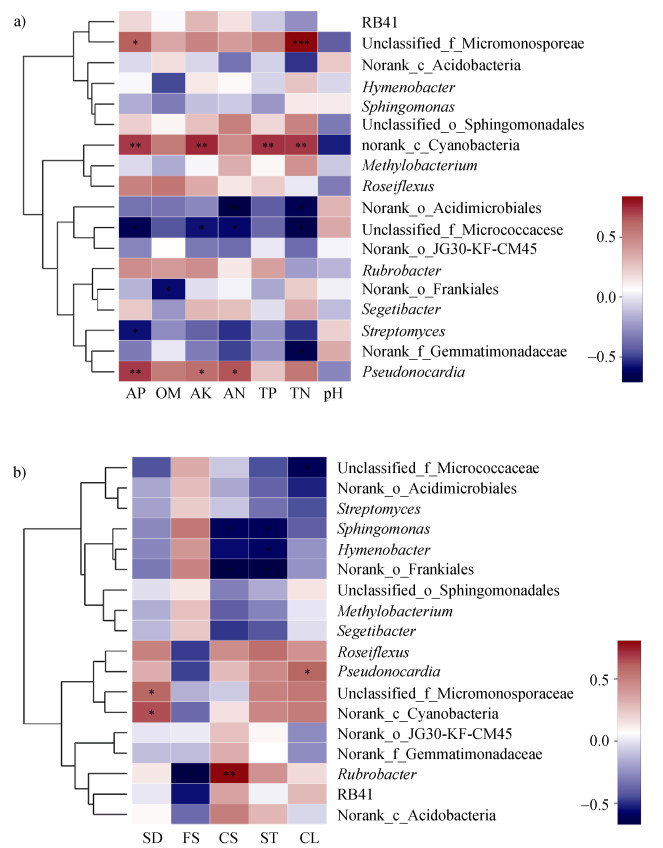
|
图 6 属水平上细菌种类与土壤化学性质(a)和土壤颗粒组成(b)的相关性热图 Fig. 6 A correlation heatmap of bacterial types and soil chemical properties (a) and soil particle composition (b) at the genus level |
选取属水平上相对丰度前18的物种与土壤颗粒组成绘制相关性Heatmap图。如图 6b所示,与SS和LBSS分别相比在BC和LBBC中相对丰度有显著优势的5个属(Pseudonocardia、unclassifiled_ f__Micromonosporaceae、norank_c__Cyanobacteria、Rubrobacter、norank_c__Acidobacteria)均与FS(裸沙地的主要颗粒组成)呈负相关,其中Rubrobacter与FS呈显著负相关;并且该5个属与ST(结皮土壤中含量显著增多)均呈正相关。此外,Pseudonocardia、norank_c__Cyanobacteria、Rubrobacter、norank_c__Acidobacteria这4个属与CST(同样是结皮土壤中含量显著增多)均呈正相关,而且Rubrobacter与CST呈极显著正相关。此外,Pseudonocardia、unclassifiled_f__Micromonosporaceae、norank_c__Cyanobacteria、Rubrobacter这4个属与CY呈正相关,并且Pseudonocardia与CY呈显著正相关。
2.9 共现性网络苔藓结皮的形成影响BC和LBBC中细菌的群落组成,与裸沙地表层和下层的对照分别相比其相对丰度具有显著优势的物种中,norank_c__ Acidobacteria在共现性网络(图 7)中与其他细菌之间的联系最密切,连接度(the degree of connections)最高,且多为正相关作用关系;unclassifiled_f__ Micromonosporaceae、norank_c__Cyanobacteria和Pseudonocardia与其他细菌之间的联系程度次之,且unclassifiled_f__Micromonosporaceae和Pseudonocardia多为负相关作用关系,norank_c__ Cyanobacteria的正、负相关作用关系参半;Rubrobacter与其他细菌之间的联系程度最小。与SS相比在BC中相对丰度有显著优势的unclassifiled_ f__Micromonosporaceae、norank_c__Cyanobacteria和Pseudonocardia三者之间互为正相关作用关系,与LBSS相比在LBBC中相对丰度有显著优势的norank_c__Acidobacteria和Rubrobacter之间亦为正相关作用关系。此外,放线菌门(蓝色结点所示)在苔藓结皮区域土壤中占有非常重要的地位。
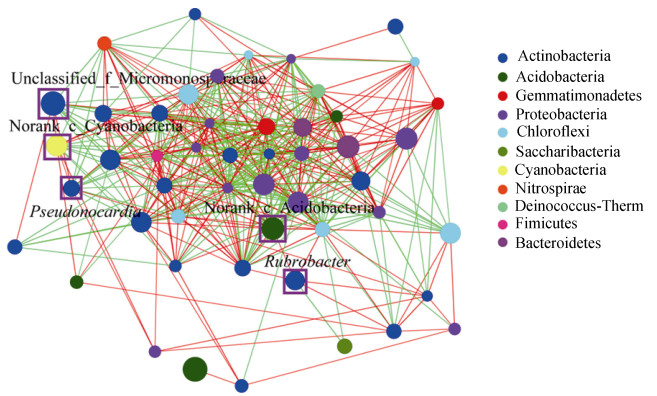
|
注:红色线表示相互作用关系为正,绿色线表示相互作用关系为负,节点上标记的为显著差异物种,P < 0.05。 Note: The red line indicates positive interaction, the green line indicates negative interaction, marked nodes represent significantly different species, P < 0.05. 图 7 苔藓结皮影响下细菌共现性网络 Fig. 7 Co-occurrence network of bacteria under the influence of moss crust |
苔藓结皮层所测定的各项土壤养分指标均高于裸沙表层、结皮下方沙土和裸沙下层。从水平方向上看,生物土壤结皮的速效养分含量显著高于裸沙表层,这是因为苔藓结皮中的微生物及植物能够有效地富集速效养分。生物土壤结皮的pH值略低于7,在4个样本组中最低,可能是结皮层中的微生物能够分泌酸性物质所致[12-13]。生物结皮的形成使得土壤化学性质发生改变,结皮中的微生物群落结构与环境化学存在密切联系[14]。当生物结皮将养分富集后,植被灌丛可以有效利用这些养分而得到生长,而且植物可以减少干扰并提供遮阴条件,促进生物结皮的生长[15],并且不同植被类型对生物结皮的发育影响不同[16]。在这样的相互促进下,植物和结皮共同生长,起到固沙的作用。结皮下方土壤的有效磷、有效氮、速效钾含量均高于裸沙下层土壤,可见在结皮层的影响下,结皮下方土壤中的速效养分含量有所增加。在土壤粒度组成方面,苔藓结皮层与结皮下方土壤均有黏粒出现,且粉粒和粗粉砂的含量分别高于裸沙表层和裸沙下层,说明生物土壤结皮的土壤粒径小于裸沙土壤。大量粗粉砂的出现是生物结皮形成的前提条件和物质基础,而结皮层的发育又促进了粗粉砂风化,故而逐渐有了黏粒的出现[13]。生物结皮层具有明显富集细颗粒物的能力,并随着生物结皮层形成年份的延长逐渐增加,这种能力对改善沙土土壤理化性质,对沙土发育演变过程具有积极作用[17-18]。
3.2 苔藓结皮对沙化土壤细菌群落的影响细菌群落组成柱形图分析结果显示,在门水平上,结皮层样本中Actinobacteria和Cyanobateria的相对丰度分别为38.52%和8.12%,明显高于裸沙表层样本;在属水平上,结皮层样本中unclassifiled_ f__Micromonosporaceae(属于小单孢菌科的1个未知属,归于Actinobacteria门)和norank_c__Cyanobacteria(属于蓝藻纲的1个未知属,归于Cyanobacteria门)的相对丰度分别为11.58%和7.13%,也明显高于裸沙表层样本。可见无论从门水平还是属水平上分析苔藓结皮优势菌群的结果一致,其对生物固沙具有重要作用。结皮层的样本点最为集中,说明其组内样本之间细菌群落组成差异最小;在结皮层影响下,结皮下方土壤组内样本之间细菌群落组成差异小于裸沙下层土壤。说明苔藓结皮的形成可使土壤细菌群落组成组内之间差异变小。苔藓结皮的形成使结皮层及其下方土壤中的细菌丰度均显著高于裸沙表层和下层,并且结皮层中的细菌丰度最高。在四组样本中,结皮下方土壤细菌多样性最高,而非结皮层土壤细菌多样性最高。唐凯[19]对浑善达克沙地生物土壤结皮研究发现结皮层的细菌多样性低于结皮下方土壤。从共现性网络分析可知,在苔藓结皮层相对丰度最高的unclassifiled_f__Micromonosporaceae(属于小单孢菌科的1个未知属)与其他细菌之间多为负相关作用关系,可能与小单孢菌科的微生物能够分泌抗生素有关[20];而结皮下方土壤中相对丰度最高的norank_c__Acidobacteria(属于酸杆菌纲的1个未知属)与其他细菌之间多为正相关作用关系。土壤细菌群落中优势菌群与其他细菌之间的正、负相关作用关系可能会影响土壤细菌群落的多样性。苔藓结皮层的形成对沙地原有表层细菌群落产生重要影响,unclassifiled_f__Micromonosporaceae和norank_ c__Cyanobacteria的相对丰度明显高于裸沙表层;并且在土壤理化性质方面使其各项土壤养分指标均明显高于裸沙表层,但对pH影响较小。从Heatmap分析可以看出,pH对4个样本组中的细菌种类没有显著影响,而有效磷、速效钾、全磷、全氮等因子对结皮样本组中的优势细菌unclassifiled_f__ Micromonosporaceae和norank_c__Cyanobacteria具有显著或极显著影响。说明结皮的形成对细菌群落的影响大于pH。
在之前的研究中,缺少对裸沙地进行表层和下层的分层取样,故而在进行结皮与裸沙的对比分析时针对性不足。而从细菌群落组成分析中可知,裸沙表层和裸沙下层土壤之间存在明显差异,将对照沙地进行分层取样,对比分析才更准确。在毛乌素沙地苔藓结皮的影响下,不同深度土壤细菌群落中的一些物种发生显著变化。且unclassifiled_f__ Micromonosporaceae和norank_c__Cyanobacteria在苔藓结皮中的相对丰度位于前两位,norank_ c__Acidobacteria在结皮下方土壤中的相对丰度排在首位,进一步说明苔藓结皮的形成对结皮层土壤及其下方土壤细菌群落中优势物种的形成具有重要影响。丛枝菌根真菌在生物土壤结皮中广泛存在,对于荒漠生态系统具有重要作用,其群落多样性与生物结皮之间关联密切[21]。在后续研究中可考虑对裸沙和生物结皮进行分层取样,更加细致地对比分析结皮形成对荒漠土壤丛枝菌根真菌群落的影响。
3.3 苔藓结皮及其下方土壤中丰度显著增加的细菌的固沙能力与裸沙表层和下层土壤分别相比,在毛乌素沙地苔藓结皮和其下方土壤中相对丰度显著增加的物种,在固沙过程中应具有重要作用。其中,unclassifiled_f__Micromonosporaceae、Pseudonocardia和Rubrobacter同属于放线菌门(Actinobacteria),Actinobacteria是常见的土壤寄居者,有极强的黏附能力,可以成为贮菌源,其分泌出来的黏液可以将沙土黏结[22],其丝状菌体也利于结皮层结构的稳定。并且Actinobacteria是土壤团聚体的重要组成部分,负责稳定土壤团聚体的结构[23-24]。细菌norank_c__Cyanobacteria属于蓝藻门(Cyanobacteria),Cyanobacteria在苔藓结皮中占有重要地位[25-26],生物结皮演替早期阶段的藻结皮具有显著高于地衣结皮和苔藓结皮的固氮能力,有助于荒漠生态系统进行原始养分积累;在维管植物大规模出现后,可以继续固定大气中的氮素,不断积累土壤有机质,为周围的维管植物和土壤微生物提供养分来源,促进了荒漠生态系统的正向演替[27-28]。此外,扫描电子显微镜观察发现丝状蓝藻与胞外多聚分泌物形成一个错综复杂的网络,能够在土壤表面结合、附着矿物颗粒,增强了生物结皮的结构稳定性[29]。细菌norank_c__Acidobacteria属于酸杆菌门(Acidobacteria),同Actinobacteria一样,Acidobacteria也是土壤团聚体的重要组成部分,在稳定土壤团聚体的结构方面发挥着重要作用[23-24]。
4 结论沙地苔藓结皮能有效富集速效养分和全效养分,并细化沙粒。有效磷、速效钾、有效氮、黏粒、粉粒、粗砂是影响沙地苔藓结皮区域细菌群落组成的重要环境因子。苔藓结皮层中16S rRNA基因拷贝数最高,结皮下方土壤中微生物多样性最高。在研究生物结皮的过程中,对照沙地也要分层取样,微生物群落对比分析才更准确。苔藓结皮的形成对结皮层土壤及其下方土壤细菌群落中优势物种的形成具有重要影响,这些物种对稳定沙地土壤结构具有重要作用。因此,苔藓结皮的形成对沙地原有表层及下层土壤的细菌群落产生显著影响,利于生物固沙。
| [1] |
Zhou Y, Yang X C, Jin Y X, et al. Classification of the desertification control models in North China (In Chinese)[J]. Journal of Desert Research, 2020, 40(3): 106-114. [周颖, 杨秀春, 金云翔, 等. 中国北方沙漠化治理模式分类[J]. 中国沙漠, 2020, 40(3): 106-114.]
(  0) 0) |
| [2] |
Gao L Q, Bowker M A, Xu M X, et al. Biological soil crusts decrease erodibility by modifying inherent soil properties on the Loess Plateau, China[J]. Soil Biology & Biochemistry, 2017, 105: 49-58.
(  0) 0) |
| [3] |
Li X R, Tan H J, Hui R, et al. Researches in biological soil crust of China: A review (In Chinese)[J]. Chinese Science Bulletin, 2018, 63(23): 2320-2334. [李新荣, 谭会娟, 回嵘, 等. 中国荒漠与沙地生物土壤结皮研究[J]. 科学通报, 2018, 63(23): 2320-2334.]
(  0) 0) |
| [4] |
Young M H, Fenstermaker L F, Belnap J. Monitoring water content dynamics of biological soil crusts[J]. Journal of Arid Environments, 2017, 142: 41-49. DOI:10.1016/j.jaridenv.2017.03.004
(  0) 0) |
| [5] |
Zhao L N, Liu Y B, Wang Z R, et al. Bacteria and fungi differentially contribute to carbon and nitrogen cycles during biological soil crust succession in arid ecosystems[J]. Plant and Soil, 2020, 447(1/2): 379-392. DOI:10.1007/s11104-019-04391-5
(  0) 0) |
| [6] |
Chiquoine L P, Abella S R, Bowker M A. Rapidly restoring biological soil crusts and ecosystem functions in a severely disturbed desert ecosystem[J]. Ecological Applications, 2016, 26(4): 1260-1272. DOI:10.1002/15-0973
(  0) 0) |
| [7] |
Maier S, Schmidt T S B, Zheng L J, et al. Analyses of dryland biological soil crusts highlight lichens as an important regulator of microbial communities[J]. Biodiversity and Conservation, 2014, 23(7): 1735-1755. DOI:10.1007/s10531-014-0719-1
(  0) 0) |
| [8] |
Bates S T, Nash T H III, Sweat K G III, et al. Fungal communities of lichen-dominated biological soil crusts: Diversity, relative microbial biomass, and their relationship to disturbance and crust cover[J]. Journal of Arid Environments, 2010, 74(10): 1192-1199. DOI:10.1016/j.jaridenv.2010.05.033
(  0) 0) |
| [9] |
Liu Y M, Li X R, Xing Z S, et al. Responses of soil microbial biomass and community composition to biological soil crusts in the revegetated areas of the Tengger Desert[J]. Applied Soil Ecology, 2013, 65: 52-59. DOI:10.1016/j.apsoil.2013.01.005
(  0) 0) |
| [10] |
Jia L J, Tang K, Lan H Q, et al. Diversity and structure of hypolithic bacteria community of Zhongyang Gobi (In Chinese)[J]. Microbiology China, 2018, 45(12): 2603-2613. [贾丽娟, 唐凯, 兰慧青, 等. 中央戈壁石下生物土壤结皮中细菌群落结构和多样性[J]. 微生物学通报, 2018, 45(12): 2603-2613.]
(  0) 0) |
| [11] |
张博. 超声耦合碱解预处理促进高固污泥厌氧消化的工艺特性研究[D]. 天津: 天津大学, 2017. Zhang B. Characteristics of coupled ultrasonic and alkaline pretreatment on enhancing anaerobic digestion of high-solid sludge[D]. Tianjin: Tianjin University, 2017. (  0) 0) |
| [12] |
Kakeh J, Gorji M, Sohrabi M, et al. Effects of biological soil crusts on some physicochemical characteristics of rangeland soils of Alagol, Turkmen Sahra, NE Iran[J]. Soil & Tillage Research, 2018, 181: 152-159.
(  0) 0) |
| [13] |
Yang J Z, Bu C F, Zhang X C. Primary study on development characteristics of biological soil crust in Mu Us Sandy Land in Northern Shaanxi (In Chinese)[J]. Journal of Soil and Water Conservation, 2009, 23(6): 162-165, 189. DOI:10.3321/j.issn:1009-2242.2009.06.036 [杨建振, 卜崇峰, 张兴昌. 陕北毛乌素沙地生物结皮发育特征的初步研究[J]. 水土保持学报, 2009, 23(6): 162-165, 189.]
(  0) 0) |
| [14] |
Swenson T L, Karaoz U, Swenson J M, et al. Linking soil biology and chemistry in biological soil crust using isolate exometabolomics[J]. Nature Communications, 2018, 9: 19. DOI:10.1038/s41467-017-02356-9
(  0) 0) |
| [15] |
Ghiloufi W, Chaieb M. Vascular plant diversity associated with biological soil crusts: Insights from Mediterranean arid ecosystem[J]. African Journal of Ecology, 2017, 55(2): 252-255. DOI:10.1111/aje.12342
(  0) 0) |
| [16] |
Wu Y S, Yin R P, Tian X M, et al. Development characteristics of biological crusts under artificial vegetation in southern mu us sandy land (In Chinese)[J]. Journal of Desert Research, 2018, 38(2): 339-344. [吴永胜, 尹瑞平, 田秀民, 等. 毛乌素沙地南缘人工植被区生物结皮发育特征[J]. 中国沙漠, 2018, 38(2): 339-344.]
(  0) 0) |
| [17] |
Yan D R, Huang H G, Zhang S N, et al. Nutrients and particle composition characteristics in moss biological crusts (In Chinese)[J]. Journal of Arid Land Resources and Environment, 2018, 32(10): 111-116. [闫德仁, 黄海广, 张胜男, 等. 沙漠苔藓生物结皮层养分及颗粒组成特征[J]. 干旱区资源与环境, 2018, 32(10): 111-116.]
(  0) 0) |
| [18] |
He F L, Guo C X, Wu H, et al. Effect of biological soil crust succession on soil texture, nutrient contents, and microbial populations of dune surfaces at the edge of the Minqin Oasis (In Chinese)[J]. Acta Ecologica Sinica, 2017, 37(18): 6064-6073. [何芳兰, 郭春秀, 吴昊, 等. 民勤绿洲边缘沙丘生物土壤结皮发育对浅层土壤质地、养分含量及微生物数量的影响[J]. 生态学报, 2017, 37(18): 6064-6073.]
(  0) 0) |
| [19] |
唐凯. 浑善达克沙地生物土壤结皮细菌多样性和群落结构研究[D]. 呼和浩特: 内蒙古农业大学, 2016. Tang K. Community structure and diversity of bacteria in biological soil crusts of Hunshandake deserts[D]. Huhhot: Inner Mongolia Agricultural University, 2016. (  0) 0) |
| [20] |
Adnani N, Vazquez-Rivera E, Adibhatla S, et al. Investigation of interspecies interactions between marine Micromonosporaceae for identification of novel antibiotics[J]. Planta Medica, 2015, 81(11): 913.
(  0) 0) |
| [21] |
Qi J H, Liu Y B, Li X R, et al. AMF diversity analysis of lichen and moss biocrusts in Shapotou region (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(4): 986-994. [漆婧华, 刘玉冰, 李新荣, 等. 沙坡头地区地衣和藓类结皮丛枝菌根真菌多样性研究[J]. 土壤学报, 2020, 57(4): 986-994.]
(  0) 0) |
| [22] |
丛立双. 内蒙古荒漠生物结皮中细菌群落分析[D]. 呼和浩特: 内蒙古农业大学, 2010. Cong L S. Investigation of bacterial community structure in biological soil crusts of Inner Mongolia deserts[D]. Huhhot: Inner Mongolia Agricultural University, 2010. (  0) 0) |
| [23] |
Mummey D, Holben W, Six J, et al. Spatial stratification of soil bacterial populations in aggregates of diverse soils[J]. Microbial Ecology, 2006, 51(3): 404-411. DOI:10.1007/s00248-006-9020-5
(  0) 0) |
| [24] |
Zheng H, Wang X, Luo X X, et al. Biochar-induced negative carbon mineralization priming effects in a coastal wetland soil: Roles of soil aggregation and microbial modulation[J]. Science of the Tota l Environment, 2018, 610/611: 951-960. DOI:10.1016/j.scitotenv.2017.08.166
(  0) 0) |
| [25] |
Maier S, Tamm A, Wu D M, et al. Photoautotrophic organisms control microbial abundance, diversity, and physiology in different types of biological soil crusts[J]. The ISME Journal, 2018, 12(4): 1032-1046. DOI:10.1038/s41396-018-0062-8
(  0) 0) |
| [26] |
Chilton A M, Neilan B A, Eldridge D J. Biocrust morphology is linked to marked differences in microbial community composition[J]. Plant and Soil, 2018, 429(1/2): 65-75.
(  0) 0) |
| [27] |
Chamizo S, Cantón Y, Miralles I, et al. Biological soil crust development affects physicochemical characteristics of soil surface in semiarid ecosystems[J]. Soil Biology & Biochemistry, 2012, 49: 96-105.
(  0) 0) |
| [28] |
Zhang B C, Li R H, Xiao P, et al. Cyanobacterial composition and spatial distribution based on pyrosequencing data in the Gurbantunggut Desert, Northwestern China[J]. Journal of Basic Microbiology, 2016, 56(3): 308-320. DOI:10.1002/jobm.201500226
(  0) 0) |
| [29] |
Malam Issa O, Le Bissonnais Y, Défarge C, et al. Role of a cyanobacterial cover on structural stability of sandy soils in the Sahelian part of western Niger[J]. Geoderma, 2001, 101(3/4): 15-30.
(  0) 0) |
 2021, Vol. 58
2021, Vol. 58


