2. 华南理工大学环境与能源学院, 广州 510006
2. School of Environment and Energy, South China University of Technology, Guangzhou 510006, China
铁矿物是土壤氧化物中最为活跃的组分之一[1-2]。在不同环境条件下,铁矿物形态、价态、结构和表面特性的变化使其在环境污染物迁移和转化过程中扮演着极其重要的角色[3-4]。有机质作为土壤重要的组成之一,其在调节土壤健康、污染物行为和生物地球化学循环方面起着重要作用[5-7]。在各种不同类型的土壤中,有机质浓度通常与铁氧化物的含量有关,二者大多数以有机复合体的形式存在。在铁矿物转化过程中,环境中有机质的存在常对铁氧化物的溶解和重结晶以及晶体生长等过程起调控作用。通常,在受污染的土壤环境中,重金属的迁移和生物毒性取决于其形态,其一般受到土壤组分(如铁矿物和有机质)的影响。如图 1所示,土壤中铁矿物、有机质和重金属可通过物理包裹、吸附解吸、氧化还原、溶解沉淀、络合和共沉淀等一系列物理和化学方式发生相互作用[8-11]。例如:重金属或有机质可在土壤铁矿物表面发生吸附解吸和氧化还原反应;游离态的重金属又能和土壤有机质络合并重新吸附至铁矿物表面;在铁矿物发生还原、溶解和重结晶反应过程中,吸附在铁矿物表面或固定在铁矿物晶格内的重金属被重新分配。此外,微生物作为土壤的重要组成部分,不但能够直接还原土壤铁矿物[12-13],还能与重金属竞争铁矿物表面吸附位点并将矿物上解吸的重金属直接还原或氧化,同时微生物还能利用有机质作为电子穿梭体加速铁矿物还原[14],从而间接影响重金属的环境行为,这些耦合反应造成重金属在土壤多组分中的迁移转化与在单一土壤组分中显著不同。

|
图 1 土壤铁矿物转化及其界面有机质和重金属相互作用过程示意图 Fig. 1 Schematic illustration of the soil iron-bearing minerals transformation and mutual interaction process of interface organic matter and heavy metals |
弱结晶铁矿物转化为结晶铁矿物通常受到pH、温度和水化学条件等因素的影响[15],转化过程中出现的重金属离子和有机质均能减缓铁矿物的转化速率[16-18]。反之,铁矿物转化速率也能够影响污染物的生物地球化学循环和土壤有机质组分的变化[9-11]。已有的研究结果对铁矿物转化机制以及有机质或重金属和铁矿物的相互作用机制阐述得较为清楚,目前大多数研究的关注点主要集中在铁矿物-有机质-重金属甚至是实际土壤体系中各组分间的相互作用机制,而土壤铁矿物、有机质和重金属的相互作用常处于动态变化中,这使得预测土壤中重金属的环境行为面临巨大的挑战。此外,土壤中微生物的存在也能够加速铁矿物成分的变化[19],间接地影响土壤中重金属的形态和有机质的周转,这进一步增加了土壤铁矿物-有机质-重金属相互作用机制研究的难度。根据全国污染调查公报所示,我国土壤重金属污染形势严峻,其中城市、城郊和农村均存在不同程度的农田重金属污染问题[20],了解和认识重金属在土壤环境中的迁移转化规律能够对未来治理和修复重金属污染问题提供相应的理论依据和指导。鉴于我国目前的重金属污染涉及土壤多组分,有机质介导下土壤铁矿物的非生物转化和生物转化过程是影响重金属在土壤环境中迁移和转化的关键因素之一。因此,准确理解微尺度下铁矿物-有机质-重金属相互作用机制将有助于阐明重金属在土壤多组分界面反应的分子机制并预测土壤环境中重金属的归趋,这对未来推动我国重金属污染控制工作具有重要意义。本文就铁矿物转化机制以及重金属和有机质在铁矿物-水界面相互作用机制进行了系统的总结。
1 土壤铁矿物非生物和生物转化过程土壤环境中,结晶度较弱的水铁矿通常作为晶质铁矿物的前驱体[21],其一般可通过热脱水和脱羟基等方式最终转化为赤铁矿和磁赤铁矿。铁矿物间相互转化机制主要分为溶解再结晶或者直接固相转化[22]。溶解再结晶机制是弱晶质铁矿物先溶解,产生Fe(OH)2+和Fe(OH)2+等羟基铁离子,然后再通过聚合作用形成晶质铁氧化物;固相直接转化机制是弱晶质铁矿物通过脱水和结构重排直接转化为晶质铁氧化物。通常,弱晶质铁矿物的转化受反应温度和pH的影响。以水铁矿为例,一般地,老化时间越长和转化温度越高,转化产物的结晶度越好;当反应pH低于水铁矿零电荷点时,针铁矿的生成量随转化温度的降低而升高;当反应pH高于水铁矿零电荷点时,赤铁矿的生成量随转化温度的升高而升高;在室温反应条件下,强酸(pH < 3)或者弱碱性(pH=7~8)的环境有利于赤铁矿的生成,弱酸性(pH=3~6)和强碱性(pH=10~14)的环境有利于针铁矿的生成[15-23]。
目前,亚铁催化铁矿物发生相变的研究备受关注。在铁矿物转化过程中,亚铁的活性和浓度是决定亚铁催化铁矿物转化程度和路径的关键因素。当亚铁和弱晶质铁矿物共存时,亚铁能够催化结晶度较差和热力学不稳定的矿物发生转化,该转化机制是亚铁和弱晶质铁矿物表面发生电子转移,使得疏松多孔的弱晶质铁矿物发生溶解再结晶或者直接固相转化,从而生成其他晶质铁氧化物[9]。反应温度和反应pH的不同也会导致亚铁的形态不同,从而使得电子转移速率不同,最终导致转化产物差异较大[24-25]。有研究[26]发现,在反应pH较高的条件下,亚铁主要以Fe(OH)2+的形式存在,诱导并催化水铁矿直接固相转化;在反应pH接近中性条件下,亚铁主要以Fe(OH)+的形式存在,催化水铁矿溶解再结晶生成赤铁矿;一般情况下,Fe(OH)2+和Fe(OH)+同时存在于反应体系中,反应体系的pH和催化剂含量高低决定反应过程中何种机制起主导作用。
越来越多的研究表明,微生物介导下铁的地球化学循环过程极其重要,该过程广泛存在于湿地系统、沉积物、地球深处的含水层以及淹水水稻土等厌氧环境中,这是自然界铁代谢的重要途径之一[12]。铁循环过程大致可分为铁氧化和铁还原两大过程,其中微生物介导的铁氧化过程主要分为以下四个部分:(1)微生物利用氧气氧化亚铁[27]:在酸性条件下,氧化亚铁硫杆菌(Thiobacillus ferroxidans)可直接利用氧气对亚铁进行生物氧化;微氧的无机营养菌(如水类纤发菌属)可通过细胞外膜上的亚铁氧化蛋白将亚铁转变为难溶解的铁氧化物;微生物产生的氧气自由基(如O2·)可直接将三价铁还原成亚铁,该反应过程中氧气自由基介导的三价铁还原速率要高于亚铁被氧气氧化的速率[3];(2)厌氧光能自养铁氧化菌介导的亚铁氧化[3]:如绿菌属(Chlorobium ferrooxidans)和红假单胞菌属(Rhodopseudomonas palustris)可利用光对二氧化碳进行同化固定,反应过程中溶解态亚铁作为唯一电子供体,最终合成弱结晶的水铁矿或者结晶态较高的针铁矿;(3)微生物矿化[28]:厌氧-好氧界面存在的微好氧微生物(如湿地纤毛菌属)不但可以生物氧化亚铁形成磁铁矿,还能够影响环境中的矿物风化过程;(4)硝酸盐还原亚铁氧化[2]:在厌氧和中性条件下,硝酸盐还原菌可利用乙酸将硝酸根还原为亚硝酸根,产生的亚硝酸根进一步与游离态、吸附态和结晶态的亚铁(如菱铁矿和磁铁矿)直接发生还原反应,最终生成NO、N2O和N2。
微生物介导的铁还原过程包括以下五个部分:(1)分泌螯合剂促进铁矿物的溶解[29]:产甲烷菌能够利用H2或CO2还原绿脱石中的三价铁,从而促使矿物溶解;(2)通过细菌附属物的黏附和铁矿物直接发生相互作用[30]:地杆菌和希瓦氏菌的鞭毛和菌毛直接附着在铁矿物表面,形成传递电子的生物纳米导线,进而直接将电子传递给铁矿物;(3)细胞色素和铁还原酶参与的铁矿物还原[30]:希瓦氏菌外膜的C-型细胞色素(如MtrC和OmcA)和地杆菌的OmcE和OmcS均能介导胞外电子传递,这些物质的存在能够帮助电子从菌毛的末端传递至胞外的铁氧化物上,进而还原铁矿物;(4)微生物分泌具有氧化还原活性的电子穿梭体促使铁矿物还原[3,31]:在铁矿物含量较低的环境中,微生物可分泌具有氧化还原活性的电子穿梭体(如核黄素),使电子在微生物和铁矿物中传递,或者是直接将电子传递给环境中天然存在的电子穿梭体(如腐殖酸、醌类和抗生素),进而促使铁矿物还原[32];(5)通过微生物膜中的辅酶因子实现电子传递[3]:微生物形成的生物膜中存在氧化还原活性的辅酶因子,这些物质可在微生物胞外电子传递过程中实现电子的多步跃迁,这种传递方式有利于电子的长距离传输。尽管在过去的研究中,人们对微生物和铁矿物之间电子传递的关键机制有了一定的了解,但是仍然缺乏有效的模型用于定量描述微生物胞外电子传递机制。目前为止,土壤中胞外呼吸微生物的种类尚未完全鉴定,电子传递链相关界面的某些关键蛋白等电子载体的分子结构有待进一步解析,并且其对应的功能也亟待验证,影响铁矿物和微生物之间电子传递链中能量大小与形式发生显著变化的机制和关键节点也需要进一步阐明[33]。
在适当的条件下,周围环境的改变促使铁矿物发生相互转化。弱结晶的铁矿物(如水铁矿和纤铁矿)通过脱水、脱羟基、氧化还原、结构重排和重结晶等方式转化为其他结晶度较好的铁矿物[4]。在有氧环境中,赤铁矿和针铁矿在热力学上是自然界中最稳定的两种铁矿物,是许多其他铁矿物转化的最终产物。但是在实际土壤环境中,铁矿物的转化产物受到转化温度、pH、铁氧化物界面性质、亚铁离子、微生物、金属离子、土壤团聚体和有机质等多重因素的影响[9-10],使得铁矿物的转化机制较为复杂,而土壤铁矿物的相变势必会对与之相关的元素或物质循环和迁移产生一定的影响。因此,在分子水平上理解控制土壤和沉积物中铁元素和铁矿物循环的生物地球化学过程有助于深刻认识上述影响。
2 土壤有机物对铁矿物转化过程的影响机制植物根系分泌物(如有机酸、氨基酸、糖、蛋白质和酚类)也会直接或间接地影响土壤铁矿物的相变。例如:草酸作为土壤中含量最丰富的有机酸之一,对铁氧化物具有较强的络合作用,草酸的出现可促使针铁矿表面发生溶解[34],同时生成的三价铁能够和草酸发生络合,在光照条件下能够通过配体-金属离子直接电子转移作用还原三价铁,产生的二价铁能够进一步催化铁矿物发生转化[35]。此外,抗坏血酸作为植物根系分泌物中广泛存在的有机物之一,也能够促使铁矿物还原。Huang等[36]证实了抗坏血酸的加入对不同晶面赤铁矿还原速率的影响,结果表明(012)晶面和(001)晶面的赤铁矿分别能与抗坏血酸形成单齿和双齿络合物,且(012)晶面赤铁矿的铁还原速率更高。同时,反应过程产生的亚铁会引起分子氧活化,进一步促使铁矿物发生转化[37]。Sheng等[38]通过研究发现,柠檬酸也能够显著影响亚铁催化水铁矿的转化产物类型和含量,随着柠檬酸含量逐渐升高,水铁矿转化速率降低,且产物中针铁矿含量降低,纤铁矿含量逐渐升高。根系分泌物除了能够促进铁矿物的还原溶解之外,吸附在铁矿物表面的根系分泌物还能够阻隔亚铁和微生物及铁矿物的接触,进而阻断电子传递,减缓铁矿物的还原溶解过程。同时,根系分泌物也能抑制晶体生长或铁矿物纳米颗粒的聚集。Li等[39]证实了随着草酸和水铁矿的摩尔比例逐渐增加,二者之间的结合方式从初始的双齿双核转变为双齿单核,从而阻碍水铁矿的成核生长。因此,植物根系中分泌的有机化合物能够促进或抑制铁氧化物的聚集、吸附、还原、成核和溶解等过程,但是可能存在的机理仍然有待深入阐述。
有机质(如富里酸、胡敏酸和胡敏素)作为土壤中有机物的重要组成部分,可通过物理保护和化学保护作用被土壤团聚体固定,从而形成有机-无机复合体。通常,有机质可通过静电引力、配位交换、范德华力、阳离子键桥、疏水作用和氢键等方式与土壤团聚体中的铁矿物相互作用[7,40],通过化学作用被固持的这部分有机碳主要吸附在土壤团聚体颗粒表面,铁矿物和黏土矿物在该过程起主要作用。通常稳定性高的团聚体中的铁氧化物能通过络合作用固定更多的有机碳,吸附在土壤团聚体表面的有机碳也可进一步充当配位体来促成大团聚体的形成,增强了土壤团聚体的张力强度,提高了自身的稳定性,从而抑制了团聚体中无定形态铁矿物的非生物和生物转化[41-43]。此外,与铁矿物结合的有机碳的性质、种类和含量也会显著影响土壤团聚体中铁氧化物的转化,ThomasArrigo等[44-45]通过室内转化实验发现,水铁矿的转化速率随着添加的有机质含量的升高而降低,且其转化速率与吸附在水铁矿表面的有机质羧基含量有关,羧基含量越高,水铁矿转化速率越快。Chen等[46]通过亚铁催化水铁矿-有机质的共沉淀转化实验发现,有机质添加量与水铁矿的转化速率呈反比,且当有机碳和铁的摩尔比大于2.8时,水铁矿表面吸附位点被有机质完全占据,进而阻碍了亚铁和水铁矿之间的电子传递过程。此外,吸附在水铁矿表面的有机质还会阻碍铁氧化物溶解,从而抑制水铁矿的转化。有机质的加入还能够与亚铁直接络合,降低铁矿物在溶解和再结晶过程中亚铁和三价铁电子转移的速率,有机质所含芳香族官能团能直接吸附在铁氧化物上,阻碍水铁矿或纤铁矿成核作用[47-48]。
目前,有机质的电子接收和传递能力逐渐成为国内外的研究热点[12]。在实际厌氧的土壤环境中,相比于铁矿物,铁还原微生物更容易与土壤有机质接触,有机质中含有的醌基官能团能够充当电子穿梭体,弥补微生物和铁矿物之间由于距离原因而导致的铁还原反应过程受阻,因此,有机质的加入能够改变微生物还原铁矿物的速率和程度[12],同时反应过程中产生的亚铁还能促使铁矿物发生转化[19]。目前大多数研究主要集中在有机质具体如何影响铁矿物的表面反应以及相互作用动力学,而在多组分土壤体系中,有机质和铁矿物的反应是一个动态过程,通常是多种结合机制同时存在并交互作用,这些反应过程会显著影响有机质对土壤重金属的络合[49]。阐明有机质和土壤铁矿物相互作用对理解土壤铁矿物的转化、准确预测土壤碳库和全球气候变化以及土壤重金属环境行为至关重要。
3 土壤铁矿物界面重金属反应机制重金属在铁矿物-水界面上的吸附作用可分为非专性吸附和专性吸附。通常,铁矿物具有较高活性的表面点位,与之共存的重金属能够被铁矿物吸附,这使得铁矿物在固定土壤重金属方面起着关键作用。有研究表明,土壤铁矿物能够有效地去除环境中的砷、铀和铬等高毒性重金属[50-52]。近几年,高分辨光谱和电子显微镜技术的发展极大地促进了重金属在环境中迁移和转化机制的研究[9]。其中,应用较为广泛的是利用同步辐射技术从分子水平阐明重金属和铁矿物的微观结合机制[53-54]。夏星和杨建军[53]阐明了同步辐射技术和扫描透射X射线显微技术能够揭示多重因素影响下模拟系统和实际土壤系统中铁氧化物固定重金属的分子机制。此外,球差校正电子显微技术的发展使得能够从原子尺度阐明铁矿物和重金属的微观反应机制,直观地呈现吸附在铁矿物表面和铁矿物晶格内部重金属的分布[11]。
铁矿物转化作为土壤中最为活跃的生物地球化学过程之一,该反应通常也会影响表面结合的金属或类金属等元素的环境效应。当铁矿物发生转化时,与之共存的重金属会在铁矿物表面发生吸附解吸、氧化还原、共沉淀和掺杂等一系列反应,进而控制着土壤变价元素(如铬和砷)和稳定价态金属(如锌、铜和铅)的环境行为[55-58]。研究[9-10]发现,在水铁矿转化过程中,溶液中存在的铅或砷掺杂进入新形成的赤铁矿或纤铁矿晶格内部;当初始矿物为热力学更加稳定的赤铁矿或针铁矿时,反应过程中出现的二价铁不能催化其转化为其他二次矿物,但是却能在原始的赤铁矿或针铁矿颗粒上观察到该铁矿物的重新生长,导致与之共存的重金属也能够掺杂进入赤铁矿或针铁矿晶格内部[57-58]。同时,亚铁与铁矿物形成的氧化还原电势差能够直接将五价砷还原为三价砷[59]。此外,土壤中铁还原菌的存在也能够显著影响环境中重金属的命运。研究[60]发现,希瓦氏菌MR-1能够将弱晶质铁矿物还原为二价铁,生成的二价铁进一步催化铁矿物发生重结晶,与之共存的类金属砷能掺杂至磁铁矿或蓝铁矿晶格内部;相反地,还有研究[61]发现,在希瓦氏菌-水铁矿-五价砷的反应体系中,细菌不但能够直接还原铁矿物,使得吸附在铁矿物表面的五价砷释放进入溶液中,还能够将溶液中五价砷还原为三价砷,增大砷的生物有效性和毒性。在含有铁氧化菌的反应体系中,三价砷和五价砷均能与亚铁氧化形成的纤铁矿以络合物的形式结合,并且纤铁矿对三价砷的固定作用要强于五价砷[62]。总体而言,已有的研究结果表明,铁矿物转化会显著影响重金属的形态分布,进而影响其在土壤中的迁移与转化。目前重金属和铁矿物相互作用的研究主要集中在表面络合、吸附解吸和氧化还原等方面,这些研究通常集中于单个反应过程,缺乏对环境中多组份动态耦合反应过程的理解。因此,在未来的研究中应考虑各环境要素间的相互作用,特别是生物和非生物之间的相互作用对重金属环境行为的影响,这可能为未来降低水稻土中重金属的有效性提供重要的理论指导作用[63]。
4 土壤铁矿物-有机质相互作用下的重金属反应机制铁矿物转化(水解、成核、沉淀和重结晶)使得与之相关联的重金属和有机质释放进入溶液中或通过物理包裹和共沉淀作用被重新固定[64-65]。由于溶解性有机质广泛存在于沉积物和土壤环境中,通常在自然界中铁矿物和有机质会以有机质-矿物复合体的形式存在,这使得重金属在土壤环境中的作用机制较为复杂[66-67],造成该现象的主要原因可能是:(1)吸附在矿物表面的有机质通过配体交换和螯合等方式使得重金属更加牢固地吸附在矿物上[7],进一步抑制了重金属在环境中的迁移;赵转军等[68]阐述了土壤中有机质能够显著改变铁矿物的表面性质,增强其吸附性能,铁矿物-有机质形成的共沉淀的优良吸附性可能为将来土壤污染场地重金属的治理和修复提供新思路。(2)有机质与原本吸附在矿物上的重金属竞争矿物表面的吸附位点,减弱了重金属与矿物的吸附作用,同时有机质还能作为电子穿梭体,加速铁矿物还原溶解,进一步增加了重金属的迁移和生物可利用性。Qiao等[64-65]通过微宇宙培养实验发现在受砷污染的土壤中添加天然有机质(如富里酸、胡敏酸和胡敏素)和生物质炭均能促进铁还原,增加溶液中砷的浓度。由此可知,反应体系中有机质的出现对铁矿物的转化和重金属的迁移具有显著的影响。此外,在亚铁催化铁矿物转化过程中,当溶液中存在腐殖酸时,亚铁容易与腐殖酸结合形成络合物,从而降低铁矿物的转化速率[9],进而影响与之共存的重金属的铬[66-67]和锌[69]的迁移转化。Lu等[11,70]通过球差校正显微镜等手段系统地研究了水铁矿-有机质-重金属反应体系中,有机碳及重金属铜和铅的环境行为。研究[11]发现,胡敏酸的加入能够减缓水铁矿的转化速率,促使转化产物含有更多疏松多孔的结构,进而增加对重金属铅和有机质的固定(图 2)。综上所述,有机质的存在会一定程度地影响铁矿物转化,从而促进或者抑制铁矿物对重金属的固定。
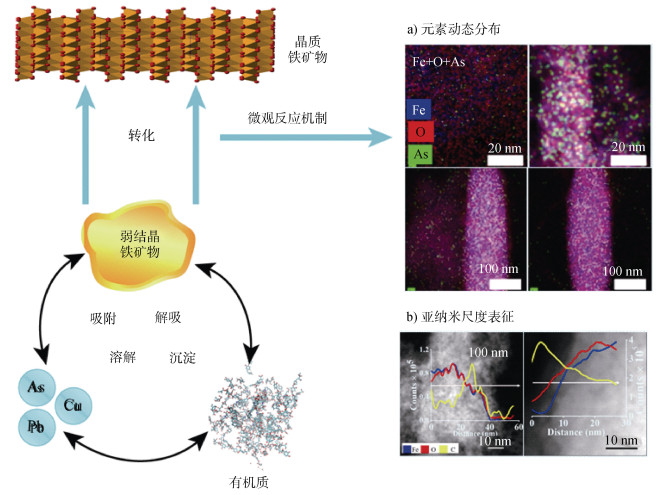
|
注:图中元素的能量色散谱图和能量损失谱图源自Hu等[10]。 Note:The elemental energy-dispersive X-ray spectroscopy(EDS)mapping and electron energy loss spectroscopy(EELS)line scans were adapted with permission from Hu et al.[10]. Copyright 2018 American Chemical Society. 图 2 铁矿物、有机质和重金属耦合反应及微观观测手段 Fig. 2 Coupled reactions of Fe oxides, organic matter, and heavy metals and microscopic characterization approach |
由于土壤类型多样,反应条件过于复杂,导致很难评估重金属的环境行为,因此,为了准确预测重金属在土壤中的形态分布以及动力学行为,不同类型的模型(如德米尔腐殖质水模型、电荷分布-多位点表面络合模型、配体电荷分布模型、Stockholm腐殖质模型和非理想竞争性吸附模型)被发展起来,用以帮助了解土壤中重金属的迁移和转化规律[71]。Peng等[72]基于平衡模型和电荷分布-多位点表面络合模型,建立了土壤重金属吸附解吸动力学统一模型,该模型将重金属与有机质和土壤铁矿物多点位的反应考虑进去,用于准确预测土壤中重金属镉、铜、镍、铅和锌在不同pH条件下的吸附解吸动力学行为。Xiong等[73]利用配体电荷分布模型和同步辐射光谱阐明了重金属铅在针铁矿和富里酸或胡敏酸上的形态分布,结果表明pH会影响胡敏酸和铅的结合,但是对富里酸的影响是恒定的。同时,增加有机质浓度,能够增加其对铅的络合,减少针铁矿对铅的吸附。值得注意的是,虽然这些已发表的研究[74-77]对重金属形态的预测结果令人满意,但这些模型未考虑矿物-有机质界面反应以及三元络合物的形成和微生物存在情况下对重金属形态变化的影响。基于上述考虑,Hu等[10]研究了在铁矿物-重金属-有机质反应体系中,铁矿物转化过程中砷和有机质的命运,发展的耦合定量模型可用于预测砷在不同铁矿物上的分布及其由铁矿物表面的释放动力学;近期,Lin等[50]基于微生物能够竞争铁矿物表面的吸附位点,诱导砷发生解吸这一理论,发展了一个耦合定量模型,用于预测微生物介导的砷还原和不同形态砷在铁氧化物上的非线性吸附和解吸动力学。以上模型的发展可为将来预测实际土壤铁矿物-有机质-微生物共存体系中重金属的迁移和生物可利用性提供理论基础和指导。
5 展望尽管目前基于铁矿物、有机质和微生物之间的相互作用机制,在土-水界面调控重金属的迁移与转化方面已经取得了一些较好的结果,但土壤是一个复杂的多相体系,已有的研究对微观机制的揭示尚存在诸多不足。未来的研究应将环境科学、环境化学、土壤学和生物学以及地质学等多学科进行融合与交叉,大力发展新兴和原位监测技术,将微观与宏观相结合,侧重于量化和原位监测,全面阐述土壤中矿物-有机质-微生物相互作用对重金属环境行为影响的生物-化学耦合过程与机制,需要着重从以下几个方向开展后续的研究。
(1)铁矿物、有机质和微生物相互作用影响下土壤重金属环境行为的分子机制。微生物或微生物代谢活动产生的活性分子(如胞外聚合物)对土壤铁矿物和有机质界面上重金属形态变化具有深刻的影响,因此,开展铁矿物-有机质-微生物相互作用影响下重金属转化机制的研究非常必要,未来研究的关注点可包括:实际环境中痕量或超痕量重金属元素的快速检测、有机质分子组分的精确解析、矿物表面性质的表征、土壤中氧化还原活性物质(如腐殖质和胞外聚合物)化学和电化学特性的表征以及微生物、铁矿物和有机质在土壤界面重金属吸附解吸过程中的贡献等。
(2)原子和分子水平上土壤界面反应过程和机制。近年来,现代化学、物理学和生物学技术的空间分辨力与灵敏度的提高,允许在细胞水平、分子水平甚至是原子水平揭示微生物介导下矿物、有机质和重金属微观反应机制,从而为在更微观尺度上解读重金属的命运提供更加深刻的理解。例如:同步辐射光谱学[53-54]和成像技术[70]的发展能够在分子尺度甚至是纳米尺度阐明微界面反应机制。此外,各种原位电化学[78]和分子探针技术的兴起,可直接用于观测众多氧化还原反应。未来应该将常规的电化学、生物化学、分子生物学和物理化学等各学科的研究方法和现代先进的仪器技术(如高精度微量热技术、同步辐射X射线近边和扩展边吸收光谱、纳米二次离子质谱以及基于高通量测序的蛋白组学和宏基因组学等)相结合,多重技术联用对矿物、有机质、微生物相互作用调控下的土壤重金属界面反应进行热力学和动力学表征以及对重金属形态的鉴定等。
(3)微尺度上土-水界面反应过程的原位动态监测方法和技术的研发。目前发展的诸多常规分析表征技术,运用到实际场地的微观尺度研究中面临诸多困难,亟待开发出适用于土壤矿物、有机质和微生物互作界面上重金属归趋的原位观测技术和研究方法[79]。
(4)模拟复杂的生物地球化学反应以及发展耦合动力学模型。在获取详细的热力学和动力学数据的基础上建立模型,获得必要的反应参数用以评估每个反应过程的相对贡献。然而,非生物和生物反应的耦合过程非常复杂,如果要将实验室获得的知识应用于实际污染场地修复技术的设计和性能评估,就必须扩大微尺度工艺和调整反应参数。目前的难点是在实验室得到详细反应机制的认知后,如何用于在现场尺度规模上发展定量模型去描述重金属的归趋[80]。
| [1] |
Kappler A, Schink B, Newman D K. Fe(Ⅲ) mineral formation and cell encrustation by the nitrate-dependent Fe(Ⅱ)-oxidizer strain BoFeN1[J]. Geobiology, 2005, 3(4): 235-245. DOI:10.1111/j.1472-4669.2006.00056.x
(  0) 0) |
| [2] |
Liu T X, Chen D D, Luo X B, et al. Microbially mediated nitrate-reducing Fe(Ⅱ) oxidation: Quantification of chemodenitrification and biological reactions[J]. Geochimica et Cosmochimica Acta, 2019, 256: 97-115. DOI:10.1016/j.gca.2018.06.040
(  0) 0) |
| [3] |
Melton E D, Swanner E D, Behrens S, et al. The interplay of microbially mediated and abiotic reactions in the biogeochemical Fe cycle[J]. Nature Reviews Microbiology, 2014, 12(12): 797-808. DOI:10.1038/nrmicro3347
(  0) 0) |
| [4] |
Schwertmann U, Cornell R M. Iron oxides in the laboratory: Preparation and characterization . New Jersey: Wiley, 2008.
(  0) 0) |
| [5] |
Lavallee J M, Soong J L, Cotrufo M F. Conceptualizing soil organic matter into particulate and mineral-associated forms to address global change in the 21st century[J]. Global Change Biology, 2020, 26(1): 261-273. DOI:10.1111/gcb.14859
(  0) 0) |
| [6] |
Shi Z Q, Wang P, Peng L F, et al. Kinetics of heavy metal dissociation from natural organic matter: Roles of the carboxylic and phenolic sites[J]. Environmental Science & Technology, 2016, 50(19): 10476-10484.
(  0) 0) |
| [7] |
Vindedahl A M, Strehlau J H, Arnold W A, et al. Organic matter and iron oxide nanoparticles: Aggregation, interactions, and reactivity[J]. Environmental Science: Nano, 2016, 3(3): 494-505. DOI:10.1039/C5EN00215J
(  0) 0) |
| [8] |
Han L F, Sun K, Keiluweit M, et al. Mobilization of ferrihydrite-associated organic carbon during Fe reduction: Adsorption versus coprecipitation[J]. Chemical Geology, 2019, 503: 61-68. DOI:10.1016/j.chemgeo.2018.10.028
(  0) 0) |
| [9] |
Hu S W, Liang Y Z, Liu T X, et al. Kinetics of As(Ⅴ) and carbon sequestration during Fe(Ⅱ)-induced transformation of ferrihydrite-As(Ⅴ)-fulvic acid coprecipitates[J]. Geochimica et Cosmochimica Acta, 2020, 272: 160-176. DOI:10.1016/j.gca.2020.01.002
(  0) 0) |
| [10] |
Hu S W, Lu Y, Peng L F, et al. Coupled kinetics of ferrihydrite transformation and As(Ⅴ) sequestration under the effect of humic acids: A mechanistic and quantitative study[J]. Environmental Science & Technology, 2018, 52(20): 11632-11641.
(  0) 0) |
| [11] |
Lu Y, Hu S W, Wang Z M, et al. Ferrihydrite transformation under the impact of humic acid and Pb: Kinetics, nanoscale mechanisms, and implications for C and Pb dynamics[J]. Environmental Science: Nano, 2019, 6(3): 747-762. DOI:10.1039/C8EN01327F
(  0) 0) |
| [12] |
Shi L, Dong H L, Reguera G, et al. Extracellular electron transfer mechanisms between microorganisms and minerals[J]. Nature Reviews Microbiology, 2016, 14(10): 651-662. DOI:10.1038/nrmicro.2016.93
(  0) 0) |
| [13] |
Weber K A, Achenbach L A, Coates J D. Microorganisms pumping iron: Anaerobic microbial iron oxidation and reduction[J]. Nature Reviews Microbiology, 2006, 4(10): 752-764. DOI:10.1038/nrmicro1490
(  0) 0) |
| [14] |
Bai Y G, Mellage A, Cirpka O A, et al. AQDS and redox-active NOM enables microbial Fe(Ⅲ)-mineral reduction at cm-scales[J]. Environmental Science & Technology, 2020, 54(7): 4131-4139.
(  0) 0) |
| [15] |
Das S, Hendry M J, Essilfie-Dughan J. Transformation of two-line ferrihydrite to goethite and hematite as a function of pH and temperature[J]. Environmental Science & Technology, 2011, 45(1): 268-275.
(  0) 0) |
| [16] |
Han X H, Tomaszewski E J, Sorwat J, et al. Effect of microbial biomass and humic acids on abiotic and biotic magnetite formation[J]. Environmental Science & Technology, 2020, 54(7): 4121-4130.
(  0) 0) |
| [17] |
Park S, Lee J H, Shin T J, et al. Adsorption and incorporation of arsenic to biogenic lepidocrocite formed in the presence of ferrous iron during denitrification by Paracoccus denitrificans[J]. Environmental Science & Technology, 2018, 52(17): 9983-9991.
(  0) 0) |
| [18] |
Shi Z Q, Hu S W, Lin J Y, et al. Quantifying microbially mediated kinetics of ferrihydrite transformation and arsenic reduction: Role of the arsenate-reducing gene expression pattern[J]. Environmental Science & Technology, 2020, 54(11): 6621-6631.
(  0) 0) |
| [19] |
Aeppli M, Vranic S, Kaegi R, et al. Decreases in iron oxide reducibility during microbial reductive dissolution and transformation of ferrihydrite[J]. Environmental Science & Technology, 2019, 53(15): 8736-8746.
(  0) 0) |
| [20] |
环境保护部, 国土资源部. 全国土壤污染状况调查公报[R/OL]. 2014[2020-10-30]. http://websearch.mep.gov.cn/was40/search. Ministry of Environmental Protection of the People's Republic of China, Ministry of Land and Resources of the People's Republic of China. National survey of soil pollution status[R/OL]. 2014[2020-10-30]. http://websearch.mep.gov.cn/was40/search. (  0) 0) |
| [21] |
Wang X M, Yang K G, Sun S F, et al. The structure and composition of ferrihydrite and its environmental geochemical behaviors (In Chinese)[J]. Earth Science Frontiers, 2011, 18(2): 339-347. [王小明, 杨凯光, 孙世发, 等. 水铁矿的结构、组成及环境地球化学行为[J]. 地学前缘, 2011, 18(2): 339-347.]
(  0) 0) |
| [22] |
Hansel C M, Benner S G, Fendorf S. Competing Fe(Ⅱ)-induced mineralization pathways of ferrihydrite[J]. Environmental Science & Technology, 2005, 39(18): 7147-7153.
(  0) 0) |
| [23] |
Radha A V, Navrotsky A. Manganese carbonate formation from amorphous and nanocrystalline precursors: Thermodynamics and geochemical relevance[J]. American Mineralogist, 2014, 99(5/6): 1063-1070.
(  0) 0) |
| [24] |
Handler R M, Frierdich A J, Johnson C M, et al. Fe(Ⅱ)-catalyzed recrystallization of goethite revisited[J]. Environmental Science & Technology, 2014, 48(19): 11302-11311.
(  0) 0) |
| [25] |
Latta D E, Bachman J E, Scherer M M. Fe electron transfer and atom exchange in goethite: Influence of Al-substitution and anion sorption[J]. Environmental Science & Technology, 2012, 46(19): 10614-10623.
(  0) 0) |
| [26] |
Majzlan J. Thermodynamic stabilization of Hydrous ferric oxide by adsorption of phosphate and arsenate[J]. Environmental Science & Technology, 2011, 45(11): 4726-4732.
(  0) 0) |
| [27] |
Bryce C, Blackwell N, Schmidt C, et al. Microbial anaerobic Fe(Ⅱ) oxidation-Ecology, mechanisms and environmental implications[J]. Environmental Microbiology, 2018, 20(10): 3462-3483. DOI:10.1111/1462-2920.14328
(  0) 0) |
| [28] |
Edwards K J, Rogers D R, Wirsen C O, et al. Isolation and characterization of novel psychrophilic, neutrophilic, Fe-oxidizing, chemolithoautotrophic alpha-and gamma-proteobacteria from the deep sea[J]. Applied and Environmental Microbiology, 2003, 69(5): 2906-2913. DOI:10.1128/AEM.69.5.2906-2913.2003
(  0) 0) |
| [29] |
Liu D, Yu N, Papineau D, et al. The catalytic role of planktonic aerobic heterotrophic bacteria in protodolomite formation: Results from Lake Jibuhulangtu Nuur, Inner Mongolia, China[J]. Geochimica et Cosmochimica Acta, 2019, 263: 31-49. DOI:10.1016/j.gca.2019.07.056
(  0) 0) |
| [30] |
Gacitúa M A, González B, Majone M, et al. Boosting the electrocatalytic activity of Desulfovibrio paquesii biocathodes with magnetite nanoparticles[J]. International Journal of Hydrogen Energy, 2014, 39(27): 14540-14545. DOI:10.1016/j.ijhydene.2014.07.057
(  0) 0) |
| [31] |
Liu T X, Luo X B, Wu Y D, et al. Extracellular electron shuttling mediated by soluble c-type cytochromes produced by Shewanella oneidensis MR-1[J]. Environmental Science & Technology, 2020, 54(17): 10577-10587.
(  0) 0) |
| [32] |
Hu S W, Wu Y D, Shi Z Q, et al. Quinone-mediated dissimilatory iron reduction of hematite: Interfacial reactions on exposed {001} and {100} facets[J]. Journal of Colloid and Interface Science, 2021, 583: 544-552. DOI:10.1016/j.jcis.2020.09.074
(  0) 0) |
| [33] |
Jia H N, Li Y, Li Y Z, et al. Mineral electronic energy cooperates with microbial extracellular electron transfer and growth metabolism (In Chinese)[J]. Acta Microbiologica Sinica, 2020, 60(9): 2084-2105. [贾昊凝, 李艳, 黎晏彰, 等. 矿物电子能量协同微生物胞外电子传递与生长代谢[J]. 微生物学报, 2020, 60(9): 2084-2105.]
(  0) 0) |
| [34] |
Kubicki J D, Tunega D, Kraemer S. A density functional theory investigation of oxalate and Fe(Ⅱ) adsorption onto the(010) goethite surface with implications for ligand-and reduction-promoted dissolution[J]. Chemical Geology, 2017, 464: 14-22. DOI:10.1016/j.chemgeo.2016.08.010
(  0) 0) |
| [35] |
Lueder U, Jørgensen B B, Kappler A, et al. Photochemistry of iron in aquatic environments[J]. Environmental Science: Processes & Impacts, 2020, 22(1): 12-24.
(  0) 0) |
| [36] |
Huang X P, Hou X J, Song F H, et al. Ascorbate induced facet dependent reductive dissolution of hematite nanocrystals[J]. The Journal of Physical Chemistry C, 2017, 121(2): 1113-1121. DOI:10.1021/acs.jpcc.6b09281
(  0) 0) |
| [37] |
Hou X J, Shen W J, Huang X P, et al. Ascorbic acid enhanced activation of oxygen by ferrous iron: A case of aerobic degradation of rhodamine B[J]. Journal of Hazardous Materials, 2016, 308: 67-74. DOI:10.1016/j.jhazmat.2016.01.031
(  0) 0) |
| [38] |
Sheng A X, Li X X, Arai Y, et al. Citrate controls Fe(Ⅱ)-catalyzed transformation of ferrihydrite by complexation of the labile Fe(Ⅲ) intermediate[J]. Environmental Science & Technology, 2020, 54(12): 7309-7319.
(  0) 0) |
| [39] |
Li F Y, Koopal L, Tan W F. Roles of different types of oxalate surface complexes in dissolution process of ferrihydrite aggregates[J]. Scientific Reports, 2018, 8(1): 2060. DOI:10.1038/s41598-018-20401-5
(  0) 0) |
| [40] |
Wang J K, Xu Y D, Ding F, et al. Process of plant residue transforming into soil organic matter and mechanism of its stabilization: A review (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(3): 528-540. [汪景宽, 徐英德, 丁凡, 等. 植物残体向土壤有机质转化过程及其稳定机制的研究进展[J]. 土壤学报, 2019, 56(3): 528-540.]
(  0) 0) |
| [41] |
Mao X L, Lu K P, He L Z, et al. Effect of long-term fertilizer application on distribution of aggregates and aggregate-associated organic carbon in paddy soil (In Chinese)[J]. Acta Pedologica Sinica, 2015, 52(4): 828-838. [毛霞丽, 陆扣萍, 何丽芝, 等. 长期施肥对浙江稻田土壤团聚体及其有机碳分布的影响[J]. 土壤学报, 2015, 52(4): 828-838.]
(  0) 0) |
| [42] |
Wang L Y, Qin L, Lü X G, et al. Progress in researches on effect of iron promoting accumulation of soil organic carbon (In Chinese)[J]. Acta Pedologica Sinica, 2018, 55(5): 1041-1050. [王璐莹, 秦雷, 吕宪国, 等. 铁促进土壤有机碳累积作用研究进展[J]. 土壤学报, 2018, 55(5): 1041-1050.]
(  0) 0) |
| [43] |
Xu J H, Sun Y, Gao L, et al. A review of the factors influencing soil organic carbon stability (In Chinese)[J]. Chinese Journal of Eco-Agriculture, 2018, 26(2): 222-230. [徐嘉晖, 孙颖, 高雷, 等. 土壤有机碳稳定性影响因素的研究进展[J]. 中国生态农业学报, 2018, 26(2): 222-230.]
(  0) 0) |
| [44] |
ThomasArrigo L K, Byrne J M, Kappler A, et al. Impact of organic matter on iron(Ⅱ)-catalyzed mineral transformations in ferrihydrite-organic matter coprecipitates[J]. Environmental Science & Technology, 2018, 52(21): 12316-12326.
(  0) 0) |
| [45] |
ThomasArrigo L K, Kaegi R, Kretzschmar R. Ferrihydrite growth and transformation in the presence of ferrous iron and model organic ligands[J]. Environmental Science & Technology, 2019, 53(23): 13636-13647.
(  0) 0) |
| [46] |
Chen C M, Kukkadapu R, Sparks D L. Influence of coprecipitated organic matter on Fe2+(aq)-catalyzed transformation of ferrihydrite: Implications for carbon dynamics[J]. Environmental Science & Technology, 2015, 49(18): 10927-10936.
(  0) 0) |
| [47] |
Chen C M, Sparks D L. Fe(Ⅱ)-induced mineral transformation of ferrihydrite-organic matter adsorption and Co-precipitation complexes in the absence and presence of as(Ⅲ)[J]. ACS Earth and Space Chemistry, 2018, 2(11): 1095-1101. DOI:10.1021/acsearthspacechem.8b00041
(  0) 0) |
| [48] |
Xiao W, Jones A M, Li X M, et al. Effect of Shewanella oneidensis on the kinetics of Fe(Ⅱ)-catalyzed transformation of ferrihydrite to crystalline iron oxides[J]. Environmental Science & Technology, 2018, 52(1): 114-123.
(  0) 0) |
| [49] |
Ding Y, Lu Y, Liao P, et al. Molecular fractionation and sub-nanoscale distribution of dissolved organic matter on allophane[J]. Environmental Science: Nano, 2019, 6(7): 2037-2048. DOI:10.1039/C9EN00335E
(  0) 0) |
| [50] |
Lin J Y, Hu S W, Liu T X, et al. Coupled kinetics model for microbially mediated arsenic reduction and adsorption/desorption on iron oxides: Role of arsenic desorption induced by microbes[J]. Environmental Science & Technology, 2019, 53(15): 8892-8902.
(  0) 0) |
| [51] |
Pan C, Troyer L D, Liao P, et al. Effect of humic acid on the removal of chromium(Ⅵ) and the production of solids in iron electrocoagulation[J]. Environmental Science & Technology, 2017, 51(11): 6308-6318.
(  0) 0) |
| [52] |
Shi Z Q, Hu S W, Lin J Y, et al. Quantifying microbially mediated kinetics of ferrihydrite transformation and arsenic reduction: Role of the arsenate-reducing gene expression pattern[J]. Environmental Science & Technology, 2020, 54(11): 6621-6631.
(  0) 0) |
| [53] |
Xia X, Yang J J. Molecular sequestration mechanisms of heavy metals by iron oxides in soils using synchrotron-based techniques: A review (In Chinese)[J]. Chinese Journal of Applied Ecology, 2019, 30(1): 348-358. [夏星, 杨建军. 基于同步辐射技术研究土壤铁氧化物固定重金属分子机制的进展[J]. 应用生态学报, 2019, 30(1): 348-358.]
(  0) 0) |
| [54] |
Yang J J, Wang Y H, Wang J, et al. Microscale soil chemistry of heavy metals: Research process and perspective (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(3): 530-539. [杨建军, 王艺皓, Wang Jian, 等. 微尺度重金属土壤化学研究进展与展望[J]. 土壤学报, 2020, 57(3): 530-539.]
(  0) 0) |
| [55] |
Frierdich A J, Catalano J G. Controls on Fe(Ⅱ)-activated trace element release from goethite and hematite[J]. Environmental Science & Technology, 2012, 46(3): 1519-1526.
(  0) 0) |
| [56] |
Frierdich A J, Luo Y, Catalano J G. Trace element cycling through iron oxide minerals during redox-driven dynamic recrystallization[J]. Geology, 2011, 39(11): 1083-1086. DOI:10.1130/G32330.1
(  0) 0) |
| [57] |
Frierdich A J, McBride A, Tomkinson S, et al. Nickel cycling and negative feedback on Fe(Ⅱ)-catalyzed recrystallization of goethite[J]. ACS Earth and Space Chemistry, 2019, 3(9): 1932-1941. DOI:10.1021/acsearthspacechem.9b00137
(  0) 0) |
| [58] |
Frierdich A J, Scherer M M, Bachman J E, et al. Inhibition of trace element release during Fe(Ⅱ)-activated recrystallization of Al-, Cr-, and Sn-substituted goethite and hematite[J]. Environmental Science & Technology, 2012, 46(18): 10031-10039.
(  0) 0) |
| [59] |
Amstaetter K, Borch T, Larese-Casanova P, et al. Redox transformation of arsenic by Fe(Ⅱ)-activated goethite(α-FeOOH)[J]. Environmental Science & Technology, 2010, 44(1): 102-108.
(  0) 0) |
| [60] |
Sun J, Chillrud S N, Mailloux B J, et al. In situ magnetite formation and long-term arsenic immobilization under advective flow conditions[J]. Environmental Science & Technology, 2016, 50(18): 10162-10171.
(  0) 0) |
| [61] |
Huang J H. Characterising microbial reduction of arsenate sorbed to ferrihydrite and its concurrence with iron reduction[J]. Chemosphere, 2018, 194: 49-56. DOI:10.1016/j.chemosphere.2017.11.109
(  0) 0) |
| [62] |
Xiu W, Guo H M, Shen J X, et al. Stimulation of Fe(Ⅱ) oxidation, biogenic lepidocrocite formation, and arsenic immobilization by Pseudogulbenkiania sp. strain 2002[J]. Environmental Science & Technology, 2016, 50(12): 6449-6458.
(  0) 0) |
| [63] |
Shen R F, Yan X Y, Zhang G L, et al. Status quo of and strategic thinking for the development of soil science in China in the new era (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(5): 1051-1059. [沈仁芳, 颜晓元, 张甘霖, 等. 新时期中国土壤科学发展现状与战略思考[J]. 土壤学报, 2020, 57(5): 1051-1059.]
(  0) 0) |
| [64] |
Qiao J T, Li X M, Hu M, et al. Transcriptional activity of arsenic-reducing bacteria and genes regulated by lactate and biochar during arsenic transformation in flooded paddy soil[J]. Environmental Science & Technology, 2018, 52(1): 61-70.
(  0) 0) |
| [65] |
Qiao J T, Li X M, Li F B, et al. Humic substances facilitate arsenic reduction and release in flooded paddy soil[J]. Environmental Science & Technology, 2019, 53(9): 5034-5042.
(  0) 0) |
| [66] |
Xia X, Yang J J, Yan Y B, et al. Molecular sorption mechanisms of Cr(Ⅲ) to organo-ferrihydrite coprecipitates using synchrotron-based EXAFS and STXM techniques[J]. Environmental Science & Technology, 2020, 54(20): 12989-12997.
(  0) 0) |
| [67] |
Yang J J, Xia X, Liu J, et al. Molecular mechanisms of chromium(Ⅲ) immobilization by organo-ferrihydrite Co-precipitates: The significant roles of ferrihydrite and carboxyl[J]. Environmental Science & Technology, 2020, 54(8): 4820-4828.
(  0) 0) |
| [68] |
Zhao Z J, Yang Y Y, Pang Y, et al. A review of study on Fe-C interaction and their adsorption properties to soil heavy metal (In Chinese)[J]. Advance in Earth Sciences, 2017, 32(8): 867-874. [赵转军, 杨艳艳, 庞瑜, 等. 铁碳共沉作用对土壤重金属的吸附性能研究进展[J]. 地球科学进展, 2017, 32(8): 867-874.]
(  0) 0) |
| [69] |
Wang P, Lu Y, Hu S W, et al. Kinetics of Ni reaction with organic matter-ferrihydrite composites: Experiments and modeling[J]. Chemical Engineering Journal, 2020, 379: 122306. DOI:10.1016/j.cej.2019.122306
(  0) 0) |
| [70] |
Lu Y, Hu S W, Liu F, et al. Effects of humic acid and fulvic acid on the sequestration of copper and carbon during the iron oxide transformation[J]. Chemical Engineering Journal, 2020, 383: 123194. DOI:10.1016/j.cej.2019.123194
(  0) 0) |
| [71] |
Li F B, Xu R K, Tan W F, et al. The frontier and perspectives of soil chemistry in the new era (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(5): 1088-1104. [李芳柏, 徐仁扣, 谭文峰, 等. 新时代土壤化学前沿进展与展望[J]. 土壤学报, 2020, 57(5): 1088-1104.]
(  0) 0) |
| [72] |
Peng L F, Liu P Y, Feng X H, et al. Kinetics of heavy metal adsorption and desorption in soil: Developing a unified model based on chemical speciation[J]. Geochimica et Cosmochimica Acta, 2018, 224: 282-300. DOI:10.1016/j.gca.2018.01.014
(  0) 0) |
| [73] |
Xiong J, Weng L P, Koopal L K, et al. Effect of soil fulvic and humic acids on Pb binding to the goethite/solution interface: Ligand charge distribution modeling and speciation distribution of Pb[J]. Environmental Science & Technology, 2018, 52(3): 1348-1356.
(  0) 0) |
| [74] |
Shi Z Q, di Toro D M, Allen H E, et al. A general model for kinetics of heavy metal adsorption and desorption on soils[J]. Environmental Science & Technology, 2013, 47(8): 3761-3767.
(  0) 0) |
| [75] |
Tian L, Shi Z Q, Lu Y, et al. Kinetics of cation and oxyanion adsorption and desorption on ferrihydrite: Roles of ferrihydrite binding sites and a unified model[J]. Environmental Science & Technology, 2017, 51(18): 10605-10614.
(  0) 0) |
| [76] |
Xu J L, Koopal L K, Fang L C, et al. Proton and copper binding to humic acids analyzed by XAFS spectroscopy and isothermal titration calorimetry[J]. Environmental Science & Technology, 2018, 52(7): 4099-4107.
(  0) 0) |
| [77] |
Zhao W, Tan W F, Wang M X, et al. CD-MUSIC-EDL modeling of Pb2+ adsorption on birnessites: Role of vacant and edge sites[J]. Environmental Science & Technology, 2018, 52(18): 10522-10531.
(  0) 0) |
| [78] |
Aeppli M, Kaegi R, Kretzschmar R, et al. Electrochemical analysis of changes in iron oxide reducibility during abiotic ferrihydrite transformation into goethite and magnetite[J]. Environmental Science & Technology, 2019, 53(7): 3568-3578.
(  0) 0) |
| [79] |
Wan M X, Hu W Y, Huang B, et al. Application of portable X-ray fluorescence(PXRF) for rapid determination of heavy metals in fertilizers (In Chinese)[J]. Soils, 2019, 51(6): 1137-1143. [万梦雪, 胡文友, 黄标, 等. 便携式x射线荧光光谱法(pxrf)在肥料重金属快速检测中的应用[J]. 土壤, 2019, 51(6): 1137-1143.]
(  0) 0) |
| [80] |
Wang Z, Cai J Y, Hou S T, et al. Advances in geochemical engineering technology for remediation of farmland soil contaminated by heavy metals: A review (In Chinese)[J]. Soils, 2020, 52(3): 445-450. [王喆, 蔡敬怡, 侯士田, 等. 地球化学工程技术修复农田土壤重金属污染研究进展[J]. 土壤, 2020, 52(3): 445-450.]
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59


