2. 洛阳市植物营养与环境生态重点实验室, 河南洛阳 471000;
3. 洛阳市共生微生物与绿色发展重点实验室, 河南洛阳 471000
2. Luoyang Key Laboratory of Plant Nutrition and Environmental Ecology, Luoyang, Henan 471000, China;
3. Luoyang Key Laboratory of Symbiotic Microbes and Green Development, Luoyang, Henan 471000, China
土壤中铁氧化还原过程可耦合氮、碳等元素的生物地球化学循环[1-4]。土壤中铁(氢)氧化物不仅可在厌氧条件下被还原溶解,还原过程产生的Fe(II)亦可在近中性条件下被硝酸盐还原铁氧化微生物[5-6]、不产氧光合微生物或者产氧光合微生物产生的氧再次氧化[7-8]。硝酸盐依赖型亚铁氧化(nitrate- dependent ferrous oxidation,NDFO)和光合型亚铁氧化(photosynthetic ferrous oxidation,PFO)被认为是厌氧环境中Fe(II)的两种氧化途径[6,8-9]。硝酸盐依赖型亚铁氧化是指Acidovorax等微生物利用
大量研究发现,硝酸盐依赖型亚铁氧化微生物和光合细菌均可在河流、近海沉积物等厌氧环境中[8- 9,21-25]同时存在。Laufer等[9]研究发现近海沉积物中光合型亚铁氧化微生物群落丰度随着沉积物深度的变化而降低,而硝酸盐依赖型亚铁氧化微生物群落丰度则不随深度变化。Melton等[6]认为近海淡水湖沉积物中NDFO与PFO之间因为均需要Fe(II)作为电子供体而存在潜在的竞争关系。以往研究多以在特定条件下培养扩繁、分离鉴定的思路研究具有亚铁氧化功能微生物的生境及可能的种群关系,而对于其在自然环境中是否能表现出来关注较少。此外,河流、近海沉积物处于持续性淹水的近中性环境,而在季节性淹水的石灰性稻田土壤中二者是否可以同时表现及关系如何鲜见报道。黄河中下游稻田在水稻生长季大量施用氮肥且处于淹水厌氧状态,其铁氧化物的厌氧还原存在显著的光照调控效应[26],然而避光淹水时
因此,本研究以采自黄河中下游地区河南省孟津县的水稻土为样品,分别在光照或避光条件下,设置培养前添加
供试土壤采自河南省孟津县会盟镇(34°48′59″N,112°39′85″E)稻田耕层(0~20 cm)。土壤样品采集后避光风干,研磨过1 mm筛备用。供试土壤样品基本性质如下:pH 8.16±0.08,游离铁(以Fe计)10.24±0.67 g·kg–1,无定形铁2.20± 0.17 mg·g–1,全氮1.49±0.00 g·kg–1,
试验采用水土比为1:1的厌氧泥浆恒温培养试验方法。试验设置5个处理:(1)仅加入去离子水作为对照;(2)培养开始前加入10 mmol·L–1 NaNO3溶液;(3)培养开始前加入10 mmol·L–1 NH4Cl;(4)加入去离子水培养7 d促使Fe(II)累积(前期研究发现培养7 d左右Fe(II)可累积至还原容量的90%),然后加入
培养过程中定期(对照和培养前加入
培养前土壤样品中
避光培养过程中0.5 mol·L–1 HCl可提取Fe(II)与培养时间的关系曲线采用文献[24]中提到的逻辑斯特方程(logistics)y=a/(1+be–kx)拟合,并据此计算出铁还原容量(a)、Fe(II)还原速率常数(k)和Fe(II)最大还原速率(0.25ak)。由于培养过程中加入
光照条件下Fe(II)最大累积量、Fe(II)再氧化量和Fe(II)再氧化速率的计算与文献[29]相同。Fe(II)最大累积量为培养过程中Fe(II)最大含量,Fe(II)氧化量为Fe(II)最大累积量与培养结束Fe(II)含量之差,Fe(II)再氧化速率为Fe(II)再氧化量与氧化持续时间之比。
使用Microsoft Excel 2016处理数据,SPSS 23对数据进行单因素方差分析(one-way ANOVA),采用邓肯(Duncan)法进行显著性检验(P < 0.05),Origin 8.5作图。
2 结果 2.1 避光时土壤中Fe(II)累积动态避光培养过程中DS、DN、DA处理土壤中0.5 mol·L–1 HCl可提取Fe(II)含量均表现为先升高随后保持平稳趋势(图 1a),未表现出明显亚铁氧化现象。虽然DN和DA处理铁还原容量与DS无显著差异,但其最大还原速率较DS分别降低了0.28 mg·g–1·d–1和0.33 mg·g–1·d–1,速率常数降低了0.15 d–1和0.17 d–1,且DN与DA之间无显著差异(表 1)。7DN、7DA处理土壤中Fe(II)在加入
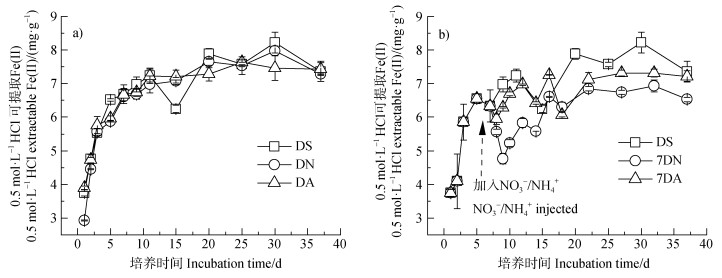
|
注:图中误差线为标准差;DS、DN、DA、7DN和7DA处理分别代表避光条件下仅加入去离子水、培养开始前加入10 mmol·L–1 NaNO3溶液、培养开始前加入10 mmol·L–1 NH4Cl、7 d后加入10 mmol·L–1 NaNO3和7 d后加入10 mmol·L–1 NH4Cl。下同。 Note: Error bars represent standard deviation; the treatments of DS, DN, DA, 7DN and 7DA under dark represented only added deionized water, 10 mmol·L–1 NaNO3 added to the soil before incubation, 10 mmol·L–1 NH4Cl added to the soil before incubation, 10 mmol·L–1 NaNO3 added to soil at 7 d and 10 mmol·L–1 NH4Cl added to soil at 7 d, respectively. The same below.
图 1 避光条件下水稻土中0.5 mol·L–1 HCl可提取态Fe(II)含量动态(a. 培养前加入 |
|
|
表 1 |
光照各处理土壤中Fe(II)均先升高后降低(图 2),均表现明显的Fe(II)氧化现象,表观Fe(II)氧化量为1.99 mg·g–1。光照时Fe(II)氧化因
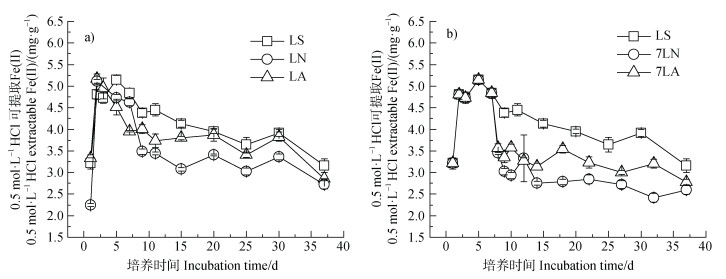
|
注:LS、LN、LA、7LN和7LA处理分别代表光照条件下仅加入去离子水、培养开始前加入10 mmol·L–1 NaNO3溶液、培养开始前加入10 mmol·L–1 NH4Cl、7 d后加入10 mmol·L–1 NaNO3和7 d后加入10 mmol·L–1 NH4Cl。下同。 Note: the treatments of LS, LN, LA, 7LN and 7LA under illumination represented only added deionized water, 10 mmol·L–1 NaNO3 added to the soil before incubation, 10 mmol·L–1 NH4Cl added to the soil before incubation, 10 mmol·L–1 NaNO3 added to soil at 7 d and 10 mmol·L–1 NH4Cl added to soil at 7 d, respectively. The same below.
图 2 光照条件下土壤中0.5 mol·L–1 HCl可提取态Fe(II)含量变化(a. 培养前加入 |
|
|
表 2 光照下加入 |
避光时整个培养过程顶空中O2含量维持在3.87±0.26 μmol·L–1,7 d时采用注射器外加
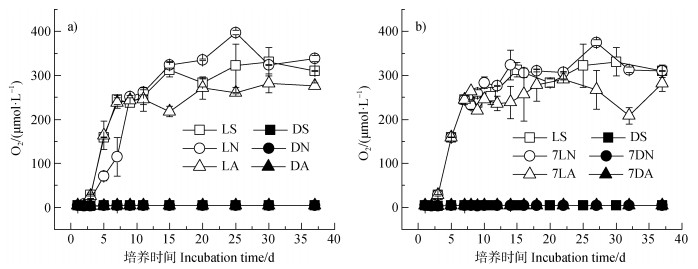
|
图 3 加入 |
培养前土壤中
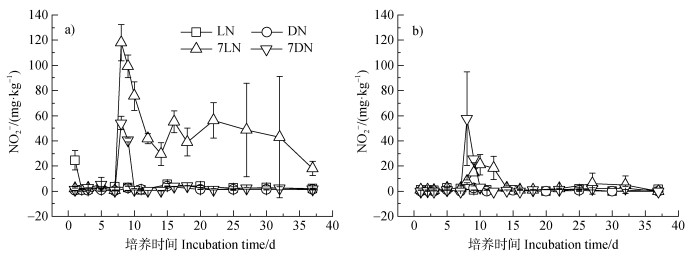
|
图 4 培养过程中水稻土中水溶性 |

|
图 5 水稻土中 |
培养前风干土样
避光培养37 d后DN处理
本研究结果显示,采自黄河中游稻田的石灰性水稻土在培养7 d后加入
淹水光照时石灰性水稻土中Fe(II)在5 d左右达到最大,5 d后表现为亚铁氧化。已有研究[8,31]发现,光照下Fe(II)可被光合产氧菌如Cyanobacteria、Chlorobium strain N1产生的O2氧化,而本研究光照下3 d后O2开始快速累积且与体系Fe(II)之间存在极显著负相关关系(P < 0.01),决定系数介于0.52 ~ 0.92之间(图 6),说明体系内的Fe(II)氧化现象主要为光合细菌光合产氧所致[8]。光照下7LN处理培养结束时Fe(II)氧化量相对于LS处理显著提高0.57 mg·g–1(表 2),且体系中出现明显的
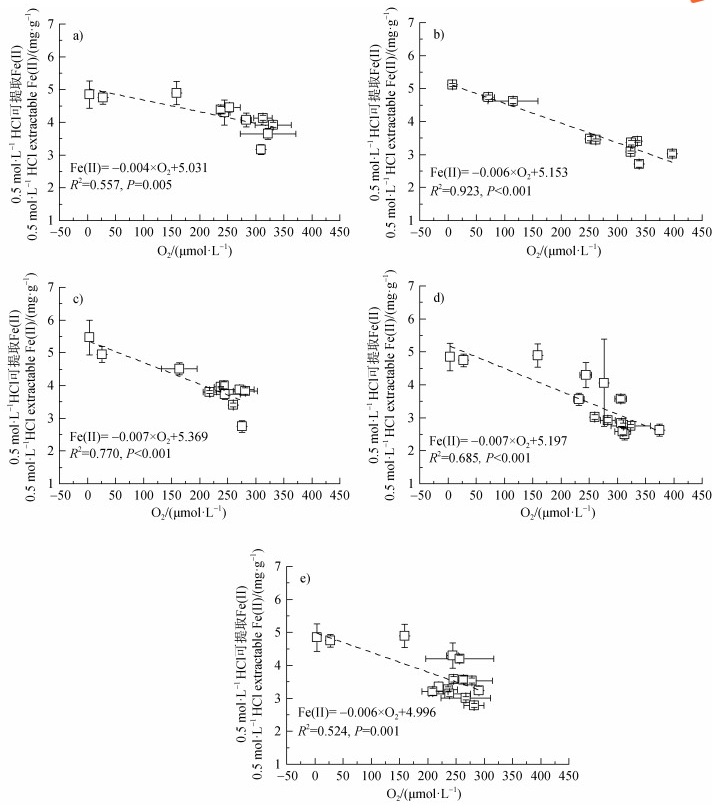
|
注:图a、b、c、d和e分别代表LS、LN、LA、7LN和7LA处理。 Note: the serial numbers a, b, c, d, and e in the figure represent treatments of LS, LN, LA, 7LN and 7LA, respectively. 图 6 厌氧培养过程中Fe(II)与顶空O2关系 Fig. 6 Relationship between Fe(II)and O2 during anaerobic incubation |
Melton等[6]发现淡水湖泊干沉积物中光合型铁氧化菌可达3.4×105 g–1,硝酸盐还原Fe(II)氧化菌为6.3×104 g–1。本研究发现,避光时NDFO可达2.21 mg·g–1且无PFO,而光照时PFO为1.99 mg·g–1,NDFO仅为0.57 mg·g–1,说明光照可能激活光合型铁氧化菌而抑制NDFO。7 d时加入
本实验土壤中
硝酸盐依赖型亚铁氧化(NDFO)与光合型亚铁氧化(PFO)现象均可在淹水的石灰性水稻土中存在。避光时氧化产生的Fe(III)可被再次还原,导致NDFO过程被掩盖。光照下土壤亚铁氧化以光合型亚铁氧化为主,光照可抑制硝酸盐还原而抑制NDFO。NDFO和PFO均可促进Fe(II)氧化成矿,通过表面吸附或共沉淀钝化固定重金属,为土壤重金属修复提供新思路。
| [1] |
Chen C M, Hall S J, Coward E, et al. Iron-mediated organic matter decomposition in humid soils can counteract protection[J]. Nature Communications, 2020, 11(1): 2255. DOI:10.1038/s41467-020-16071-5
(  0) 0) |
| [2] |
Zhang X F, Liu T X, Li F B, et al. Multiple effects of nitrate amendment on the transport, transformation and bioavailability of antimony in a paddy soil-rice plant system[J]. Journal of Environmental Sciences, 2021, 100: 90-98. DOI:10.1016/j.jes.2020.07.009
(  0) 0) |
| [3] |
Yu H Y, Li F B, Liu C S, et al. Iron redox cycling coupled to transformation and immobilization of heavy metals: implications for paddy rice safety in the red soil of South China[J]. Advances in Agronomy, 2016, 137: 279-317.
(  0) 0) |
| [4] |
Wang J B, Zhu Z K, Lin S, et al. Mineralization of goethite-adsorbed and -encapsulated organic carbon and its priming effect in paddy soil (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(6): 1530-1539. [江家彬, 祝贞科, 林森, 等. 针铁矿吸附态和包裹态有机碳在稻田土壤中的矿化及其激发效应[J]. 土壤学报, 2021, 58(6): 1530-1539.]
(  0) 0) |
| [5] |
Shelobolina E, Konishi H, Xu H F, et al. Isolation of phyllosilicate-iron redox cycling microorganisms from an illite-smectite rich hydromorphic soil[J]. Frontiers in Microbiology, 2012, 3: 134.
(  0) 0) |
| [6] |
Melton E D, Schmidt C, Kappler A. Microbial iron(II)oxidation in littoral freshwater lake sediment: the potential for competition between phototrophic vs. nitrate-reducing iron(II)-oxidizers[J]. Frontiers in Microbiology, 2012, 3: 197.
(  0) 0) |
| [7] |
Weber K A, Achenbach L A, Coates J D. Microorganisms pumping iron: Anaerobic microbial iron oxidation and reduction[J]. Nature Reviews Microbiology, 2006, 4(10): 752-764. DOI:10.1038/nrmicro1490
(  0) 0) |
| [8] |
Bryce C, Blackwell N, Schmidt C, et al. Microbial anaerobic Fe(II)oxidation–Ecology, mechanisms and environmental implications[J]. Environmental Microbiology, 2018, 20(10): 3462-3483. DOI:10.1111/1462-2920.14328
(  0) 0) |
| [9] |
Laufer K, Nordhoff M, Røy H, et al. Coexistence of microaerophilic, nitrate-reducing, and phototrophic Fe(II)oxidizers and Fe(III)reducers in coastal marine sediment[J]. Applied and Environmental Microbiology, 2015, 82(5): 1433-1447.
(  0) 0) |
| [10] |
Liu T X, Chen D D, Li X M, et al. Microbially mediated coupling of nitrate reduction and Fe(II)oxidation under anoxic conditions[J]. FEMS Microbiology Ecology, 2019, 95(4): fiz030.
(  0) 0) |
| [11] |
Liu T X, Cheng K, Chen D D, et al. Formation of Fe(Ⅲ)-minerals by microbially mediated coupling of nitrate reduction and Fe(Ⅱ)oxidation: A review (In Chinese)[J]. Ecology and Environmental Sciences, 2019, 28(3): 620-628. [刘同旭, 程宽, 陈丹丹, 等. 微生物介导的硝酸盐还原耦合亚铁氧化成矿研究进展[J]. 生态环境学报, 2019, 28(3): 620-628.]
(  0) 0) |
| [12] |
Liu T X, Chen D D, Luo X B, et al. Microbially mediated nitrate-reducing Fe(II)oxidation: Quantification of chemodenitrification and biological reactions[J]. Geochimica et Cosmochimica Acta, 2019, 256: 97-115. DOI:10.1016/j.gca.2018.06.040
(  0) 0) |
| [13] |
Benaiges-Fernandez R, Offeddu F G, Margalef-Marti R, et al. Geochemical and isotopic study of abiotic nitrite reduction coupled to biologically produced Fe(II)oxidation in marine environments[J]. Chemosphere, 2020, 260: 127554. DOI:10.1016/j.chemosphere.2020.127554
(  0) 0) |
| [14] |
Cheng B Y, Wang Y, Hua Y M, et al. The performance of nitrate-reducing Fe(II)oxidation processes under variable initial Fe/N ratios: The fate of nitrogen and iron species[J]. Frontiers of Environmental Science & Engineering, 2020, 15(4): 73.
(  0) 0) |
| [15] |
Hu S W, Liu T X, Li F B, et al. The Abiotic and biotic transformation processes of soil iron-bearing minerals and its interfacial reaction mechanisms of heavy metals: A review (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(1): 12. [胡世文, 刘同旭, 李芳柏, 等. 土壤铁矿物的生物-非生物转化过程及其界面重金属反应机制的研究进展[J]. 土壤学报, 2022, 59(1): 12.]
(  0) 0) |
| [16] |
Swanner E D, Wu W F, Hao L K, et al. Physiology, Fe(II)oxidation, and Fe mineral formation by a marine planktonic cyanobacterium grown under ferruginous conditions[J]. Frontiers in Earth Science, 2015, 3: 60.
(  0) 0) |
| [17] |
Posth N R, Konhauser K O, Kappler A. Microbiological processes in banded iron formation deposition[J]. Sedimentology, 2013, 60(7): 1733-1754. DOI:10.1111/sed.12051
(  0) 0) |
| [18] |
Thompson K J, Kenward P A, Bauer K W, et al. Photoferrotrophy, deposition of banded iron formations, and methane production in Archean oceans[J]. Science Advances, 2019, 5(11): eaav2869. DOI:10.1126/sciadv.aav2869
(  0) 0) |
| [19] |
Wang X G, Sun L R, Chen Z H, et al. Light inhibition of carbon mineralization associated with iron redox processes in calcareous paddy soil[J]. Journal of Soils and Sediments, 2020, 20(8): 3171-3180. DOI:10.1007/s11368-020-02660-w
(  0) 0) |
| [20] |
Bothe H, Schmitz O, Yates M G, et al. Nitrogen fixation and hydrogen metabolism in cyanobacteria[J]. Microbiology and Molecular Biology Reviews, 2010, 74(4): 529-551. DOI:10.1128/MMBR.00033-10
(  0) 0) |
| [21] |
Chen P C, Li X M, Li F B. Shifts of microbial communities during Fe(II)oxidation coupled to nitrate reduction in paddy soil (In Chinese)[J]. China Environmental Science, 2017, 37(1): 358-366. [陈鹏程, 李晓敏, 李芳柏. 水稻土Fe(Ⅱ)氧化耦合还原的微生物变化[J]. 中国环境科学, 2017, 37(1): 358-366.]
(  0) 0) |
| [22] |
Deng T C, Qian Y F, Chen X J, et al. Ciceribacter ferrooxidans sp. nov., a nitrate-reducing Fe(II)-oxidizing bacterium isolated from ferrous ion-rich sediment[J]. Journal of Microbiology, 2020, 58(5): 350-356. DOI:10.1007/s12275-020-9471-2
(  0) 0) |
| [23] |
Wang R, Zheng P, Zhang M, et al. Nitrate-dependent anaerobic ferrous/iron oxidation microorganism: Review on its species, distribution and characteristics (In Chinese)[J]. Microbiology China, 2015, 42(12): 2448-2456. [王茹, 郑平, 张萌, 等. 硝酸盐型厌氧铁氧化菌的种类、分布和特性[J]. 微生物学通报, 2015, 42(12): 2448-2456.]
(  0) 0) |
| [24] |
Sun L R, Wang X G, Xu X F, et al. Anaerobic redox of iron oxides and photosynthetic oxidation of ferrous iron in upland cinnamon soils (In Chinese)[J]. Acta Pedologica Sinica, 2015, 52(6): 1291-1300. [孙丽蓉, 王旭刚, 徐晓峰, 等. 旱作褐土中氧化铁的厌氧还原与光合型亚铁氧化特征[J]. 土壤学报, 2015, 52(6): 1291-1300.]
(  0) 0) |
| [25] |
Wang X G, Sun L R, Ma L J, et al. Temperature sensitivity of iron redox processes in wetland soil in the Middle and Lower Reaches of the Yellow River (In Chinese)[J]. Acta Pedologica Sinica, 2018, 55(2): 380-389. [王旭刚, 孙丽蓉, 马林娟, 等. 黄河中下游湿地土壤铁还原氧化过程的温度敏感性[J]. 土壤学报, 2018, 55(2): 380-389.]
(  0) 0) |
| [26] |
Wang X G, Guo D Y, Zhang P, et al. Effect of illumination and water condition on iron redox cycle in paddy soil (In Chinese)[J]. Acta Pedologica Sinica, 2014, 51(4): 853-859. [王旭刚, 郭大勇, 张苹, 等. 水稻土中铁氧化还原循环的光照水分效应[J]. 土壤学报, 2014, 51(4): 853-859.]
(  0) 0) |
| [27] |
Sun L R, Wang X G, Guo D Y, et al. Dynamics of anaerobic reduction of iron oxides in upland cinnamon soils (In Chinese)[J]. Acta Pedologica Sinica, 2013, 50(1): 106-112. [孙丽蓉, 王旭刚, 郭大勇, 等. 旱作褐土中铁氧化物的厌氧还原动力学特征[J]. 土壤学报, 2013, 50(1): 106-112.]
(  0) 0) |
| [28] |
Lu R K. Analytical method for soil and agricultural chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科学技术出版社, 2000.]
(  0) 0) |
| [29] |
Wang X G, Sun L R, Zhang Y L, et al. Characterization of reduction of iron oxide and oxidation of ferrous iron in upland cinnamon soil profiles in west Henan, China (In Chinese)[J]. Acta Pedologica Sinica, 2018, 55(5): 1199-1211. [王旭刚, 孙丽蓉, 张颖蕾, 等. 豫西旱作褐土剖面土壤的氧化铁还原与亚铁氧化特征[J]. 土壤学报, 2018, 55(5): 1199-1211.]
(  0) 0) |
| [30] |
Li X M, Zhang W, Liu T X, et al. Changes in the composition and diversity of microbial communities during anaerobic nitrate reduction and Fe(II)oxidation at circumneutral pH in paddy soil[J]. Soil Biology and Biochemistry, 2016, 94: 70-79.
(  0) 0) |
| [31] |
Kappler A, Bryce C, Mansor M, et al. An evolving view on biogeochemical cycling of iron[J]. Nature Reviews Microbiology, 2021, 19(6): 360-374.
(  0) 0) |
| [32] |
Clément J, Shrestha J, Ehrenfeld J G, et al. Ammonium oxidation coupled to dissimilatory reduction of iron under anaerobic conditions in wetland soils[J]. Soil Biology and Biochemistry, 2005, 37(12): 2323-2328.
(  0) 0) |
| [33] |
Shuai W, Jaffé P R. Anaerobic ammonium oxidation coupled to iron reduction in constructed wetland mesocosms[J]. Science of the Total Environment, 2019, 648: 984-992.
(  0) 0) |
| [34] |
Kuypers M M M, Marchant H K, Kartal B. The microbial nitrogen-cycling network[J]. Nature Reviews Microbiology, 2018, 16(5): 263-276.
(  0) 0) |
| [35] |
Kraft B, Strous M, Tegetmeyer H E. Microbial nitrate respiration–Genes, enzymes and environmental distribution[J]. Journal of Biotechnology, 2011, 155(1): 104-117.
(  0) 0) |
| [36] |
Dang Y A, Li S Q, Wang G D, et al. The different characteristics of soil fixed ammonium from south to north on the Loess Plateau (In Chinese)[J]. Journal of Plant Nutrition and Fertilizers, 2007, 13(5): 831-837. [党亚爱, 李世清, 王国栋, 等. 黄土高原典型土壤矿物固定态铵变化的南北差异[J]. 植物营养与肥料学报, 2007, 13(5): 831-837.]
(  0) 0) |
| [37] |
Jamieson J, Prommer H, Kaksonen A H, et al. Identifying and quantifying the intermediate processes during nitrate-dependent iron(II)oxidation[J]. Environmental Science & Technology, 2018, 52(10): 5771-5781.
(  0) 0) |
| [38] |
Klueglein N, Kappler A. Abiotic oxidation of Fe(II)by reactive nitrogen species in cultures of the nitrate- reducing Fe(II)oxidizer Acidovorax sp. BoFeN1– questioning the existence of enzymatic Fe(II)oxidation[J]. Geobiology, 2013, 11(2): 180-190.
(  0) 0) |
 2023, Vol. 60
2023, Vol. 60


