生物结皮是由不同种类的苔藓、地衣、藻类、真菌、蓝藻以及细菌等与表层土壤共同形成的一种有机复合体[1],它不仅能增强土壤抵抗风蚀和水蚀的能力,还能提高土壤肥力,改良土壤[2]。由于其特殊生态功能,生物结皮已成为国内外研究热点,国内对生物结皮的研究主要集中在干旱、半干旱地区[3-4],南方地区高温多雨的特点虽然容易引发土壤侵蚀,但同时有利于苔藓、地衣、藻类等的生长与繁殖,从而促进生物结皮的形成,因此在林地零星分布着生物结皮。但目前对南方红壤区生物结皮的关注较少。此外,关于生物结皮的研究焦点主要集中在生物结皮的组成、演替、季节变化及对碳氮循环、土壤理化性质、土壤水分和土壤侵蚀的影响[3],而对红壤生物结皮层中微生物群落结构的研究鲜有涉及。
微生物是土壤生物结皮层的重要组成部分,细菌是其中数量最多的微生物种群,在养分循坏、碳氮固定和有机质分解中发挥着关键作用,而真菌在有机质分解、物质和能量循环中也有特殊的作用。它们的群落结构和多样性深刻影响着生物结皮层的形成发育与功能的发挥[2,4]。此外,土壤微生物对肥力的形成与演变有重要作用:土壤微生物和矿物的相互作用可改变矿物表面性质和微生物活性,进而影响土壤肥力等环境效应[5];土壤中各种来源和形态的有机质最终均必须经过微生物的分解矿化过程才能重新进入土壤生物地球化学循环;微生物还能够通过分泌有机酸和功能酶的成分直接“活化”固定态的磷、钾等养分[6-7]。因此,微生物在土壤功能恢复中具有举足轻重的作用[8]。但是微生物具有高度敏感性,容易受到外部环境的影响,如植被覆盖类型、土壤特征、生物地理和干扰等[9-11]。
南方红壤侵蚀地经过多年林业生态工程的建设取得了巨大成效,但大规模侵蚀劣地上形成的乔木成林而地表裸露的“空中森林”仍然存在,劣质林地“远看绿油油,近看水土流”的林下水土流失现象仍然突出。因此,改良劣质林地土壤、提高土壤肥力、防治林下水土流失刻不容缓。有机肥、生物炭和微生物肥料常被用来改良土壤,提高土壤肥力[12],但这些肥力提升措施主要用于农业土壤,用于林地土壤的改良较少见。这些肥力提升措施的实施必然会影响土壤微生物[13-14],但其如何影响红壤生物结皮层中微生物群落结构尚不清楚,这制约了南方劣质林地土壤的改良,以及林下水土流失的防治。本研究以南方林下裸露林地为对照,添加有机肥、生物炭和石灰+微生物肥料为肥力提升措施,采用Illumina MiSeq高通量测序技术比较这三种肥力提升措施对土壤结皮层细菌和真菌群落结构的影响,为南方退化红壤区劣质林地土壤改良和水土保持提供科学指导。
1 材料与方法 1.1 试验地概况与试验设计试验地位于江西省吉安市井冈山水土保持科技示范园内(泰和县老虎山小流域),北纬26°50'—26°51',东经114°52'—114°54',海拔80~200 m,境内多平缓丘坡,坡度多为5°,属中亚热带季风气候,多年平均降雨量为1 363 mm,极端气温分别为40.4℃和–6℃,平均气温为18.6℃,无霜期为288 d,土壤为第四纪红色黏土发育而成的红壤,厚度约为3~40 cm,属于强度侵蚀退化红壤。试验地属1984年种植的马尾松林地,株行距为1 m×1 m,林下水土流失严重。
试验地设于湿地松林内,以湿地松裸露林地为对照(CK),添加有机肥(A)、生物质炭(B)、石灰+微生物肥料(T)为处理,每个处理分别设3个小区、每个小区25 m×25 m。有机肥处理每个小区施加12 kg有机肥,有机肥为当地的油菜枯饼,该有机肥含有机质70.3%,全氮5.01%,五氧化二磷1.08%,氧化钾1.82%。生物炭处理每个小区施加12 kg生物质炭,生物炭购于宜春市丰城宁能生物质发电有限公司,原料为水稻秸秆,采用连续立式生物质化炉生产,炭化温度为450℃,生物炭的基本性质为pH 10.4,有机碳467.0 g·kg–1,全氮5.90 g·kg–1,全磷1.50 g·kg–1,全钾29.50 g·kg–1。石灰+微生物肥料处理每个小区施加12 kg微生物肥料+1 kg石灰,微生物肥料购买于江苏新天地生物肥料工程中心有限公司,是南京农业大学植物营养与肥料系研制的专用微生物肥料—Bio抗土传病高效生物肥(每克肥料抗病菌种有效活菌数≥5,有机质≥25%,氮+磷+钾≥6%)。四个处理均等高条带开沟5~10 cm,并拌土回填。2018年6月第1次施肥后不再施肥,2年后,在每个处理的3个重复地块内各选取3个生物结皮层,采集生物结皮层(0~2 cm)混合均匀作为一个重复,共12个样品,4℃运回实验室后,每个样品分成2份,1份过60目的筛后置于–20℃保存,用于提取微生物DNA,进行微生物群落分析,1份风干过10目筛,用于测定土壤理化性质。
土壤理化性质的测定参照《土壤农业化学分析方法》[15]:土壤pH采用电位法(水:土=1:5)测定,土壤有机质(OM)和有机碳(SOC)采用重铬酸钾—比色法测定,全氮(TN)采用凯氏定氮法测定,全磷(TP)采用碳酸氢钠浸提—钼锑抗比色法测定,全钾(TK)采用乙酸铵浸提—火焰光度法测定。
1.2 土壤DNA提取和实时荧光定量PCR土壤细菌和真菌数量采用实时荧光定量PCR(Real-time PCR)计算。准确称取0.50 g新鲜土壤,用宏基因组DNA提取试剂盒(GENErary)根据使用方法参照说明书提取DNA,并利用1%琼脂糖凝胶电泳检测DNA质量,测定DNA完整性,用紫外分光光度计测定DNA纯度和浓度,将提取的DNA于–20℃冰箱冻存。采用实时荧光定量法在PCR仪(EDC-810型,北京东胜创新生物科技有限公司)上对细菌16S rRNA基因中的V3-V4高变区和真菌ITS1基因进行PCR扩增[14]。细菌扩增引物为338F(ACTCCTACGGGAGGCAGCAG)和806R(GGAC TACHVGGGTWTCTAAT),真菌扩增引物为ITS1F(CTTGGTCATTTAGAGGAAGTAA)和ITS2(GCTGCGTTCTTCATCGATGC)。反应体系(16 μL)包括SYBR Green Mix 7 μL,Primer-F 0.5 μL,Primer-R 0.5 μL,cDNA 8 μL。扩增程序:95℃预变性10 min,95℃变性10 s,60℃退火34 s,72℃延伸30 s,40个循环,72℃延伸10 min,降温至10℃,进行扩增。采用标准曲线法,构建目的基因和内参基因的标准品,构建标准曲线,计算目的基因和内参基因引物的扩增效率,代入计算得出两者的倍数关系,内参基因为单拷贝基因,因此可以得出目的基因拷贝数,拷贝数(copies·μL–1)的计算:b×10–9× 6.02×1023/(bp×660),其中b为标准品浓度(ng·μL–1),bp×660为质粒大小。根据得到的标准曲线计算其他样品的细菌总数和真菌总数。
1.3 细菌16S rRNA基因和真菌ITS1基因的高通量测序用2%琼脂糖凝胶对上述扩增产物提取扩增子,用胶回收试剂盒对扩增子进行纯化后,由北京百迈客生物技术有限公司的Illumina MiSeq平台对PCR扩增产物进行高通量测序。使用Trimmomatic工具对原始数据进行过滤,使用Cutadapt软件按照允许最大错配率20%,最小覆盖度80%的参数进行引物序列的识别和去除。接着用FLASH v1.2.11软件按照最小overlap长度为10 bp对每个样品的reads进行拼接,使用lima(v1.7.0)软件通过barcode序列识别不同样品的CCS序列并去除嵌合体,得到高质量CCS序列。然后用USEARCH在相似性97%的水平上对序列进行聚类,以0.005%的序列数作为阙值过滤OTUs。用QIIME2中classify-consensus-blast将特性序列与GreenGene数据库(http://greengenes.secondgenome.com/)比对,不能精确比对上参考数据库的使用classfy-sklearn分类器分类,根据序列间的相似性作为阈值分成操作分类单元(OTUs),进行物种注释,以此评估各样品中细菌和真菌在门、纲、目、科、属、种上的相对丰度。根据OTUs,用Alpha指数分析软件QIIME2(https://qiime2.org/)计算物种丰富度指数(Chao1指数)和物种多样性指数(辛普森指数和香农指数)。
1.4 数据处理采用SPSS 19.0软件对不同处理土壤理化性质、土壤生物结皮层微生物数量、多样性指数等进行Duncan法多重比较(Multiple comparisons)(P < 0.05)和皮尔森相关性分析(Pearson correlation),表中结果以“平均值±标准误”形式表示。土壤生物结皮层细菌和真菌OTUs数进行lg归一化处理,采用R 3.6.2软件绘制土壤结皮层细菌和真菌OTUs韦恩图和门水平优势物种相对丰度图,采用Canoco 5.0绘制细菌和真菌群落与土壤理化性质的典型对应分析(CCA)图。
2 结果 2.1 不同肥力提升措施下土壤理化性质各肥力提升措施均显著提高了生物结皮层土壤pH(表 1)。各肥力提升措施均对生物结皮层土壤有机质、有机碳和全氮含量有提高作用,提高作用大小依次为石灰+微生物肥料处理、有机肥处理、生物炭处理,其中,石灰+微生物肥料处理的提高作用显著。此外,有机肥处理显著提高了生物结皮层土壤全磷含量,生物炭处理显著提高了全钾含量,而石灰+微生物肥料处理却显著降低了全钾含量。
|
|
表 1 不同肥力提升措施土壤理化性质 Table 1 Soil physical-chemical properties of different fertility improvement measures |
各肥力提升措施对红壤生物结皮层真菌总数均有显著的提高作用,作用大小依次为石灰+微生物肥料处理、生物炭处理、有机肥处理,平均提高值分别为53.35×106、16.87×106和8.97×106·g–1干土。对于细菌总数,生物炭处理和有机肥处理均有显著降低作用,平均降低值分别为529.8×106和278.9× 106·g–1干土,而石灰+微生物肥料处理对其影响不显著(表 2)。
|
|
表 2 不同肥力提升措施土壤生物结皮层微生物数量和OTUs Table 2 The microbial population and OTUs in soil crusts under different fertility improvement measures |
在97%相似水平上计算各土壤样品测序的覆盖率,由表 2可知,细菌和真菌文库测序覆盖率均在90%以上,测序数据能够真实地反映土壤样品中的微生物群落,但可能仍有少量微生物种类未被发现。四个处理的土壤生物结皮层12个土样中共检测出111 555条细菌基因序列和380 311条真菌基因序列,共得到868个细菌OTUs和564个真菌OTUs。肥力提升措施对细菌OTUs数目的影响高于真菌,生物炭处理平均增加143个细菌OTUs,而石灰+生物炭处理平均降低181个细菌OTUs(表 2)。
四个处理共同的细菌OTUs数为379个,共同的真菌OTUs数为405个。各处理中,CK处理特有细菌OTUs20个、真菌OTUs4个,有机肥处理特有细菌OTUs77个、真菌OTUs2个,生物炭处理特有细菌OTUs30个、真菌OTUs2个,石灰+微生物肥料处理特有细菌OTUs2个、真菌OTUs6个(图 1)。
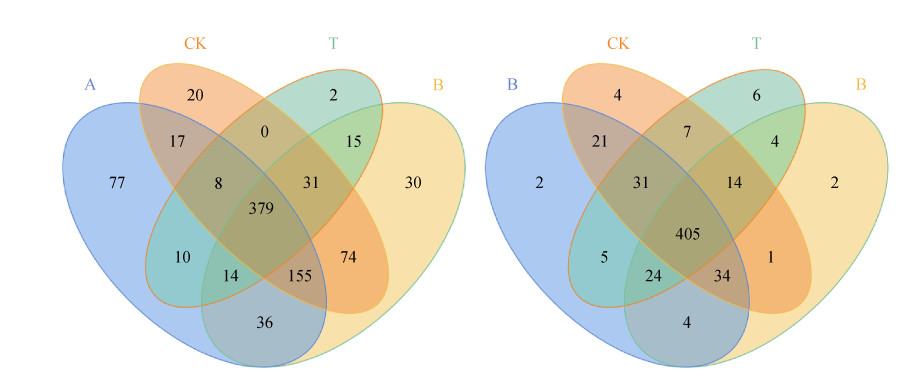
|
图 1 不同肥力提升措施土壤生物结皮层细菌和真菌OTUs韦恩图 Fig. 1 Venn diagram of bacteria and fungus in soil crusts under different fertility improvement measures |
四个处理中,有机肥处理下的土壤生物结皮层细菌门和细菌属最高,分别为21个细菌门和242个细菌属,比CK处理分别高4个细菌门和52个细菌属。四个处理的土壤生物结皮层真菌门和真菌属差异不大。各肥力提升措施对红壤生物结皮层细菌和真菌多样性指数(辛普森指数和香农指数)和丰富度指数(Chao1指数)均无显著影响(表 3)。
|
|
表 3 不同肥力提升措施土壤生物结皮层微生物多样性 Table 3 Diversity of microbial in soil crusts under different fertility improvement measures |
四个处理的土壤生物结皮层中总共检测出21个细菌门,相对丰度较高的前10个细菌门分别为酸杆菌门(Acidobacteria)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、WPS-2、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、浮霉菌门(Planctomycetes)、拟杆菌门(Bacteroidetes)、髌骨细菌门(Patescibacteria)和异常球菌-栖热菌门(Deinococcus-Thermus)(图 2a)。其中,优势细菌门为酸杆菌门、变形菌门、放线菌门和绿弯菌门,占比达80%以上。有机肥处理大幅度提高了变形菌门细菌的相对丰度,提高幅度达92.45%,同时明显降低了酸杆菌门和绿弯菌门细菌的相对丰度,降幅分别为53.24%和55.49%。生物炭处理提高了酸杆菌门和变形菌门细菌的相对丰度,提高幅度分别为16.45%和28.42%,降低了绿弯菌门细菌的相对丰度,降幅为12.81%。石灰+微生物肥料处理明显提高了放线菌门和变形菌门细菌的相对丰度,提高幅度分别为25.48%和28.27%,明显降低了绿弯菌门细菌的相对幅度,降幅为32.59%。
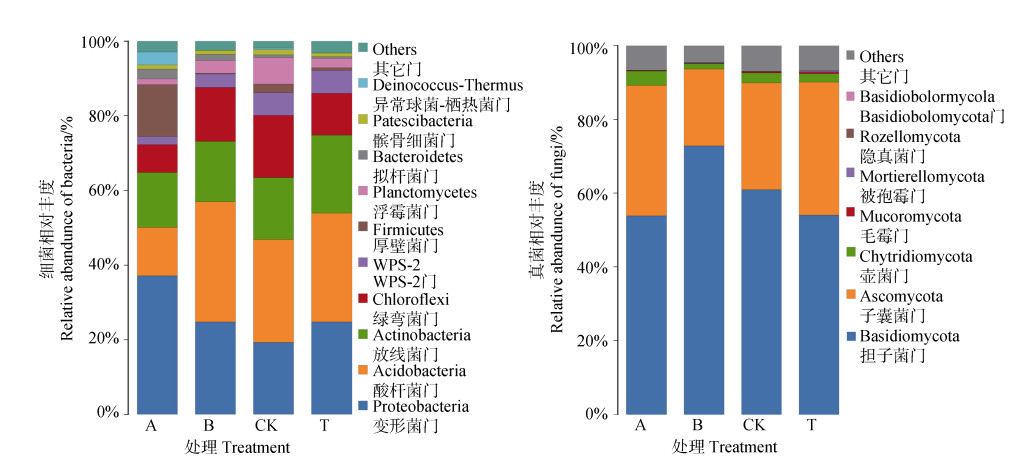
|
图 2 不同肥力提升措施土壤生物结皮层门水平优势微生物相对丰度 Fig. 2 Relative abundance of dominant microbial phyla in soil crusts under different fertility improvement measures |
四个处理的土壤生物结皮层中总共检测7个真菌门,分别为担子菌门(Basidiomycota)、子囊菌门(Ascomycota)、被孢霉门(Mortierellomycota)、隐真菌门(Rozellomycota)、壶菌门(Chytridiomycota)、毛霉门(Mucoromycota)和Basidiomycota(图 2b)。相对丰度较高的前3个真菌门分别为担子菌门、子囊菌门和壶菌门,其中,担子菌门和子囊菌门是优势真菌门,占比达90%以上。有机肥处理和石灰+微生物肥料处理均明显提高了子囊菌门真菌的相对丰度,提高幅度分别为22.13%和24.46%,却降低担子菌门真菌的相对丰度,降幅分别为11.62%和11.27%;生物炭处理则相反,对担子菌门真菌相对丰度的提高幅度为19.58%,对子囊菌门真菌相对丰度的降幅为27.93%。
2.4 微生物群落特征与土壤理化性质的关系相关性分析表明:土壤生物结皮层细菌总数与全钾呈显著负相关(r=-0.664,P < 0.05),与pH呈负相关,却与有机质、有机碳和全氮呈正相关;细菌OTUs和丰富度指数(Chao1指数)与全钾呈显著正相关(r=0.794,P < 0.01;r=0.828,P < 0.01),却与有机质、有机碳和全氮呈负相关;细菌多样性指数与全钾呈正相关;真菌总数与pH、有机质、有机碳和全氮均呈显著正相关(P < 0.05),却与全钾呈显著负相关(r=–0.613,P < 0.05);真菌多样性指数与pH和全氮呈负相关,却与全磷呈正相关(表 4)。
|
|
表 4 微生物多样性指标与土壤理化性质的相关性 Table 4 Pearson correlation of microbial diversity index and soil physical-chemical properties |
典型对应分析(CCA分析)结果表明,生物结皮层土壤理化性质对微生物群落结构有较大影响,土壤理化性质能解释土壤生物结皮层细菌群落42.44%的变异和真菌群落45.95%的变异。由图 3a可知,酸杆菌门(Acidobacteria)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、WPS-2、绿弯菌门(Chloroflexi)、浮霉菌门(Planctomycetes)、疣微菌门(Verrucomicrobia)相似性较强,与生物结皮层土壤pH、有机质、有机碳和全氮含量相关性较高。由图 3b可知,毛霉门(Mucoromycota)与生物结皮层土壤有机质、有机碳、全氮相关性较强,同时,担子菌门(Basidiomycota)、子囊菌门(Ascomycota)、壶菌门(Chytridiomycota)相似性较强,也受生物结皮层土壤有机质、有机碳含量的影响。
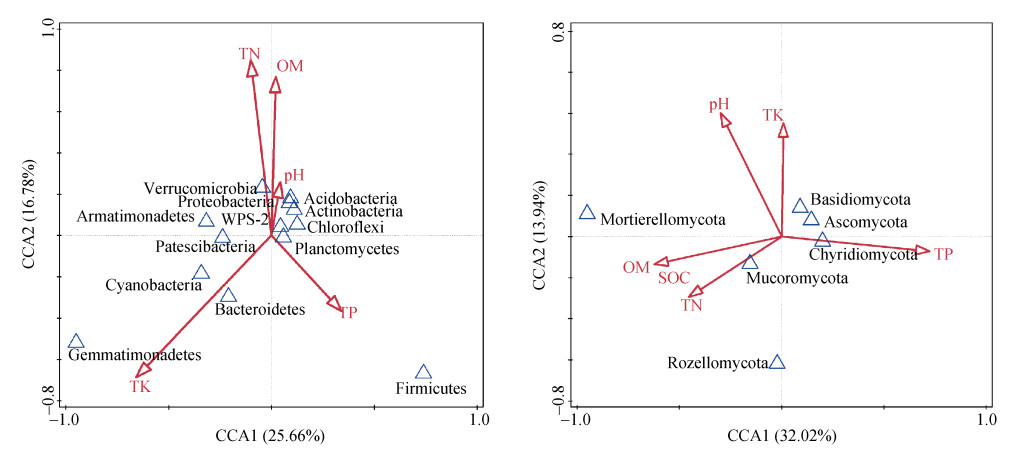
|
注:pH、OM、SOC、TN、TP、TK分别代表土壤酸碱度、土壤有机质、有机碳、全氮、全磷、全钾。 Note: pH, OM, SOC, TN, TP, TK means soil acid value, soil organic matter content, soil organic carbon, total nitrogen content, total phosphorus, total potassium, respectively. 图 3 微生物群落与土壤理化性质的典型对应分析(CCA)图 Fig. 3 Canonical correspondence analysis(CCA)of microbial communities with soil physical-chemical properties |
高通量测序技术是新一代测序技术,能够全面真实的测定微生物的群落特征,在不同地域森林生态系统土壤微生物群落研究中得到广泛应用,如东北黑土乔木林[16]、黄土高原乔木林[17]、喀斯特石漠区桑树林[18]等。近年来,随着土壤生物结皮层逐渐成为研究热点,高通量测序技术也随之应用于土壤生物结皮层微生物群落结构的研究。基于高通量测序的分析结果表明黄土高原土壤生物结皮中的优势细菌群落为酸杆菌们(24.3%)、变形菌门(23.8%)、绿弯菌门(15.8%)和放线菌门(14.5%),而优势真菌群落为子囊菌门(68.0%)和担子菌门(23.8%)[19];腾格里沙漠土壤藻生物结皮层的优势细菌门为蓝细菌(Cyanobacteria)(37.32%)、变形菌门(14.80%)、酸杆菌门(14.01%)、放线菌门(12.58%),而土壤藓生物结皮层的优势细菌门为变形菌门(29.94%)、蓝细菌(16.38%)和放线菌门(11.29%)[20];毛乌素沙地土壤藓生物结皮层优势细菌门为放线菌门(38.52%)和变形菌门(26.01%)[21]。上述研究均位于北方,表明土壤生物结皮层微生物优势群落与土壤类型和土壤生物结皮类型有关。南方红壤区生物结皮层微生物群落的研究尚未见报道,本研究首次揭示红壤生物结皮层微生物群落结构,结果表明红壤生物结皮层优势细菌门是酸杆菌门(27.39%)、变形菌门(25.90%)、放线菌门(16.68%)和绿弯菌门(12.26%),优势真菌门为担子菌门(61.19%)和子囊菌门(29.48%),优势微生物群落与黄土高原土壤生物结皮中优势微生物群落类似,但两种优势真菌门相对丰度占比相反。这可能与植被类型影响担子菌有关[22],黄土高原土壤生物结皮采自于由黑沙蒿、柠条锦鸡儿和沙柳组成的灌木林[19],而本研究土壤生物结皮采自于湿地松林地,湿地松属于外生菌根树种,有利于外生菌根真菌生长于繁殖,外生菌根真菌属于担子菌门、结合菌门和子囊菌门,而以担子菌门最多,因此本研究中担子菌门真菌的相对丰度超过子囊菌门真菌。
3.2 肥力提升措施对红壤生物结皮层微生物数量和多样性的影响土壤中碳氮磷含量是微生物生长的主要来源。研究表明施肥能增加微生物的数量,提高微生物的多样性[9,23],其中有机肥能为土壤微生物生长和繁殖提供大量、多样的土壤养分;石灰能显著改善土壤pH,中和土壤酸性[23];生物炭也能改善土壤酸碱环境,提高微生物活性[24],而微生物肥本身含有大量有益微生物。本研究添加有机肥、生物炭和石灰+微生物肥料三种肥力提升措施均显著提高了土壤生物结皮层可培养真菌数量,但是对可培养细菌数量并无显著影响,主要原因是施肥增加了土壤有机质,有机质的增加更有利于真菌的生长与繁殖[25],且细菌适合生长在微碱性环境中[26],红壤的低pH会限制细菌生长。
香农指数和辛普森指数可用于反映土壤样品中微生物群落多样性,而Chao1指数可反映群落物种丰富度。本研究结果显示有机肥和生物炭提高了细菌多样性和丰富度,而石灰+微生物肥料却降低了细菌丰富度。而对于真菌,生物炭和石灰+微生物肥料降低了其多样性和丰富度。有机肥提高细菌多样性的原因是细菌主要为异养微生物,有机肥提供的养分缓解了细菌类群之间的竞争,此外有机肥本身也携带大量微生物,因此,细菌多样性增加[27-28]。生物炭作为一种土壤改良剂,其提高细菌多样性而降低真菌多样性的原因可能在于提高酸性土壤pH,而高pH有利于细菌,低pH有利于真菌[29]。此外,生物炭中高含量的矿质元素(K+、Ca2+、Mg2+等)或具有抑制真菌生长的有机化合物对真菌具有消极影响,从而导致真菌多样性的降低[30]。石灰+微生物肥料降低细菌和真菌多样性和丰富度的原因可能在于微生物肥料中外源微生物对本土微生物的强竞争作用,也有可能是石灰本身具有一定的干燥和杀菌功能,这需要进一步研究。
3.3 肥力提升措施对红壤生物结皮层微生物群落结构的影响微生物群落结构的变化决定了生态功能的强弱,土壤碳和pH是影响微生物的分布的最主要环境因子[16-17]。研究表明有机肥、生物炭、石灰和微生物肥料均能改变土壤细菌和真菌群落组成[23-24]。变形菌门是土壤中细菌最丰富的门,该门的微生物多为兼性或者专性厌氧及异氧生活微生物,该门中的固氮菌可固定土壤中的氮元素,为碱性土壤中的主要优势群落[17,31]。而绿弯菌门是一类通过光合作用产生能量的细菌,具有兼性厌氧特点,适宜养分含量较低的土壤中[32-33]。本研究中三种肥力提升措施均提高了土壤生物结皮层变形菌门细菌的相对丰度,尤其是有机肥提高幅度达90%以上,均降低了绿弯菌门细菌的相对丰度,主要原因是三种肥力提升措施均能提高土壤pH,缓解红壤酸性环境,提高土壤养分(有机碳和全氮)含量。放线菌门包括许多寡营养细菌,能够分解纤维素和木质素,丰富的放线菌有利于土壤中植物有机物的分解和土壤氮的循环[34]。相关研究表明,有机肥、生石灰和微生物肥料均能降低土壤放线菌的相对丰度[23],生物炭则能提高放线菌的相对丰度[35]。本研究结果显示,仅石灰+微生物肥料明显提高了土壤放线菌门细菌的相对丰度,根据CCA分析结果推测这可能与石灰+微生物肥料显著提高了土壤中有机质和全氮含量有关。酸杆菌门细菌多存在于营养贫瘠的土壤环境中,可以降解植物残体、参与单碳化合物降解,其丰度与碳的可用性呈负相关关系[36]。本研究中有机肥明显降低了土壤生物结皮层酸杆菌门细菌的相对丰度,降幅达53.24%,主要原因是有机肥提供了大量可利用碳源物质,改善了土壤肥力条件,从而降低了酸杆菌相对丰度。大部分研究表明生物炭能降低酸杆菌门细菌的相对丰度[14,35],但本研究结果显示生物炭提高了酸杆菌门细菌的相对丰度,这可能与生物炭施加的量有关。程扬等[37]发现施加5 t·hm–2生物炭后,土壤酸杆菌门细菌相对丰度增加,而施加10 t·hm–2生物炭后,酸杆菌门细菌相对丰度降低。
子囊菌门是含真菌最多的门,具有降解有机物质的作用,一般在有机质含量高的土壤最为丰富[38-39]。本研究结果表明有机肥和石灰+微生物肥料能提高土壤生物结皮层子囊菌门真菌的相对丰度,这与罗俊等[23]的研究结果一致,主要原因是有机肥和石灰+微生物肥料提高了土壤的有机质含量。李发虎等[40]研究发现20~60 t·hm–2的生物炭添加也可显著提高子囊菌门真菌的丰度,本研究添加的生物炭量为12 t·hm–2,却明显降低了子囊菌门的相对丰度,这与朱孟涛等[14]研究结果一致。因此,生物炭对子囊菌门真菌的影响与生物炭施加的量有关。担子菌门是真菌中最高等的一门,种类繁多,包括对植物有益和有害的真菌,其与高稳定性有机组分(纤维素和木质素等)有正相关关系[41]。与罗俊等[23]的研究结果一致,本研究也表明有机肥和石灰+微生物肥料能降低土壤生物结皮层担子菌门真菌的相对丰度。此外,本研究发现生物炭提高了担子菌门真菌的相对丰度,原因可能是生物炭中含有的大量芳香性稳定有机物可能会促进担子菌门真菌的生长与繁殖,因此导致其相对丰度增加。
4 结论南方红壤区低效林大量存在,林下水土流失依然存在。土壤生物结皮在提高土壤肥力、促进养分代谢、提高土壤抗侵蚀能力等方面具有重要作用[42],但其在南方红壤区并未受到足够重视。本研究利用高通量测序技术研究不同肥力提升措施对红壤生物结皮层微生物群落的影响,发现有机肥、生物炭和石灰+微生物肥料对红壤生物结皮层细菌和真菌群落组成和结构均有较大影响,影响程度为有机肥 > 生物炭 > 石灰+微生物肥料。不同肥力提升措施对不同类型的细菌和真菌群落的影响不同,细菌对肥力提升措施的响应要高于真菌。土壤pH、有机质、有机碳和全氮对微生物群落影响较大。因此,在调控森林红壤生物结皮层微生物群落时,应根据所要调控的微生物类型选择合适的肥力提升措施。
| [1] |
Li X R, Zhang Y M, Zhao Y G. A study of biological soil crusts: Recent development, trend and prospect (In Chinese)[J]. Advances in Earth Science, 2009, 24(1): 11-24. DOI:10.3321/j.issn:1001-8166.2009.01.002 [李新荣, 张元明, 赵允格. 生物土壤结皮研究: 进展、前沿与展望[J]. 地球科学进展, 2009, 24(1): 11-24.]
(  0) 0) |
| [2] |
Wang H L, Jia C H, Li L B. Soil crusts and research progress (In Chinese)[J]. Journal of Hebei United University: Natural Science Edition, 2013, 35(2): 107-112. DOI:10.3969/j.issn.2095-2716.2013.02.025 [王华磊, 贾长虹, 李潞滨. 土壤结皮及研究进展[J]. 河北联合大学学报: 自然科学版, 2013, 35(2): 107-112.]
(  0) 0) |
| [3] |
Guo Z L, Cai C F. Research status and hotspots of biological soil crust based on CiteSpace and HistCite (In Chinese)[J]. Science of Soil and Water Conservation, 2019, 17(5): 146-156. [郭忠录, 蔡崇法. 生物土壤结皮研究进展与热点--基于CiteSpace和HistCite计量分析[J]. 中国水土保持科学, 2019, 17(5): 146-156.]
(  0) 0) |
| [4] |
Wu N, Pan B R, Zhang Y M. Effects and ecological significance of soil-inhabiting microorganisms in the formation of biological soil crusts (In Chinese)[J]. Arid Zone Research, 2004, 21(4): 444-450. DOI:10.13866/j.azr.2004.04.031 [吴楠, 潘伯荣, 张元明. 土壤微生物在生物结皮形成中的作用及生态学意义[J]. 干旱区研究, 2004, 21(4): 444-450.]
(  0) 0) |
| [5] |
Mager D M, Thomas A D. Extracellular polysaccharides from cyanobacterial soil crusts: A review of their role in dryland soil processes[J]. Journal of Arid Environments, 2011, 75(2): 91-97. DOI:10.1016/j.jaridenv.2010.10.001
(  0) 0) |
| [6] |
Chen Z, Wu M N, Qin H L, et al. Advances in research on molecular mechanisms of phosphate-solubilizing microorganisms in soil (In Chinese)[J]. Acta Pedologica Sinica, 2009, 46(5): 925-931. DOI:10.3321/j.issn:0564-3929.2009.05.022 [陈哲, 吴敏娜, 秦红灵, 等. 土壤微生物溶磷分子机理研究进展[J]. 土壤学报, 2009, 46(5): 925-931.]
(  0) 0) |
| [7] |
Han M, Li L N, Wei R, et al. Investigation of capacity increment to dissolve phosphate and potassium by blended culture (In Chinese)[J]. Journal of Microbiology, 2010, 30(5): 74-77. DOI:10.3969/j.issn.1005-7021.2010.05.015 [韩梅, 李丽娜, 魏冉, 等. 混合培养提高菌株解磷解钾能力的探讨[J]. 微生物学杂志, 2010, 30(5): 74-77.]
(  0) 0) |
| [8] |
Harris J A. Measurements of the soil microbial community for estimating the success of restoration[J]. European Journal of Soil Science, 2003, 54(4): 801-808. DOI:10.1046/j.1351-0754.2003.0559.x
(  0) 0) |
| [9] |
Hu Y L, Wang S L, Yan S K. Research advances on the factors influencing the activity and community structure of soil microorganism (In Chinese)[J]. Chinese Journal of Soil Science, 2006, 37(1): 170-176. DOI:10.3321/j.issn:0564-3945.2006.01.038 [胡亚林, 汪思龙, 颜绍馗. 影响土壤微生物活性与群落结构因素研究进展[J]. 土壤通报, 2006, 37(1): 170-176.]
(  0) 0) |
| [10] |
Huang Z Q, Xu Z H, Chen C R. Effect of mulching on labile soil organic matter pools, microbial community functional diversity and nitrogen transformations in two hardwood plantations of subtropical Australia[J]. Applied Soil Ecology, 2008, 40(2): 229-239. DOI:10.1016/j.apsoil.2008.04.009
(  0) 0) |
| [11] |
Tamilselvi S M, Chinnadurai C, Ilamurugu K, et al. Effect of long-term nutrient managements on biological and biochemical properties of semi-arid tropical Alfisol during maize crop development stages[J]. Ecological Indicators, 2015, 48: 76-87. DOI:10.1016/j.ecolind.2014.08.001
(  0) 0) |
| [12] |
Xu Y Q, Yan H T, Wang X Q, et al. Effects of mixed application if biochar and organic fertilizers on microbial functional diversity in Tobacco growing Cinnamon soil (In Chinese)[J]. Chinese Tobacco Science, 2020, 41(5): 55-59. [许跃奇, 阎海涛, 王晓强, 等. 生物炭与有机肥配施对褐土烟田微生物功能多样性的影响[J]. 中国烟草科学, 2020, 41(5): 55-59.]
(  0) 0) |
| [13] |
Fang W, Yu X, Wang J, et al. Effects of applying limestone powder and microbial fertilizer on soil chemical properties and microbial community in the diseased Carya cathayensis woodland (In Chinese)[J]. Journal of Zhejiang A & F University, 2020, 37(2): 273-283. [方伟, 余晓, 王晶, 等. 施加石灰石粉和微生物肥料对发病山核桃林土壤化学性质和微生物群落的影响[J]. 浙江农林大学学报, 2020, 37(2): 273-283.]
(  0) 0) |
| [14] |
Zhu M T, Liu X X, Wang J M, et al. Effects of biochar application on soil microbial diversity in soil aggregates from paddy soil (In Chinese)[J]. Acta Ecologica Sinica, 2020, 40(5): 1505-1516. [朱孟涛, 刘秀霞, 王佳盟, 等. 生物质炭对水稻土团聚体微生物多样性的影响[J]. 生态学报, 2020, 40(5): 1505-1516.]
(  0) 0) |
| [15] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [16] |
Liu J J, Sui Y Y, Yu Z H, et al. High throughput sequencing analysis of biogeographical distribution of bacterial communities in the black soils of northeast China[J]. Soil Biology & Biochemistry, 2014, 70: 113-122.
(  0) 0) |
| [17] |
Liu Y, Zeng Q C, Huang Y M. Soil microbial communities by 454 prosequencing under different Arbor forests on the Loess Plateau (In Chinese)[J]. China Environmental Science, 2016, 36(11): 3487-3494. DOI:10.3969/j.issn.1000-6923.2016.11.035 [刘洋, 曾全超, 黄懿梅. 基于454高通量测序的黄土高原不同乔木林土壤细菌群落特征[J]. 中国环境科学, 2016, 36(11): 3487-3494.]
(  0) 0) |
| [18] |
Duan Q Q, Yang X H, Huang X Z. The diversity of microbial resources in ecological mulberry rhizosphere soil in a rocky desertification area (In Chinese)[J]. Journal of Southwest University: Natural Science Edition, 2017, 39(7): 25-29. [段倩倩, 杨晓红, 黄先智. 石漠化地区生态桑林根际土壤微生物资源多样性研究[J]. 西南大学学报: 自然科学版, 2017, 39(7): 25-29.]
(  0) 0) |
| [19] |
Xiao B, Veste M. Moss-dominated biocrusts increase soil microbial abundance and community diversity and improve soil fertility in semi-arid climates on the Loess Plateau of China[J]. Applied Soil Ecology, 2017, 117/118: 165-177. DOI:10.1016/j.apsoil.2017.05.005
(  0) 0) |
| [20] |
Li J Y, Zhang X. Microbial diversity analysis of different biological soil crusts in Tengger desert (In Chinese)[J]. Ecological Science, 2017, 36(3): 36-42. [李靖宇, 张琇. 腾格里沙漠不同生物土壤结皮微生物多样性分析[J]. 生态科学, 2017, 36(3): 36-42.]
(  0) 0) |
| [21] |
Zhang Y H, Zhang S Y, Zhang S H, et al. Effect of moss crust on sandy soil properties and bacterial community in Mu Us sand land (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(6): 1585-1597. [张雨虹, 张韶阳, 张树辉, 等. 毛乌素沙地苔藓结皮对沙化土壤性质和细菌群落的影响[J]. 土壤学报, 2021, 58(6): 1585-1597.]
(  0) 0) |
| [22] |
Bossuyt H, Denef K, Six J, et al. Influence of microbial populations and residue quality on aggregate stability[J]. Applied Soil Ecology, 2001, 16(3): 195-208. DOI:10.1016/S0929-1393(00)00116-5
(  0) 0) |
| [23] |
Luo J, Lin Z L, Li S Y, et al. Effects of different soil improvement measures on soil physicochemical properties and microbial community structures in mechanically compacted acidified sugarcane field (In Chinese)[J]. Acta Agronomica Sinica, 2020, 46(4): 596-613. [罗俊, 林兆里, 李诗燕, 等. 不同土壤改良措施对机械压实酸化蔗地土壤理化性质及微生物群落结构的影响[J]. 作物学报, 2020, 46(4): 596-613.]
(  0) 0) |
| [24] |
Zheng H F, Wu H H, Weng B Q, et al. Improved soil microbial characteristics and enzyme activities with wheat straw biochar addition to an acid tea plantation in red soil (In Chinese)[J]. Soil and Fertilizer Sciences in China, 2019(2): 68-74. [郑慧芬, 吴红慧, 翁伯琦, 等. 施用生物炭提高酸性红壤茶园土壤的微生物特征及酶活性[J]. 中国土壤与肥料, 2019(2): 68-74.]
(  0) 0) |
| [25] |
Xu J W, Wang W D, Li C. The correlation among soil microorganism, enzyme and soil nutrient in different types of mixed stands of Pinus thunbergii (In Chinese)[J]. Journal of Beijing Forestry University, 2000, 22(1): 51-55. [许景伟, 王卫东, 李成. 不同类型黑松混交林土壤微生物、酶及其与土壤养分关系的研究[J]. 北京林业大学学报, 2000, 22(1): 51-55.]
(  0) 0) |
| [26] |
Shen P, Chen X D. Microbiology (In Chinese). 8th ed[M]. Beijing: Higher Education Press, 2016. [沈萍, 陈向东. 微生物学[M]. 第8版. 北京: 高等教育出版社, 2016.]
(  0) 0) |
| [27] |
Xun W B, Huang T, Zhao J, et al. Environmental conditions rather than microbial inoculum composition determine the bacterial composition, microbial biomass and enzymatic activity of reconstructed soil microbial communities[J]. Soil Biology & Biochemistry, 2015, 90: 10-18.
(  0) 0) |
| [28] |
Xu M G, Tang H J, Yang X Y, et al. Best soil managements from long-term field experiments for sustainable agriculture[J]. Journal of Integrative Agriculture, 2015, 14(12): 2401-2404.
(  0) 0) |
| [29] |
Stevens C, Duprè C, Gaudnik C, et al. Changes in species composition of European acid grasslands observed along a gradient of nitrogen deposition[J]. Journal of Vegetation Science, 2011, 22(2): 207-215.
(  0) 0) |
| [30] |
Warnock D D, Lehmann J, Kuyper T W, et al. Mycorrhizal responses to biochar in soil - concepts and mechanisms[J]. Plant and Soil, 2007, 300(1/2): 9-20.
(  0) 0) |
| [31] |
Faoro H, Alves A C, Souza E M, et al. Influence of soil characteristics on the diversity of bacteria in the Southern Brazilian Atlantic Forest[J]. Applied and Environmental Microbiology, 2010, 76(14): 4744-4749.
(  0) 0) |
| [32] |
Fierer N, Bradford M A, Jackson R B. Toward an ecological classification of soil bacteria[J]. Ecology, 2007, 88(6): 1354-1364.
(  0) 0) |
| [33] |
Xun W B, Xiong W, Huang T, et al. Swine manure and quicklime have different impacts on chemical properties and composition of bacterial communities of an acidic soil[J]. Applied Soil Ecology, 2016, 100: 38-44.
(  0) 0) |
| [34] |
Häni H, Siegenthaler A, Candinas T. Soil effects due to sewage sludge application in agriculture[J]. Fertilizer Research, 1995, 43(1/2/3): 149-156.
(  0) 0) |
| [35] |
Ren T B, Yang Y D, Gao W K, et al. Effects of application amount of biochar on soil bacterial community in tobacco fields based on high-throughput sequencing (In Chinese)[J]. Journal of Henan Agricultural Sciences, 2018, 47(12): 64-69. [任天宝, 杨艳东, 高卫锴, 等. 基于高通量测序的生物炭施用量对植烟土壤细菌群落的影响[J]. 河南农业科学, 2018, 47(12): 64-69.]
(  0) 0) |
| [36] |
Chang K T, Weng C I. The effect of an external magnetic field on the structure of liquid water using molecular dynamics simulation[J]. Journal of Applied Physics, 2006, 100(4): 043917.
(  0) 0) |
| [37] |
Cheng Y, Liu Z D, Shen Q B, et al. The impact of straw biochar on corn rhizospheric and non-rhizospheric soil microbial community structure (In Chinese)[J]. Ecology and Environmental Sciences, 2018, 27(10): 1870-1877. [程扬, 刘子丹, 沈启斌, 等. 秸秆生物炭施用对玉米根际和非根际土壤微生物群落结构的影响[J]. 生态环境学报, 2018, 27(10): 1870-1877.]
(  0) 0) |
| [38] |
Guo J J, Liu W B, Zhu C, et al. Bacterial rather than fungal community composition is associated with microbial activities and nutrient-use efficiencies in a paddy soil with short-term organic amendments[J]. Plant and Soil, 2018, 424(1/2): 335-349.
(  0) 0) |
| [39] |
Rousk J, Brookes P C, Bååth E. Fungal and bacterial growth responses to N fertilization and pH in the 150-year 'Park Grass' UK grassland experiment[J]. FEMS Microbiology Ecology, 2011, 76(1): 89-99.
(  0) 0) |
| [40] |
Li F H, Li M, Liu J Q, et al. Effect of biochar on fungal abundance of rhizosphere soil and cucumber root growth in greenhouse (In Chinese)[J]. Transactions of the Chinese Society for Agricultural Machinery, 2017, 48(4): 265-270. [李发虎, 李明, 刘金泉, 等. 生物炭对温室黄瓜根际土壤真菌丰度和根系生长的影响[J]. 农业机械学报, 2017, 48(4): 265-270.]
(  0) 0) |
| [41] |
Lopes A R, Manaia C M, Nunes O C. Bacterial community variations in an alfalfa-rice rotation system revealed by 16S rRNA gene 454-pyrosequencing[J]. FEMS Microbiology Ecology, 2014, 87(3): 650-663.
(  0) 0) |
| [42] |
Zhang B C, Wu Z F, Li B. Progress and prospect of biological soil crusts in Loess Plateau (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(5): 1123-1131. [张丙昌, 武志芳, 李彬. 黄土高原生物土壤结皮研究进展与展望[J]. 土壤学报, 2021, 58(5): 1123-1131.]
(  0) 0) |
 2023, Vol. 60
2023, Vol. 60


