2. 中国科学院西北高原生物研究所, 西宁 810008;
3. 中国科学院大学, 北京 100049
2. Northwest Institute of Plateau Biology, Chinese Academy of Sciences, Xining 810008, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
青藏高原在维护我国乃至亚洲生态系统的生态安全发挥着重要的屏障保护作用[1]。近年来,在全球气候变化和人类活动的共同影响下,青藏高原各类生态系统的结构和功能正发生着一系列的变化。占有主体地位的高寒草地已在局部地区发生了以植被盖度降低、优良牧草比例和草地生产力下降、土壤贫瘠化、土地沙化等为典型特征的草地退化,一些地区甚至出现了完全沙化的极端退化现象[2]。高寒草地是典型的生态脆弱区,其草地生物量低,生态系统抵抗力和恢复力弱,易受到外界因素干扰。因此,其草地退化所引起的生态环境效应尤为严重,特别是导致了生物多样性的损失、水土流失的加剧和草畜矛盾的加深,从而严重威胁到区域畜牧业经济发展和生态安全与稳定[1]。针对高寒草地的退化问题,已有一些学者研究了退化过程中植被群落结构、土壤理化属性以及可培养土壤微生物数量的变化[3-4]。也有一些学者从生态恢复的角度探讨了如何进行人工植被重建的方法和策略[5-6]。这些研究主要关注植物群落的演变、土壤肥力的改善、草地生产力的提升等方面,有关土壤微生物群落特征(生物量、多样性和群落结构)的研究较少,尤其是草地退化和不同植被恢复措施效果的对比研究更为稀缺,对高寒草地土壤微生物群落演变的主要驱动因子和机制还缺乏认知。
土壤真菌在草地生态系统的物质循环和能量流动各环节中发挥着不可或缺的生态作用[7-8],它们通过分解植物凋落物等过程参与土壤有机质的形成与转化,从而提高土壤养分水平。因此,真菌群落特征能够间接地反映土壤的养分状况,常被用于评价生态系统的健康状况[9-10]。真菌群落对生境的变化非常敏感,其生物量和多样性往往与温度、土壤水分、养分、化学计量特征(如C: N)、植物群落等多种环境因素密切相关。在寒冷生态系统中,地表气温能够影响液态水的可利用性,是影响真菌群落多样性和结构的重要因素;温度的高低也与真菌的代谢活动强度息息相关,会影响微生物的生活史策略[11]。同时,植物也能通过根际分泌物对土壤真菌群落的结构和组成产生调节作用[12-13]。高寒草地的退化过程是土壤和植被系统的协同变化,往往伴随着不同程度的植被盖度降低、植物物种减少、土壤含水量下降、养分状况恶化、土壤机械组成的改变等;相反,生态恢复过程则由于植物的定殖,凋落物、根系及其分泌物向土壤中的输入增多,土壤养分水平得以提升,土壤水分蒸散量减少导致水分状况得以改善[14]。这些生物和非生物环境因子的显著变化,必然会导致土壤真菌群落特征发生改变。但是,在以低温为主要特征的高寒草地,土壤和植被特征在沙化和植被恢复过程中真菌群落结构构建的影响程度如何尚未得知。
本文采用实时荧光定量PCR(Quantitative real-time PCR)和Illumina MiSeq高通量测序技术,对比研究了天然草地、沙化草地、草本人工草地和人工灌丛植被四种不同草地类型的土壤真菌群落的生物量、多样性和结构,以评估不同植被恢复措施对沙化草地土壤真菌群落的恢复效果;并基于真菌群落与植被和土壤属性之间的关系,揭示影响土壤真菌群落构建的关键因素及其贡献量,为青藏高原高寒草地土壤真菌群落的保护和退化草地的恢复与治理提供微生物学方面的科学依据。
1 材料与方法 1.1 研究区概况研究地位于青海省贵南县过马营镇(35°48′N,101°6′E),平均海拔3 107 m。该地区属高原大陆性气候,年平均气温2.3℃,年均降水量391 mm,主要集中在6—9月份,年蒸发量大于1 300 mm。土壤以栗钙土为主,天然植被为以早熟禾(Poa annua)、丛生黄耆(Astragalus confertus)、矮嵩草(Kobresia humilis)和多色苦荬(Ixeris chinensis)为优势种的高寒草地。自20世纪80年代起,局部地表出现了沙化现象。当地从20世纪末陆续用早熟禾和丛生黄耆等草本或以柠条(Caragana korshinsk)为主的灌木对沙化草地进行了人工恢复与重建。迄今为止,恢复草地在植被群落特征和土壤理化属性均发生了显著变化,尤其是植被盖度、多样性及地上生物量显著增加,土壤水分和养分水平显著提高[15]。
1.2 样地设置和样品采集2020年7月,选取位于同一坡面的天然草地(NG)、沙化草地(DG)、草本人工草地(AG)和人工灌丛植被(AS)四个草地类型为试验样地,其中,AG和AS为1998年建植。在每个试验样地设置1条100 m的样线,沿样线每隔10 m设置1个100 m2(10 m×10 m)的样方,每个样地共5个100 m2的样方。沿100 m2样方对角线均匀设置3个1 m2(1 m×1 m)的样方,调查1 m2样方内的草本和100 m2样方内的灌木盖度(Plant coverage,PC)和物种组成,并刈割植物地上部分,在80℃下烘干后称重,作为地上生物量(Aboveground biomass,ABs)。从每个1 m2样方的四个角和中心点钻取0~10 cm的土壤,同一个100 m2样方的土壤样品混合为1个样品。用环刀(100 cm3)采集1 m2样方内0-10 cm的土壤,带回实验室后80℃下烘干称重,测定其土壤容重(Bulk density,BD)。所有采集的土壤样品在实验室内过2 mm筛后充分混合,人工捡出植物根系等杂物后,分为三份。一份用于土壤水分(Soil moisture,SM)的测定和无机氮的提取;另一份在室内自然风干,用于土壤理化性质的测定;剩余土壤样品在–20℃下保存,用于DNA的提取、qPCR和Illumina MiSeq测序。植被群落特征和土壤理化属性的测定方法及其结果参见王亚妮等[15]。
1.3 土壤DNA提取与qPCR采用E.Z.N.A.® soil DNA试剂盒(Omega Bio-tek,美国)提取土壤样品中的总DNA。用1%的琼脂糖凝胶电泳和Nanodrop®ND-2000紫外分光光度计(NanoDrop Technologies,美国)测定260/ 280 nm和260/230 nm的吸光值来检测DNA纯度和浓度。提取的DNA稀释后保存于TE缓冲液中(10 mmol·L–1 Tris-HCl,1 mmol·L–1 EDTA,pH 8.0),并保存在–20℃下备用。
采用StepOne实时荧光PCR仪(ABI 7500,Applied Biosystems,美国)测定真菌ITS基因的绝对丰度,其扩增引物分别为ITS1(5′-CTTGGTCA TTTAGAGGAAGTAA-3′)和ITS2(5′-TGCGTTC TTCATCGATGC-3′)。20 μL的反应体系由10 μL高灵敏性染料法定量PCR检测试剂(Vazyme Biotech Co.,Ltd,中国)、正向和反向引物各0.8 μL(5 μmol·L–1)、1 μL DNA模板和7.4 μL等离子水组成。扩增条件为95℃下预变性5 min,95℃下40个循环30 s,58℃下退火30 s,72℃下延伸1 min。标准曲线由含有扩增子引物和一组含有质粒10倍系列的稀释液构建,真菌ITS基因拷贝数由回归方程中的转换拐点(Ct)和已知的标准曲线中的拷贝数计算得到。
1.4 PCR扩增和Illumina MiSeq测序用与qPCR相同的引物构建真菌群落的基因文库。以10 ng DNA样品为模板在GeneAmp® 9700 PCR仪(Applied Biosystems,美国)上扩增真菌ITS基因。反应体系包括4 μL FastPfu Buffer溶液、2 μL dNTPs(2.5 mmol·L–1)、正向和反向引物各0.8 μL(5 μmol·L–1)、0.4 μL FastPfu聚合酶、10 ng DNA模板,加等离子水至20 μL。扩增条件为95℃预变性3 min,95℃变性30 s,循环35次,55℃下退化30 s,72℃下退火45 s,72℃下延伸10 min。用2%的琼脂糖凝胶和AxyPrep DNA凝胶试剂盒回收PCR产物(Axygen Biosciences,美国),用QuantiFluor™-ST微型荧光剂进行定量(Promega Corporation,美国)。纯化后的PCR产物混合后在Illumina MiSeq高通量测序平台上(Illumina,美国)从两端进行测序,测序工作由上海美吉生物科技有限公司完成。原始测序数据已上传到NCBI(https://www.ncbi.nlm.nih.gov/)SRA数据库,收录号为SRP311564。
1.5 数据处理与统计分析采用FLASH、Trimmomatic软件对测序数据的原始序列进行去杂和质控过滤以获得优化序列。使用UPARSE软件(7.1版,http://drive5.com/uparse/)对有效序列以97%的相似度进行聚类分析生成操作分类单位(OTUs)。使用BLAST软件与NCBI中的GenBank数据库比较进行分类。使用R语言(V 3.4.3)分析Illumina MiSeq测序数据,用Sobs、Shannon-Wiener、Ace、Chao1指数和Faith谱系多样性指数(phylogenetic diversity,PD)衡量真菌群落的α多样性。采用基于Bray-Curtis距离的非度量多维尺度分析(NMDS)判定不同草地类型之间真菌群落结构的相似性(β多样性)。采用SPSS 22.0单因素方差分析在门和纲水平上检验不同真菌类群相对丰度的显著性差异及FUNGuild真菌功能注释结果的差异。采用Spearman相关、Mantel tests、典范对应分析法(CCA)和方差分解分析法(VPA)分析真菌群落α多样性和群落结构与植被群落和土壤属性之间的关系。通过R语言中的Permutest分析来检测环境因子相关显著性,利用FUNGuild进行土壤真菌功能注释。
2 结果 2.1 土壤真菌基因丰度和群落多样性四个草地类型中DG真菌基因拷贝数显著低于NG和AS(P < 0.05),AG、AS与DG三个样地之间差异不显著(图 1a)。DG土壤真菌群落的Sobs、Shannon、Ace、Chao1和PD多样性指数最低,分别较NG降低了91.8%、27.0%、85.2%、92.3%和92.9%。AG和AS土壤真菌群落α多样性指数均显著高于DG,但与NG差异不显著(表 1)。NG、DG与AS和AG的真菌群落明显相互分离(P= 0.001),而AS和AG群落结构的距离较近,AG与NG之间的距离较AS与NG之间的距离相对更近(图 1b),表明四种草地类型之间的土壤真菌群落结构存在显著差异,AG和AS之间较其他样地更为相似,AG和NG的真菌群落结构较AS和NG更为相似。

|
注:NG,天然草地;DG,沙化草地;AG,草本人工草地;AS,人工灌丛植被。*表示不同草地类型之间有显著差异(P < 0.05)。 Note: NG, natural grassland; DG, desertified grassland; AG, herb-based artificial grassland; AS, shrub-based artificial grassland.*dominate significant difference between different grasslands at the P < 0.05 level. 图 1 不同草地类型土壤真菌基因拷贝数(a)和NMDS(b)分析 Fig. 1 Soil fungal genes copy number(a)and NMDS(b)in different alpine grasslands |
|
|
表 1 土壤真菌群落α多样性指数 Table 1 The α-diversity indices of soil fungal community in different alpine grasslands |
Ilumina Miseq测序共获得744 780条有效序列,聚类得到2 062个OTU。其中,59个OTU为四种草地类型所共有,NG、DG、AG和AS特有436、43、356和349个OTU(图 2a)。所有OTU分属于13个门、38个纲、96个目、210个科和444个属。其中,子囊菌门(Ascomycota)占绝对优势,其平均相对丰度为82.9%(73.5%~91.3%),担子菌门(Basidiomycota)次之,其平均相对丰度为9.1%(4.9%~20.0%);其他真菌门的相对丰度都比较低,未分类门(unclassified_k_Fungi)、被孢霉门(Mortierellomycota)和壶菌门(Chytridiomycota)的平均相对丰度仅为4.7%、2.0%和0.8%(图 2b)。
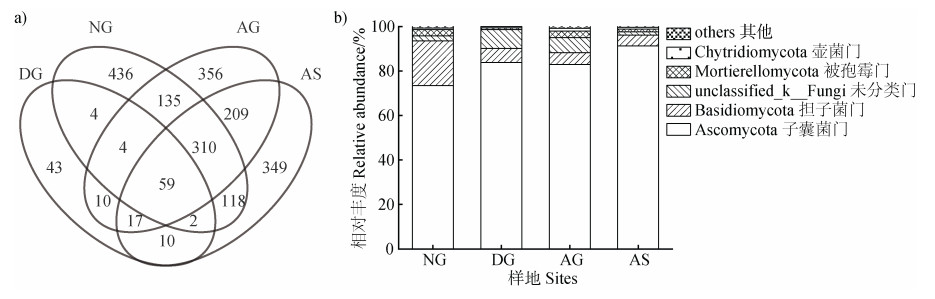
|
图 2 不同草地类型土壤真菌群落Venn图(a)和门水平组成(b) Fig. 2 Venn plot(a)and composition of soil fungal community(b)in different alpine grasslands |
如图 3所示,在所有真菌门和前15个优势真菌纲中,有5个门和8个纲的真菌相对丰度在不同草地类型之间存在差异显著(P < 0.05)。草地沙化后,担子菌门的相对丰度显著下降了68.5%;大多数稀有真菌门(相对丰度 < 1%),如被孢霉门和其他门真菌的相对丰度显著降低或趋于消失(P < 0.05),而未分类真菌门相对丰度显著增加;在纲分类水平上,粪壳菌纲(Sordariomycetes)的相对丰度较NG显著(P < 0.05)增加了2.9倍,而伞菌纲(Agaricomycetes)、散囊菌纲(Eurotiomycetes)、被孢霉纲(Mortierellomycetes)分别显著(P < 0.05)降低了76.8%、82.4%和70%。与DG相比,AG和AS中的子囊菌门和担子菌门的相对丰度变化不大;AG中的被孢霉门、锤舌菌纲(Leotiomycetes)和被孢霉纲的相对丰度分别显著(P < 0.05)增加了1.4倍、9.1倍和2.6倍;AS中的粪壳菌纲和未分类真菌纲(unclassified_k_Fungi)的相对丰度显著(P < 0.05)下降了59.3%和83.0%,而座囊菌纲和锤舌菌纲分别显著(P < 0.05)增加了2.7倍和6.1倍。AG中担子菌门、伞菌纲和散囊菌纲以及AS中的伞菌纲、散囊菌纲和被孢霉纲的相对丰度显著低于NG,而AG未分类真菌纲的相对丰度则显著高于NG。两种人工植被类型相比,AG中的未分类真菌门、被孢霉门、被孢霉纲和未分类真菌纲的相对丰度显著(P < 0.05)高于AS(1.3倍~3.7倍)。
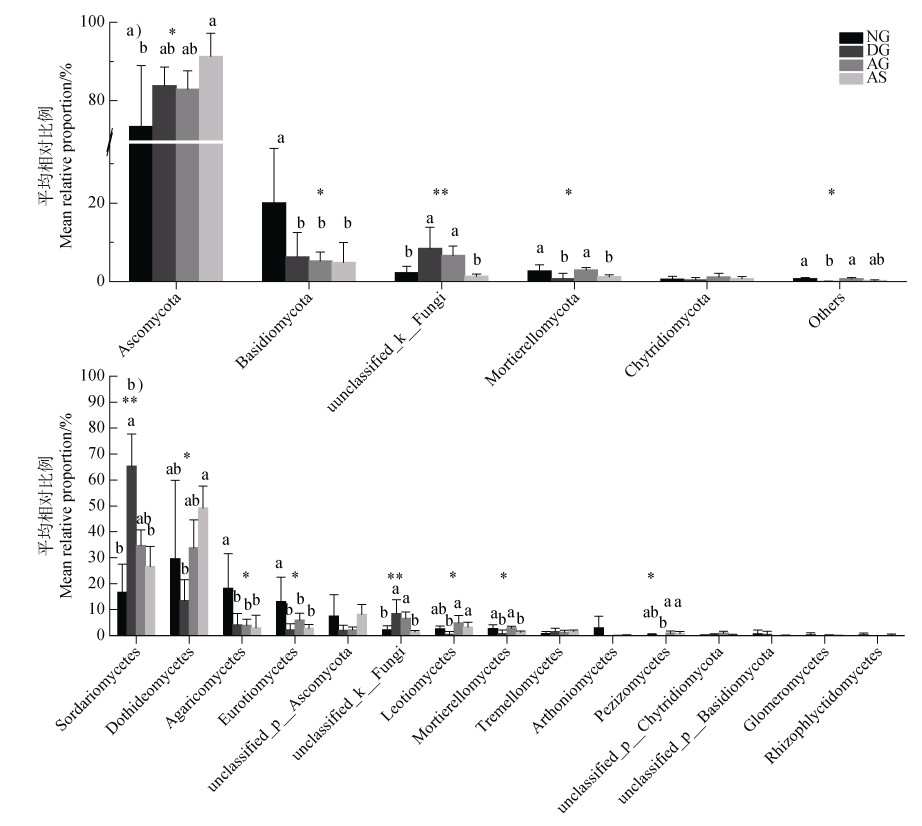
|
注:Ascomycota:子囊菌门;Basidiomycota:担子菌门;unclassified_k__Fungi:未分类门;Mortierellomycota:被孢霉门;Chytridiomycota:壶菌门;Others:其他门类;Sordariomycetes:粪壳菌纲;Dothideomycetes:座囊菌纲;Agaricomycetes:伞菌纲;Eurotiomycetes:散囊菌纲;unclassified_p_Ascomycota:子囊菌门未分类纲;unclassified_k_Fungi:未分类真菌纲;Leotiomycetes:锤舌菌纲;Mortierellomycetes:被孢霉纲;Tremellomycetes:银耳纲;Arthoniomycetes:星裂菌纲;Pezizomycetes:盘菌纲;unclassified_p_Chytridiomycota:壶菌门未分类纲;unclassified_p_Basidiomycota:担子菌门未分类纲;Glomeromycetes:球囊菌纲;Rhizophlyctidomycetes:当前中文未命名纲。*和**分别代表的是P < 0.05,P < 0.01;不同小写字母表示同一门和纲的真菌相对比例在不同草地类型之间差异显著。 Note: * and ** represent significant difference s at P < 0.05 and P < 0.01, respectively; Different lowercase letters represent a significant difference in relative abundance for the same fungal phylum and class between grasslands. 图 3 不同草地类型土壤真菌门(a)和15个最优势真菌纲(b)相对丰度差异比较 Fig. 3 Comparisons of relative abundance of soil fungal communities at the phylum(a)and top 15 classes(b)in different alpine grasslands |
利用FUNGuild对土壤真菌群落进行功能注释(图 4),根据营养方式将真菌群落大体上分为病理型、腐生型和共生型三类。其中,病理-共生型、腐生-病理-共生型、腐生-共生型、共生型真菌及未定型在4个草地类型间的相对丰度存在显著差异(P < 0.05)。相比于DG和NG,AG中的病理-共生型真菌相对丰度极显著增加(P < 0.01),AG和AS显著提高了共生型真菌的相对丰度(P < 0.01);与NG相比,DG和人工恢复植被重建(AG和AS)显著降低了病理-腐生-共生型真菌的相对丰度;DG和AS显著降低了腐生-共生型真菌(P < 0.05)。

|
图 4 不同草地类型土壤真菌群落功能结构 Fig. 4 Functional structure of soil fungal communities in different alping grasslands |
真菌群落的Sobs、Ace、Chao1和PD多样性指数与PC、PR、PS、TN、TOC、EC和Nitrate极显著(P < 0.01)正相关,而与BD和铵态氮显著(P < 0.05)负相关;真菌群落Shannon指数仅与PC和硝态氮极显著(P < 0.01)正相关,与其他指标不相关。由此可见,高寒草地土壤真菌群落的α多样性与植被群落特征和土壤属性密切相关(表 2)。
|
|
表 2 真菌α多样性指数与植被和土壤属性的Spearman相关性 Table 2 Spearman correlations of fungal α-diversity indices with vegetation and soil properties |
Mental检验发现,真菌群落结构与大多数植被群落和土壤属性指标显著(P < 0.05)正相关,但与TP、AP和铵态氮不相关。其中,真菌群落结构与EC和BD的相关性最强,其r值分别为0.70和0.64,与AK的相关性最弱(r=0.24)。CCA分析其第一轴(CCA1)和第二轴(CCA2)共解释了21.4%的真菌群落结构变化(图 5a)。VPA分析结果发现,植被属性(PR、PC、PS和ABs)、土壤化学属性(TC、TN、AP、AK和硝态氮)和土壤物理属性(SM、BD、pH和EC)对土壤真菌群落结构的解释度分别为18.6%、29.0%和17.2%,三者结合共解释了50.0%的真菌群落结构变化(图 5b)。

|
注:PC:植被盖度;PR:物种丰富度;PS:香农指数;ABs:地上生物量;SM: 土壤水分;BD:容重;EC:电导率;TOC:总有机碳;TN:全氮;TP:全磷;AP:有效磷;AK:速效钾;Nitrate:硝态氮;Ammonia:铵态氮;C:土壤化学属性;P:土壤物理属性;V:植被属性。**代表P < 0.01。 Note: PC: plant coverage; PR: plant richness; PS: plant Shannon index; ABs: aboveground biomass; SM: soil moisture; BD: bulk density; EC: electrical conductivity; TOC: total organic carbon; TN: total nitrogen; TP: total phosphorus; AP: available phosphorus; AK: available potassium; Nitrate: nitrate nitrogen; Ammonia: ammonia nitrogen; C: soil chemical properties; P: soil physical properties; V: vegetation properties. ** represents significant difference at P < 0.01. 图 5 土壤真菌群落结构与植被(V)、土壤物理属性(P)和化学属性(C)之间的CCA(a)和VPA(b)分析 Fig. 5 Correlations of soil fungal community structure with vegetation(V), soil physical(P)and soil chemical(C)properties based on CCA(a)and VPA(b) |
高寒草地沙化显著降低了土壤真菌群落的生物量和α多样性(图 1),表明高寒草地极端退化导致了土壤真菌数量的严重衰退和物种的丧失,这一结果与蒋永梅等[16]对退化高寒草地的研究报道一致。本研究中土壤真菌群落的多样性与植被属性(盖度、多样性和地上生物量)和土壤养分(TOC、TN等)显著正相关,而与土壤容重显著负相关(表 2),表明沙化后真菌群落α多样性的显著下降与高寒草地植被盖度、多样性及其生物量的锐减、土壤养分条件的恶化和土壤干旱化密切相关。一般而言,植被丰富度越高,土壤真菌群落的丰富度和多样性也会越高[17]。一方面,由于不同植物通过产生不同种类和数量的根系分泌物及凋落物为真菌的生长和繁殖提供了底物,从而影响其数量和丰富度[18],另一方面,植被越丰富,菌根真菌与其根系共生的机会越大,种间合作提高了共生真菌的竞争能力,进而促进了真菌群落的多样性[10]。此外,土壤养分状况及水分含量对土壤真菌群落的组成和多样性变化也具有重要的驱动作用,有研究发现真菌群落多样性与可利用有机物的含量存在正相关关系[17,19]。本研究中,沙化草地几乎没有植被覆盖,基本断绝了凋落物和根系分泌物向土壤中输入有机质的途径,导致部分真菌因营养和能量的匮乏而使其生物量和多样性显著降低;植物根系的匮乏也可能减少了能与其共生的一些菌根真菌的丧失。同时,由于草地的水分涵养能力下降,土壤可侵蚀性增加,导致营养物质流失严重,这也加剧了真菌群落数量的减少和物种的消失,尤其是一些稀有真菌(相对丰度 < 1%)趋于消失(图 3)。同时,土壤容重的增加也会导致土壤中氧气含量的降低,可能在一定程度上限制了真菌的生长与繁殖。
类似于之前其他高寒地区的相关报道[20],天然草地土壤真菌的优势门类为子囊菌门和担子菌门(图 2)。研究发现担子菌门是木质化植物残体的主要分解者,多富集于土壤养分丰度的环境中[21-22]。因此,天然草地沙化后,随着植被的退化及土壤养分的流失,其相对丰度显著降低。粪壳菌纲是子囊菌门中除了座囊菌纲之外最大的纲,其中的大多数物种是植物、节肢动物及哺乳动物的病原真菌[23]。草地沙化后,粪壳菌纲真菌的相对丰度显著增加(P < 0.01,图 4),预示着天然草地在沙化过程中可能因病虫害的发生而加速了高寒草地植被的退化和沙化。
3.2 植被恢复与土壤真菌群落结构人工植被重建22年后,土壤真菌群落的生物量和α多样性基本恢复到天然草地的水平(图 2)。这一结果反映出沙化高寒草地土壤真菌群落具有较好的恢复力,也说明人工植被重建是治理和恢复沙化草地的有效措施,但其土壤真菌基因丰度和多样性的恢复仍需要近20年的一个漫长时期。然而,无论是利用草本植物还是灌木物种进行恢复,其土壤真菌群落结构依旧与天然草地具有明显差异(图 1b),表明草地沙化将会导致土壤真菌群落结构发生一些不可逆的变化,即使在植被恢复多年后依然难以得到完全恢复。NMDS结果(图 1b)还显示草本人工草地与天然草地的相似性相比于人工灌丛植被更高,说明用草本植物进行沙化草地的恢复与治理较灌木物种对土壤真菌群落的恢复效果更好。人工植被重建后,子囊菌门和担子菌门的相对丰度没有显著改变,这一结果与尹亚丽等[24]在退化高寒草甸进行人工补播10年后土壤真菌群落的变化并不一致。其原因可能是二者之间在草地类型和恢复时间两方面均有所不同,本研究地属于高寒草原,其土壤真菌群落结构有别于高寒草甸,人工植被建立在完全沙化的高寒草原,而尹亚丽等的研究则基于与中度退化草甸之间的比较;同时,本研究中的真菌群落的演变是人工植被建立22年后的结果,较尹亚丽等人工补播的恢复时间更为长久。因此,今后还需要在更长时间尺度上研究土壤真菌群落结构的演变过程和构建机理。
从功能结构而言,沙化和人工植被重建后草地真菌群落的功能结构发生了明显的改变(图 4),表明草地退化和人工植被重建构建了全新的土壤真菌群落的生态功能。在沙化草地进行人工植被重建后,植物的定殖促进了共生型真菌相对丰度的显著增加。人工草本草地中较高的病理-共生型真菌相对丰度暗示了单一结构的人工草地较天然草地更容易发生病理型共生真菌的病害。天然草地中腐生-共生真菌在沙化和人工植被重建后其相对丰度降低,表明土壤真菌对凋落物和有机质的分解能力可能下降。
3.3 土壤真菌群落的主要影响因子植被和土壤通过多种相互作用共同影响土壤真菌群落的多样性。本研究中,土壤真菌群落多样性与大多数植被和土壤属性指标显著正相关(表 2),预示着保护青藏高原高寒草地的植被和土壤对维护其土壤真菌群落的完整性具有重要的生态意义。从植被属性来讲,由于真菌寄主特异性[25]和资源多样性[26]随着植物多样性增加而增加,真菌群落多样性则随之增大。硝态氮与真菌群落多样性(Shannon)之间以及全氮和电导率与真菌群落丰富度(Sobs、Ace、Chao1)之间显著正相关,而土壤容重与土壤真菌群落丰富度显著负相关。这与其他研究报道类似[27-29],反映了高寒草地土壤真菌多样性与土壤理化性质的密切相关性。此外,一些学者认为土壤水分也是影响土壤真菌群落多样性的主要因素,它能够影响菌丝的延展及细胞膜的物质扩散和吸收[15,30],也能影响固氮微生物的固氮作用[31],尤其在荒漠地区的影响极为显著。在本研究中,土壤水分与真菌群落丰富度(Ace、Chao1)和谱系多样性(PD指数)极显著正相关(表 2),这表明土壤水分也是制约该区域高寒草地土壤真菌群落多样性恢复的重要因子。
土壤真菌群落结构与大部分植被和土壤属性显著正相关(表 3)。其中,电导率与真菌群落结构相关性最强,其次为土壤容重和植被属性(植被盖度、丰富度、Shannon指数)。这一结果表明土壤盐分对土壤真菌群落结构有明显的影响。有研究认为,真菌群落的组成和功能更多是由气候和土壤预测因子来决定,而C: N所表征的土壤养分有效性在寒冷生态系统中具有很强预测性[32]。草地退化和恢复过程中,土壤C: N的变化与真菌群落多样性和结构之间的关系还需进一步研究。与草地沙化相反,人工草地植物定殖后其根系的增加不仅为真菌的定居和繁殖提供了必需的营养条件,在根系作用下土壤容重的下降也创造了良好的土壤通气状况,有利于菌根真菌子实体的产生[33]。在人工植被建植后,其他植物逐渐开始定殖而使植物多样性增加,植物凋落物、根系及其分泌物的数量和种类明显提升,为土壤真菌群落的生理代谢过程提供了大量而丰富的C、N源以及一些低分子量糖类、氨基酸、羧酸类等其它底物,因而促进了土壤及不同根际真菌群落的定居和繁殖[34]。此外,本文中土壤化学性质对真菌群落结构的解释度高于植被属性和土壤物理属性(图 5b),说明土壤养分水平较植被群落和土壤物理属性在更大程度上影响土壤真菌的群落结构。
4 结论高寒草地沙化后,随着植被的消失、土壤养分水平的下降和土壤趋于干旱,土壤真菌群落的生物量和多样性显著降低。人工植被重建则有效地促进了沙化高寒草地土壤真菌丰度和多样性的恢复,22年后基本达到了天然草地的水平。人工植被重建促使沙化草地土壤真菌群落向天然草地演变,但22年后其群落结构与天然草地的相似度仍不高。草本人工草地与天然草地之间的真菌群落结构比人工灌丛植被更为相似,表明利用草本植物进行沙化草地的治理与恢复比灌木物种更有利于土壤真菌群落的恢复。土壤真菌群落的多样性与植被和土壤指标的关系因多样性指数的不同而异,而其群落结构与大多数植被和土壤指标显著正相关。相比而言,土壤化学属性对真菌群落结构的解释度比土壤物理属性和植被属性单独的解释度更高,表明其对土壤真菌群落结构的变化具有相对更重要的影响。
| [1] |
Sun H L, Zheng D, Yao T D, et al. Protection and construction of the national ecological security shelter zone on Tibetan Plateau (In Chinese)[J]. Acta Geographica Sinica, 2012, 67(1): 3-12. [孙鸿烈, 郑度, 姚檀栋, 等. 青藏高原国家生态安全屏障保护与建设[J]. 地理学报, 2012, 67(1): 3-12.]
(  0) 0) |
| [2] |
Zhou H K, Zhao X Q, Zhou L, et al. A study on correlations between vegetation degradation and soil degradation in the 'Alpine Meadow' of the Qinghai-Tibetan Plateau (In Chinese)[J]. Acta Pratacultural Science, 2005, 14(3): 31-40. DOI:10.3321/j.issn:1004-5759.2005.03.005 [周华坤, 赵新全, 周立, 等. 青藏高原高寒草甸的植被退化与土壤退化特征研究[J]. 草业学报, 2005, 14(3): 31-40.]
(  0) 0) |
| [3] |
Cai X B, Peng Y L, Wei S Z, et al. Variation of organic carbon and humus carbon in alpine steppe soil and functions of microorganisms therein (In Chinese)[J]. Acta Pedologica Sinica, 2014, 51(4): 834-844. [蔡晓布, 彭岳林, 魏素珍, 等. 高寒草原土壤有机碳与腐殖质碳变化及其微生物效应[J]. 土壤学报, 2014, 51(4): 834-844.]
(  0) 0) |
| [4] |
Hao A H, Xue X, Peng F, et al. Different vegetation and soil degradation characteristics of a typical grassland in the Qinghai-Tibetan Plateau (In Chinese)[J]. Acta Ecologica Sinica, 2020, 40(3): 964-975. [郝爱华, 薛娴, 彭飞, 等. 青藏高原典型草地植被退化与土壤退化研究[J]. 生态学报, 2020, 40(3): 964-975.]
(  0) 0) |
| [5] |
Zhang Q, Ma L, Zhang Z H, et al. Ecological restoration of degraded grassland in Qinghai-Tibet alpine region: Degradation status, restoration measures, effects and prospects (In Chinese)[J]. Acta Ecologica Sinica, 2019, 39(20): 7441-7451. [张骞, 马丽, 张中华, 等. 青藏高寒区退化草地生态恢复: 退化现状、恢复措施、效应与展望[J]. 生态学报, 2019, 39(20): 7441-7451.]
(  0) 0) |
| [6] |
Ma Y S, Zhang Z H, Dong Q M, et al. Application of restoration ecology in 'black soil type' degraded grassland rebuilding (In Chinese)[J]. Journal of Gansu Agricultural University, 2007, 42(2): 91-97. DOI:10.3969/j.issn.1003-4315.2007.02.021 [马玉寿, 张自和, 董全民, 等. 恢复生态学在"黑土型"退化草地植被改建中的应用[J]. 甘肃农业大学学报, 2007, 42(2): 91-97.]
(  0) 0) |
| [7] |
Legay N, Baxendale C, Grigulis K, et al. Contribution of above- and below-ground plant traits to the structure and function of grassland soil microbial communities[J]. Annals of Botany, 2014, 114(5): 1011-1021. DOI:10.1093/aob/mcu169
(  0) 0) |
| [8] |
Murugan R, Loges R, Taube F, et al. Changes in soil microbial biomass and residual indices as ecological indicators of land use change in temperate permanent grassland[J]. Microbial Ecology, 2014, 67(4): 907-918. DOI:10.1007/s00248-014-0383-8
(  0) 0) |
| [9] |
Deacon L J, Janie Pryce-Miller E, Frankland J C, et al. Diversity and function of decomposer fungi from a grassland soil[J]. Soil Biology & Biochemistry, 2006, 38(1): 7-20.
(  0) 0) |
| [10] |
Wang F, BAU T. Research advances in the diversity of soil fungi (In Chinese)[J]. Journal of Fungal Research, 2014, 12(3): 178-186. [王芳, 图力古尔. 土壤真菌多样性研究进展[J]. 菌物研究, 2014, 12(3): 178-186.]
(  0) 0) |
| [11] |
Newsham K K, Hopkins D W, Carvalhais L C, et al. Relationship between soil fungal diversity and temperature in the maritime Antarctic[J]. Nature Climate Change, 2016, 6(2): 182-186. DOI:10.1038/nclimate2806
(  0) 0) |
| [12] |
Peay K G, Baraloto C, Fine P V. Strong coupling of plant and fungal community structure across western Amazonian rainforests[J]. The ISME Journal, 2013, 7(9): 1852-1861. DOI:10.1038/ismej.2013.66
(  0) 0) |
| [13] |
Broeckling C D, Broz A K, Bergelson J, et al. Root exudates regulate soil fungal community composition and diversity[J]. Applied and Environmental Microbiology, 2008, 74(3): 738-744. DOI:10.1128/AEM.02188-07
(  0) 0) |
| [14] |
Shui W, Bai J P, Jian X M, et al. Changes in water conservation and soil physicochemical properties during the recovery of desertified grassland in Zoigê, China (In Chinese)[J]. Acta Ecologica Sinica, 2017, 37(1): 277-285. [税伟, 白剑平, 简小枚, 等. 若尔盖沙化草地恢复过程中土壤特性及水源涵养功能[J]. 生态学报, 2017, 37(1): 277-285.]
(  0) 0) |
| [15] |
Wang Y N, Hu Y G, Wang Z R, et al. Impacts of desertification and artificial revegetation on soil bacterial community in alpine grassland (In Chinese)[J]. Acta Prataculturae Sinica, 2022, 31(5): 26-39. [王亚妮, 胡宜刚, 王增如, 等. 沙化和人工植被重建对高寒草地土壤细菌群落特征的影响[J]. 草业学报, 2022, 31(5): 26-39.]
(  0) 0) |
| [16] |
Jiang Y M, Shi S L, Tian Y L, et al. Characteristics of soil microorganism and soil enzyme activities in alpine meadows under different degrees of degradation (In Chinese)[J]. Journal of Soil and Water Conservation, 2017, 31(3): 244-249. [蒋永梅, 师尚礼, 田永亮, 等. 高寒草地不同退化程度下土壤微生物及土壤酶活性变化特征[J]. 水土保持学报, 2017, 31(3): 244-249.]
(  0) 0) |
| [17] |
Peay K G, Kennedy P G, Talbot J M. Dimensions of biodiversity in the Earth mycobiome[J]. Nature Reviews Microbiology, 2016, 14(7): 434-447. DOI:10.1038/nrmicro.2016.59
(  0) 0) |
| [18] |
Hu L F, Robert C A M, Cadot S, et al. Root exudate metabolites drive plant-soil feedbacks on growth and defense by shaping the rhizosphere microbiota[J]. Nature Communications, 2018, 9: 2738. DOI:10.1038/s41467-018-05122-7
(  0) 0) |
| [19] |
Li Y M, Wang S P, Jiang L L, et al. Changes of soil microbial community under different degraded gradients of alpine meadow[J]. Agriculture, Ecosystems & Environment, 2016, 222: 213-222.
(  0) 0) |
| [20] |
Rong X S, He M, Wang C Y, et al. Analysis on the diversity of soil bacterial and fungal communities in the degraded alpine grassland in northern Tibet plateau (In Chinese)[J]. Ecology and Environmental Sciences, 2018, 27(9): 1646-1651. [荣新山, 何敏, 王从彦, 等. 藏北退化高寒草原土壤细菌和真菌多样性分析[J]. 生态环境学报, 2018, 27(9): 1646-1651.]
(  0) 0) |
| [21] |
Lienhard P, Terrat S, Prévost-Bouré N C, et al. Pyrosequencing evidences the impact of cropping on soil bacterial and fungal diversity in Laos tropical grassland[J]. Agronomy for Sustainable Development, 2014, 34(2): 525-533.
(  0) 0) |
| [22] |
Treseder K K, Lennon J T. Fungal traits that drive ecosystem dynamics on land[J]. Microbiology and Molecular Biology Reviews, 2015, 79(2): 243-262.
(  0) 0) |
| [23] |
Maharachchikumbura S S N, Hyde K D, Jones E B G, et al. Towards a natural classification and backbone tree for Sordariomycetes[J]. Fungal Diversity, 2015, 72(1): 199-301.
(  0) 0) |
| [24] |
Yin Y L, Li S X, Ma Y S. Effects of replanting on soil fungal community characteristics in degraded alpine meadow (In Chinese)[J]. Acta Agrestia Sinica, 2020, 28(6): 1791-1797. [尹亚丽, 李世雄, 马玉寿. 人工补播对退化高寒草甸土壤真菌群落特征的影响[J]. 草地学报, 2020, 28(6): 1791-1797.]
(  0) 0) |
| [25] |
Gilbert G S, Webb C O. Phylogenetic signal in plant pathogen-host range[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(12): 4979-4983.
(  0) 0) |
| [26] |
Waldrop M P, Zak D R, Blackwood C B, et al. Resource availability controls fungal diversity across a plant diversity gradient[J]. Ecology Letters, 2006, 9(10): 1127-1135.
(  0) 0) |
| [27] |
Zhang J X, Wang Z Q, Quan X L, et al. Responses of soil microbial communities of sown perennial grassland in alpine region to different sowing ways and growth years (In Chinese)[J]. Acta Agrestia Sinica, 2021, 29(2): 270-280. [张杰雪, 王占青, 全小龙, 等. 高寒地区人工草地土壤微生物群落对不同种植方式和年限的响应[J]. 草地学报, 2021, 29(2): 270-280.]
(  0) 0) |
| [28] |
Xiao Y N, Zhong X L, Wang B C, et al. Microbial community structure and function and their influencing factors in the soil of Horqin area of Tongliao City, Inner Mongolia (In Chinese)[J]. Earth Science, 2020, 45(3): 1071-1081. [肖玉娜, 钟信林, 王北辰, 等. 通辽科尔沁地区土壤微生物群落结构和功能及其影响因素[J]. 地球科学, 2020, 45(3): 1071-1081.]
(  0) 0) |
| [29] |
Li H Y, Yao T, Gao Y M, et al. Relationship between soil fungal community and soil environmental factors in degraded alpine grassland (In Chinese)[J]. Acta Microbiologica Sinica, 2019, 59(4): 678-688. [李海云, 姚拓, 高亚敏, 等. 退化高寒草地土壤真菌群落与土壤环境因子间相互关系[J]. 微生物学报, 2019, 59(4): 678-688.]
(  0) 0) |
| [30] |
McGuire K L, Fierer N, Bateman C, et al. Fungal community composition in neotropical rain forests: The influence of tree diversity and precipitation[J]. Microbial Ecology, 2012, 63(4): 804-812.
(  0) 0) |
| [31] |
Diao Z M. Study on microbial nitrogen physiological groups in alpine grassland (In Chinese)[J]. Soils, 1996, 28(1): 49-53. [刁治民. 高寒草地的微生物氮素生理群区系研究[J]. 土壤, 1996, 28(1): 49-53.]
(  0) 0) |
| [32] |
Yang T, Adams J M Y., Shi Y, et al. Soil fungal diversity in natural grasslands of the Tibetan Plateau: associations with plant diversity and productivity[J]. New Phytologist, 2017, 21(2): 756-765.
(  0) 0) |
| [33] |
Qin L, Xu J, Ma X, et al. Research on symbiotical fungi species and ectomycorrhizae occurrence of chestnut(Castanea mollissima BL.) (In Chinese)[J]. Journal of Beijing Agricultural College, 1995, 10(1): 71-76. [秦岭, 徐践, 马萱, 等. 板栗共生菌根真菌种类及其发生规律的研究[J]. 北京农学院学报, 1995, 10(1): 71-76.]
(  0) 0) |
| [34] |
Wu L K, Lin X M, Lin W X. Advances and perspective in research on plant-soil-microbe interactions mediated by root exudates (In Chinese)[J]. Chinese Journal of Plant Ecology, 2014, 38(3): 298-310. [吴林坤, 林向民, 林文雄. 根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望[J]. 植物生态学报, 2014, 38(3): 298-310.]
(  0) 0) |
 2023, Vol. 60
2023, Vol. 60


