2. 农业农村部环境保护科研监测所天津市农业环境与农产品安全重点实验室, 天津 300191;
3. 喀喇沁旗农牧局, 内蒙古赤峰市 024400
2. Agro-Environmental Protection Institute, Ministry of Agriculture and Rural Affairs, Tianjin Key Laboratory of Agro-environment and Agro-product Safety, Tianjin 300191, China;
3. Agricultural and Pastoral Bureau of Karakqin Banner, Chifeng, Inner Mongolia 024400, China
集约化农业管理措施的广泛推行旨在提高作物产量以满足人类日益增长的粮食需求。由于作物生长需要大量的氮素,氮素供应成为直接影响作物产量的重要因子[1]。增加化学氮素投入可显著促进农业生产[2],但长期大量施用氮素会导致土壤酸化[2]、肥力下降[3]、养分失衡[4]、温室气体排放上升[5]以及生物多样性丧失[6],继而降低土壤的生态系统服务多功能性[7]。土壤质量每况愈下,人类健康受到严重威胁。如何培肥地力和提高养分循环效率以实现土壤生产力不断提升与生态环境协调发展,已成为现代农业发展所需解决的关键问题[8-9]。
土壤微生物是土壤-植物系统中生源要素迁移转化的引擎,土壤中有机质的分解与积累,氮素转化(包括生物固氮)等过程无不与微生物的活动密切相关[10]。现代可持续和环境友好型农业鼓励有机肥和化学氮肥的联合应用。秸秆还田是提升土壤肥力的有效措施,能够显著提高土壤有机碳含量和减少氮素流失[11],从而减少化肥过量施用对环境所带来的负面影响。秸秆还田所带入的有机物质和矿质元素有利于土壤微生物的生长和繁殖,反之微生物数量的增加促进了秸秆分解[12]。秸秆在土壤微生物的分解作用下发生矿化反应,土壤养分得到补充和良性循环利用[13]。秸秆还田措施真正实现了“取之于田,用之于田”。土壤微生物组是维系陆地生态系统地上-地下相互作用的纽带,那么,秸秆还田对土壤微生物多样性的影响直接影响着地下和地上生态系统结构和功能稳定性。有研究[7]表明,氮肥配施秸秆对土壤理化性质和微生物多样性的影响大于单独施氮处理,其中秸秆还田增强了土壤微生物网络的复杂性。目前有关农业管理措施对土壤微生物组影响的研究大多集中在细菌和真菌群落,而对土壤原生生物群落影响的了解尚不全面。
原生生物包括除了植物、真菌和动物外的所有真核生物[14],在土壤真核群落中占据很大比例,是土壤微生物组的重要组成部分[15]。在土壤生态系统中,原生生物具有重要的服务功能,如调节有机质分解、影响养分循环过程、维持土壤肥力和植物生产力[14,16]。原生生物包括光养类(phototrophs)、捕食类(phagotrophs)、寄生类(parasites)以及兼性营养类等多种功能类群,构成地下微食物网的基础[17]。捕食类原生生物通过捕食个体更小的生物(如细菌、真菌、藻类、线虫和其他原生生物),控制微生物种群的丰度和功能[17-18]。而这种捕食活动重新分配了所获猎物体中的养分,促进土壤养分的周转,在调节土壤肥力方面发挥关键作用。此外,原生生物还可通过降低植物根际环境中致病菌的丰度和毒性或与植物有益微生物协同作用,达到抑制植物病害、促进植物生长、保持植物健康的作用[18-20]。Guo等[20]表明原生生物在激发植物性能中发挥重要作用,可以将其作为微生物因子用于调控和指示植物健康。同时,原生生物是微生物组中对施肥处理和季节变化较敏感的种群,具有监测农田土壤质量的潜力[7]。土壤原生生物是生态系统物质循环的重要参与者,然而,由于原生生物群落的研究起步较晚,开展土地管理策略变化对土壤原生生物群落影响的研究十分必要。为此,本研究通过布设包括2个秸秆还田组和4个氮肥梯度的全因子交互田间定位试验,探究氮肥配施秸秆对土壤原生生物群落的影响,明确主要环境驱动因子,以期增进对原生生物在土壤质量变化中的指示作用及其在微生物组中重要性的了解,同时为氮肥施用配合秸秆还田技术的优化提供基础数据与理论支撑。
1 材料与方法 1.1 研究区概况与土壤样品采集田间试验在位于天津市宁河区的农业农村部环境保护科研监测所实验站(39°48'N,117°71'E)中进行。该实验站的气候条件、土壤类型等信息见吴宪等[21]。田间试验始于2015年10月,采取2 × 4全因子交互式设计,包括2个秸秆还田组(秸秆不还田组和秸秆还田组)和4个氮肥梯度,分别是不施氮肥秸秆不还田处理(CK)、N 100 kg·hm–2处理(N100)、N 200 kg·hm–2处理(N200)、N 300 kg·hm–2处理(N300)、秸秆还田处理(S)、秸秆还田配施N 100 kg·hm–2处理(SN100)、秸秆还田配施N 200 kg·hm–2处理(SN200)、秸秆还田配施N 300 kg·hm–2处理(SN300)共计8个处理,各3个重复小区。试验中施用的肥料包括无机复合肥(N:P2O5:K2O为28︰8︰8)、磷肥(P2O5含量12%)、钾肥(K2O含量60%)、尿素(N含量46%)。在冬小麦和夏玉米播种时分别将相当于纯氮量60 kg·hm–2、120 kg·hm–2、180 kg·hm–2的无机复合肥作为基肥施入相应的试验小区,并在小麦苗期和玉米拔节期分别将相当于纯氮量40 kg·hm–2、80 kg·hm–2、120 kg·hm–2的尿素作为追肥施入。所有处理所施用的磷肥和钾肥量均一致(P2O5:187.5 kg·hm–2、K2O:63 kg·hm–2),在冬小麦和夏玉米播种时一次性施入。按照当地常规管理方式,所有处理中小麦秸秆全部粉碎还田,玉米季仅秸秆还田组中的玉米秸秆粉碎为小段后通过耕翻方式还田,因此本研究中的秸秆还田专指玉米秸秆还田。田间管理措施采用当地常规生产方式。
在玉米收获前(2020年9月)采集土壤样品,采样深度0~20 cm。在每个处理小区中,使用直径5 cm的土壤采样器随机采集5个土芯并混合成1个土壤样品,装入灭菌自封袋暂存于低温保温箱中,并迅速运送回实验室。将每份土壤样品过筛(2 mm),去除杂质后分为3份子样品:用于高通量测序分析的子样品于–70℃保存;用于土壤硝态氮和铵态氮的测定的子样品于4℃冷藏;第3份子样品经风干后于室温保存用于其他理化性质分析。
1.2 土壤理化性质测定土壤理化性质的测定方法参见《土壤农化分析》[22]。采用烘干法测定土壤含水量(moisture content,MC);采用复合电极法测定土壤pH[水土比(v/v)为2.5:1];土壤有机质(soil organic matter,SOM)、全氮(total nitrogen,TN)、全磷(total phosphorus,TP)和有效磷(available phosphorus,AP)分别采用重铬酸钾容量法、半微量凯氏法、HClO4-H2SO4消煮—钼锑抗比色法和NaHCO3浸提—钼锑抗比色法测定;土壤样品经0.01 mol·L–1 CaCl2溶液浸提后使用连续流动分析仪(AA3,SEAL Analytical,德国)测定铵态氮(
使用Fast DNA® Spin Kit for Soil(MP Biomedicals,美国)从0.5 g土壤提取DNA,提取步骤参照试剂盒操作说明书。DNA的完整性通过1.0%的琼脂糖凝胶电泳判断,并使用NanoDrop2000超微量分光光度计(NanoDrop Technologies,hermo Scientific,MA,美国)测定DNA吸光率,计算DNA浓度并检验纯度。用带有barcode序列的引物组F-TAReuk454FWD1/R-TAReukREV3[23]扩增真核生物18S rRNA基因的V4高变区序列。使用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,美国)对PCR扩增子进行纯化,并经QuantiFluor™-ST(Promega,美国)定量后,将纯化的扩增子等摩尔混合后,在Illumina MiSeq测序仪上进行测序,扩增子测序交由上海美吉生物医药科技有限公司(Majorbio Bio-Pharm Technology Co.,上海)完成。
使用QIIME(Quantitative Insights Into Microbial Ecology)(1.9.1)对原始序列进行行质量筛选和修剪[24],使用UPARSE软件(7.0.1090)用于嵌合体移除[25],在97%的相似度水平上将序列聚类成操作分类单元(operational taxonomic units,OTUs),选择每个OTU中数量最多的序列作为代表性序列用于分类学注释。通过与PR2数据库(protist ribosomal reference database)(version_4.5)比对以确定每个OTU的分类学信息[26]。去除Rhodophyta、Streptophyta、fungus、Opisthokonta_X、后生动物等真核生物类群以获得最终的原生生物OTU分类表。参照相关文献人工划分原生生物功能群,包括捕食类、光养类、寄生类、其他消费者类(包括一些寄生兼捕食型、光养兼捕食型等)以及其他无法归类的[27-28]。原始测序数据已提交至美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库,登录号为PRJNA 766328。
1.4 统计分析采用单因素方差分析(One-way analysis of variance,AONVA)中的邓肯(Duncan)事后检验法检验不同处理间土壤理化性质的差异,P值设置为0.05。皮尔森(Pearson)相关分析采用SPSS 20.0(IBM SPSS Inc.)进行。不同处理间原生生物群落结构相异性评价采用基于Bray-Curtis距离矩阵的主坐标分析(principal co-ordinates analysis,PCoA)完成,不同处理间差异显著性通过R语言的vegan包进行相似性分析(analysis of similarities,ANOSIM)和评价。采用冗余分析(redundancy analysis,RDA)明确驱动土壤原生生物群落组成变化的关键驱动因子。所有数据采用R(v4.0.3)或Origin 2018进行可视化处理,并在Adobe Illustrator中进行图像整合。
2 结果 2.1 氮肥配施秸秆后土壤理化性质变化由表 1可见,土壤pH随氮肥施用量的增加而显著降低(P < 0.05),秸秆还田整体上提高了土壤pH。与配施秸秆处理相比,单施化肥处理表现出更高的SOM含量(P < 0.05)。与单施化肥处理相比,秸秆还田显著降低了土壤
|
|
表 1 氮肥配施秸秆后土壤理化性质 Table 1 Soil physical and chemical properties |
|
|
表 2 土壤理化性质和原生生物多样性的双因素方差分析 Table 2 Two-factor ANOVA for soil physical and chemical properties and protist diversity |
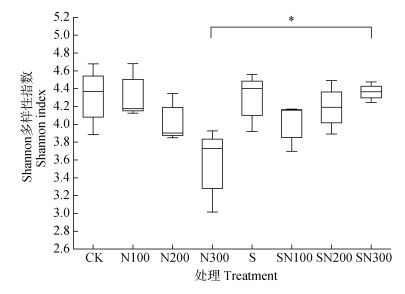
本研究共获得1 289 885条高质量的原生生物序列,聚类得到1 045个OTU。如图 1所示,秸秆不还田组(单施化肥)中,香农指数随施氮量的增加而降低;而在秸秆还田组中,除0 kg·hm–2施氮量外,香农指数随施氮量增加而增加,但变化幅度较小(3.69~4.49)。在这些处理中,仅SN300处理的香农指数较相应的N300处理显著增加(P < 0.05)。
|
注:*表示P < 0.05。下同。 Note: * means P < 0.05. The same below. 图 1 不同处理土壤原生生物群落的香农指数 Fig. 1 Shannon index of soil protist community of different treatments |
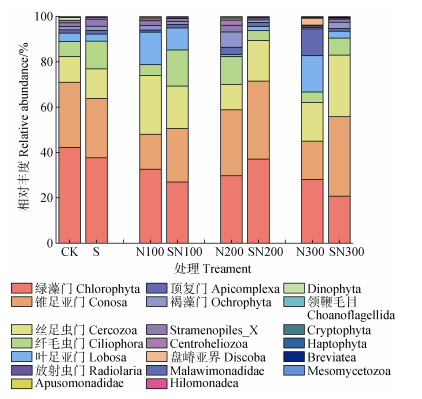
系统发育分析表明,原生生物群落分属9个超级组、19个门、61个纲、108个目、202个科、338个属和396个种。土壤原生生物群落在门水平上的组成情况如图 2所示,不同处理的优势门相同,其中绿藻门(Chlorophyta)平均相对丰度为20.74%~42.21%,锥足亚门(Conosa)平均相对丰度为15.50%~35.05%,丝足虫门(Cercozoa)平均相对丰度为11.18%~27.09%,纤毛虫门(Ciliophora)平均相对丰度为4.29%~15.95%。
|
图 2 门水平上的土壤原生生物群落组成 Fig. 2 Soil protist community composition at the phylum level |
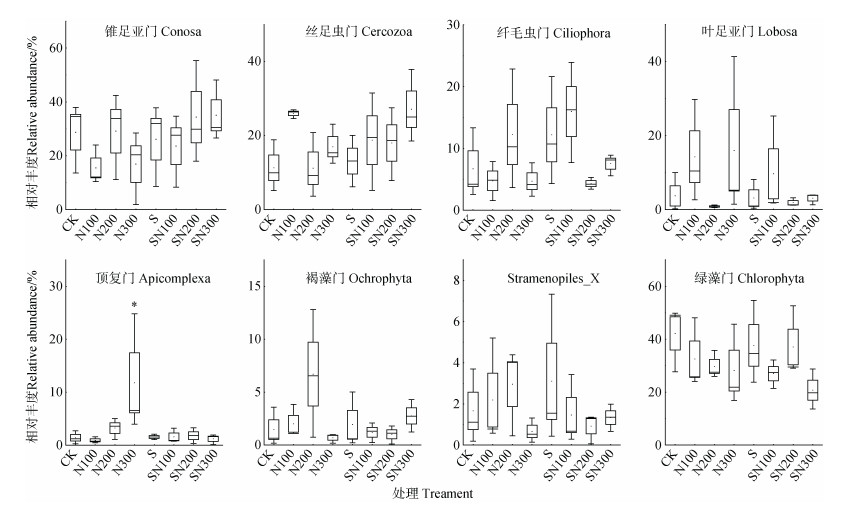
如图 3所示,秸秆不还田组,随施氮量的增加,绿藻门(Chlorophyta)的相对丰度降低,锥足亚门(Conosa)和纤毛虫门(Ciliophora)的相对丰度均呈降低-升高-降低趋势,丝足虫门(Cercozoa)的相对丰度呈升高-降低-升高趋势,而顶复门(Apicomplexa)的相对丰度在N300处理中最高(P < 0.05)。秸秆还田组,随施氮量的增加,绿藻门(Chlorophyta)的相对丰度整体降低,而锥足亚门(Conosa)和丝足虫门(Cercozoa)的相对丰度呈增加趋势。
|
图 3 原生生物群落优势门的相对丰度变化 Fig. 3 Changes in relative abundances of the dominant phylum of protist community |
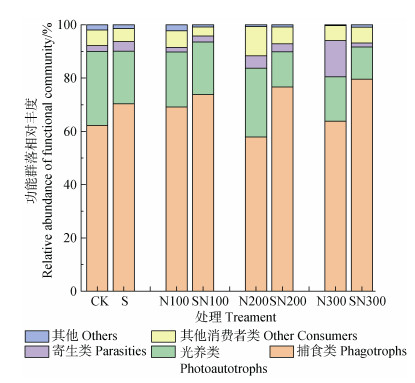
土壤原生生物群落的功能组成如图 4所示。各处理中,捕食类原生生物占比57.00%~79.57%,光养类占比12.11%~27.78%,寄生类占比1.40%~13.54%。同等施氮量条件下,秸秆还田处理较秸秆不还田处理的捕食类原生生物的相对丰度提高了7.95%~14.01%,而光养类原生生物的相对丰度则降低了0.8%~12.0%。N300处理的寄生类原生生物比例(13.54%)显著高于其他处理(P < 0.05)。
|
注:其他消费者类包括一些光养兼捕食类或寄生兼捕食类等消费者。 Note: Other consumers include some consumers which both are phototrophic and phagotrophic or parasitic and phagotrophic. 图 4 土壤原生生物群落功能组成 Fig. 4 Functional composition of soil protist community |
PCoA分析结果(图 5)表明,秸秆不还田组中,各处理间原生生物群落结构差异不显著,但均显著不同于N200处理。而就秸秆还田组而言,仅SN100与SN200间群落结构差异显著。对比秸秆不还田组与秸秆还田组发现,仅N200与SN200处理间群落结构表现出显著差异。
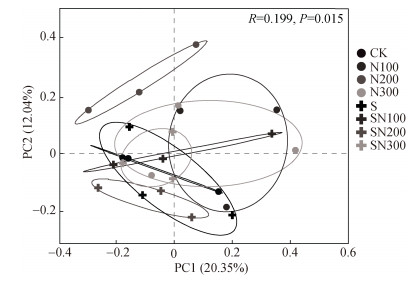
|
图 5 土壤原生生物群落的主坐标分析(PCoA) Fig. 5 Principal coordinates analysis(PCoA)of soil protist community |
冗余分析(redundancy analysis,RDA)结果表明,轴1和轴2分别解释原生生物群落变异的21.12%和5.26%(图 6)。Mantel检验结果表明,pH(R2 = 0.562,P = 0.001)、TN(R2 = 0.458,P = 0.002)、SOM(R2 = 0.337,P = 0.017)、
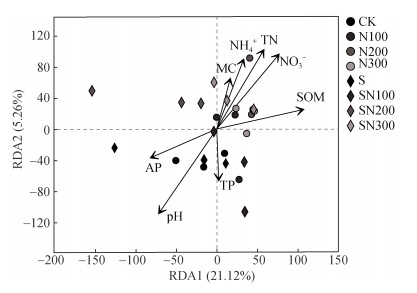
|
注:MC表示含水量,SOM表示土壤有机质,TN表示全氮,TP表示全磷, |
寄生类的相对丰度均与SOM显著正相关(P < 0.05),与pH显著负相关(P < 0.05);其他消费者类原生生物的相对丰度与SOM和
|
|
表 3 原生生物功能群相对丰度与土壤性质间的皮尔森相关性 Table 3 Pearson's correlation analysis between the relative abundances of functional groups and edaphic properties |
|
|
表 4 原生生物功能群相对丰度间的皮尔森相关性 Table 4 Pearson's correlation analysis between relative abundances of functional groups |
土壤管理是影响原生生物群落组成的重要人类活动[29]。原生生物作为农田环境变化的重要指示生物对氮肥施用尤为敏感[7]。本研究各施肥处理的土壤原生生物群落优势类群分别是绿藻门(Chlorophyta)、锥足亚门(Conosa)、丝足虫门(Cercozoa)和纤毛虫门(Ciliophora),与前人的研究结果[30]相似,但其相对丰度受施肥措施的影响各有不同,如锥足亚门(Conosa)和丝足虫门(Cercozoa)的相对丰度仅在秸秆还田组中整体上随施氮量增加而增加,而在秸秆不还田组中未呈现规律性变化;绿藻门(Chlorophyta)的相对丰度整体上随施氮量增加而降低(图 3),这说明不同管理措施形成的异质土壤环境塑造了不同的原生生物群落。本研究中单施化肥降低了土壤原生生物的多样性(图 1),说明对原生生物产生了负面影响,这与以往化肥施用对细菌和真菌群落的研究结果[6,31]相似。而结合秸秆还田措施后,原生生物群落多样性整体上得到提升,尤其在高施氮水平下,原生生物群落多样性的提升尤为明显(图 1),表明秸秆还田形成了有利于原生生物的栖息环境。虽然通过双因素方差分析,未发现施肥或秸秆还田对原生生物香农多样性的显著影响(表 2),这可能与所进行的试验持续时间仅有5年有关,但足以证明土壤环境在朝着有利于土壤原生生物的方向发展。
捕食类土壤原生生物是本研究的优势功能群(图 4),与Li等[15]的研究结果一致,说明其在调节其他微生物群落的生物量、活性和结构中具有潜在的巨大作用,从而也对微生物驱动的生态系统功能产生重要影响。捕食类原生生物能够将养分转移至土壤食物网的较高营养级,并通过捕食土壤中的细菌与真菌促进微生物的活动和养分循环,提高土壤食物网的养分周转速率[32]。按照群落生态学理论,捕食是影响群落结构的重要因素[33],土壤微生物群落也不例外。Chen等[34]研究表明,旱地土壤中原生生物以捕食细菌群落为主,而对真菌群落的影响较小。课题组前期研究表明秸秆还田增加细菌的绝对丰度和多样性,并且有利于真菌的增殖[35]。据此推测认为,秸秆还田为捕食类原生生物提供了丰富的能量来源,促进了它们的繁殖。由于捕食单一猎物所获得的养分无法满足捕食者的生长和繁殖需求[36],原生生物捕食者必须取食各种各样的猎物以获得足够的营养物质,进而形成了捕食者的猎物偏好,反之通过选择性捕食效应影响猎物(细菌)的丰度和种间竞争,维持和促进猎物(细菌)的多样性。此外,捕食类原生生物可能通过吞噬植物病原菌,抑制植物病害和促进植物生长[18-19]。本研究中秸秆还田措施降低了中和高施氮量下寄生类的顶复门(Apicomplexa)原生生物相对丰度(图 3),该门类包含能引起人或动物弓形虫病和其他疟疾的病原物[37],这表明秸秆还田可降低某些土壤病原菌的致病风险,这也在一定程度上印证了捕食类与寄生类原生生物的显著负相关关系(表 4),说明原生生物捕食者可通过自上而下的调控发挥作用。
原生生物群落变化与农业管理制度改变所致的土壤pH、含水量和养分有效性变化密切相关。本研究中RDA和相关性分析结果(图 6,表 3)表明SOM和pH是影响原生生物群落组成和功能的关键土壤环境因子。土壤微生物绝大部分是异养型的,因此,SOM作为碳源能够促进异养微生物的生长,尤以细菌和真菌为主,这为原生生物提供了丰富的食物来源。异养生物的生长繁殖会压缩自养生物的生存空间,本研究中直接体现在绿藻门(Chlorophyta)的占比整体上随施氮量增加而降低(图 3)。然而,细菌和真菌,乃至原生生物不仅受到碳源的影响,也会受到其他关键环境因子(如pH)的显著影响。本研究中无论是否实施秸秆还田措施,氮肥施用显著降低了土壤pH(表 1),与Hao等[3]的研究结果一致,这也可能是导致具有植物特性的绿藻门(Chlorophyta)比例降低的另一个因素。例如,本研究中单施化肥组中高施氮量处理所致的土壤酸化会抑制细菌和真菌的生长(表 1),这种抑制作用可能会超过SOM的激发作用,导致细菌和真菌数量降低,进而对原生生物产生间接影响,如多样性下降和捕食类比例的降低。虽然秸秆还田未明显增加土壤的SOM,却显著提升了土壤pH和部分速效养分(如AP),形成了对原生生物有利的土壤环境。
对于土壤原生生物群落结构,虽然个别处理间表现出显著差异,但就整体布局而言,原生生物群落结构的变化并不明显,而且秸秆不还田组与秸秆还田组间也未形成鲜明的界限(图 5),推测可能是短期的秸秆还田尚未达到分化原生生物群落结构的环境,或许在未来持续更长时间管理措施的影响下才能表现出明显差异。总之,以上研究结果暗示秸秆还田通过改变土壤非生物因子(即自下而上的调控)进而影响原生生物的猎物,从而塑造了原生生物群落。因此,未来应该从环境适应性和营养级关系来探索原生生物在土壤-植物系统中的关键作用。
4 结论秸秆还田能够改变单独施用化肥所致的原生生物群落多样性降低的不利影响,并且通过提高捕食类原生生物的比例以控制寄生类原生生物,具有对细菌和真菌群落自上而下的调控作用,从而降低土壤病害的发生,而上述结果可能归因于秸秆还田通过改变土壤非生物因子(如pH和SOM)所引发的自下而上的调控。总之,未来应该系统研究小麦-玉米轮作制度下原生生物在土壤微生物食物网营养级关系中的关键作用,并通过调整农业管理制度加强对有益土壤原生生物功能群的利用以促进植物健康和农业可持续发展。
| [1] |
Qiu L L, Li Z Q, Xu J S, et al. Effects of biochar and straw application on soil biochemical properties and wheat yield in yellow-cinnamon soil (In Chinese)[J]. Soils, 2021, 53(3): 475-482. [邱丽丽, 李增强, 徐基胜, 等. 生物质炭和秸秆施用对黄褐土生化性质及小麦产量的影响[J]. 土壤, 2021, 53(3): 475-482.]
(  0) 0) |
| [2] |
Guo J H, Liu X J, Zhang Y, et al. Significant acidification in major Chinese croplands[J]. Science, 2010, 327(5968): 1008-1010. DOI:10.1126/science.1182570
(  0) 0) |
| [3] |
Hao T X, Zhu Q C, Zeng M F, et al. Impacts of nitrogen fertilizer type and application rate on soil acidification rate under a wheat-maize double cropping system[J]. Journal of Environmental Management, 2020, 270: 110888. DOI:10.1016/j.jenvman.2020.110888
(  0) 0) |
| [4] |
Tilman D, Cassman K G, Matson P A, et al. Agricultural sustainability and intensive production practices[J]. Nature, 2002, 418(6898): 671-677. DOI:10.1038/nature01014
(  0) 0) |
| [5] |
Yu K, Fang X T, Zhang Y H, et al. Low greenhouse gases emissions associated with high nitrogen use efficiency under optimized fertilization regimes in double-rice cropping systems[J]. Applied Soil Ecology, 2021, 160: 103846. DOI:10.1016/j.apsoil.2020.103846
(  0) 0) |
| [6] |
Qin H Y, Deng H, Han C, et al. Anammox bacterial abundance and biodiversity in greenhouse vegetable soil are influenced by high nitrate content[J]. Pedosphere, 2020, 30(3): 343-354. DOI:10.1016/S1002-0160(18)60023-2
(  0) 0) |
| [7] |
Zhao Z B, He J Z, Geisen S, et al. Protist communities are more sensitive to nitrogen fertilization than other microorganisms in diverse agricultural soils[J]. Microbiome, 2019, 7(1): 33. DOI:10.1186/s40168-019-0647-0
(  0) 0) |
| [8] |
Cai Z C. Discussion on the strategies for development of the subdiscipline of soil fertility and soil nutrient cycling for the 14th Five-year Plan (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(5): 1128-1136. [蔡祖聪. 浅谈"十四五"土壤肥力与土壤养分循环分支学科发展战略[J]. 土壤学报, 2020, 57(5): 1128-1136.]
(  0) 0) |
| [9] |
Shen R F, Yan X Y, Zhang G L, et al. Status quo of and strategic thinking for the development of soil science in China in the new era (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(5): 1051-1059. [沈仁芳, 颜晓元, 张甘霖, 等. 新时期中国土壤科学发展现状与战略思考[J]. 土壤学报, 2020, 57(5): 1051-1059.]
(  0) 0) |
| [10] |
Zhu Y G, Shen R F, He J Z, et al. China soil microbiome initiative: Progress and perspective (In Chinese)[J]. Bulletin of Chinese Academy of Sciences, 2017, 32(6): 554-565. [朱永官, 沈仁芳, 贺纪正, 等. 中国土壤微生物组: 进展与展望[J]. 中国科学院院刊, 2017, 32(6): 554-565.]
(  0) 0) |
| [11] |
Quan Z, Li S L, Zhu F F, et al. Fates of.15N-labeled fertilizer in a black soil-maize system and the response to straw incorporation in Northeast China[J]. Journal of Soils and Sediments, 2018, 18(4): 1441-1452. DOI:10.1007/s11368-017-1857-3
(  0) 0) |
| [12] |
Tian S Y, Li H M, Chen J L, et al. Differences of nutrient contents in residual wheat and maize straws and their relationship with microbial community composition in fluvo-aquic soil (In Chinese)[J]. Soils, 2021, 53(1): 55-63. [田胜营, 李慧敏, 陈金林, 等. 潮土中残留小麦和玉米秸秆养分含量差异及与微生物群落组成的关系[J]. 土壤, 2021, 53(1): 55-63.]
(  0) 0) |
| [13] |
Ma L N, Ma J X, Wang D M, et al. Effects of straw returning and nitrogen application on soil nutrients and yield in saline-sodic Japonica rice region (In Chinese)[J]. Journal of Jilin Normal University: Natural Science Edition, 2021, 42(4): 134-140. [马丽娜, 马俊祥, 王冬梅, 等. 秸秆还田与施氮量对盐碱粳稻区土壤养分及产量的影响[J]. 吉林师范大学学报: 自然科学版, 2021, 42(4): 134-140.]
(  0) 0) |
| [14] |
Geisen S, Mitchell E A D, Adl S, et al. Soil protists: A fertile frontier in soil biology research[J]. FEMS Microbiology Reviews, 2018, 42(3): 293-323. DOI:10.1093/femsre/fuy006
(  0) 0) |
| [15] |
Li F F, Sun A Q, Jiao X Y, et al. Specific protistan consumers and parasites are responsive to inorganic fertilization in rhizosphere and bulk soils[J]. Journal of Soils and Sediments, 2021, 21(12): 3801-3812. DOI:10.1007/s11368-021-03052-4
(  0) 0) |
| [16] |
Oliverio A M, Geisen S, Delgado-Baquerizo M, et al. The global-scale distributions of soil protists and their contributions to belowground systems[J]. Science Advances, 2020, 6(4): eaax8787. DOI:10.1126/sciadv.aax8787
(  0) 0) |
| [17] |
Lars G, Manfred J, Dominik H, et al. Protistan community analysis: Key findings of a large-scale molecular sampling[J]. The ISME Journal, 2016, 10(9): 2269-79. DOI:10.1038/ismej.2016.10
(  0) 0) |
| [18] |
Geisen S. The bacterial-fungal energy channel concept challenged by enormous functional versatility of soil protists[J]. Soil Biology and Biochemistry, 2016, 102: 22-25. DOI:10.1016/j.soilbio.2016.06.013
(  0) 0) |
| [19] |
Xiong W, Song Y Q, Yang K M, et al. Rhizosphere protists are key determinants of plant health[J]. Microbiome, 2020, 8(1): 27. DOI:10.1186/s40168-020-00799-9
(  0) 0) |
| [20] |
Guo S, Xiong W, Hang X N, et al. Protists as main indicators and determinants of plant performance[J]. Microbiome, 2021, 9(1): 64. DOI:10.1186/s40168-021-01025-w
(  0) 0) |
| [21] |
Wu X, Hu H, Wang R, et al. Effects of reduction of chemical fertilizer and substitution coupled with organic manure on the molecular ecological network of microbial communities in fluvo-aquic soil (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(2): 545-556. [吴宪, 胡菏, 王蕊, 等. 化肥减量和有机替代对潮土微生物群落分子生态网络的影响[J]. 土壤学报, 2022, 59(2): 545-556.]
(  0) 0) |
| [22] |
Bao S D. Analysis for soil and agro-chemistry (In Chinese). Beijing: China Agriculture Press, 2000. [鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000.]
(  0) 0) |
| [23] |
Stoeck T, Breiner H W, Filker S, et al. A morphogenetic survey on ciliate plankton from a mountain lake pinpoints the necessity of lineage-specific barcode markers in microbial ecology[J]. Environmental Microbiology, 2014, 16(2): 430-444. DOI:10.1111/1462-2920.12194
(  0) 0) |
| [24] |
Bolyen E, Rideout J R, Dillon M R, et al. Reproducible, interactive, scalable and extensible microbiome data science using QⅡME 2[J]. Nature Biotechnology, 2019, 37(8): 852-857. DOI:10.1038/s41587-019-0209-9
(  0) 0) |
| [25] |
Edgar R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 2013, 10(10): 996-998. DOI:10.1038/nmeth.2604
(  0) 0) |
| [26] |
Guillou L, Bachar D, Audic S, et al. The Protist Ribosomal Reference database(PR2): A catalog of unicellular eukaryote small sub-unit rRNA sequences with curated taxonomy[J]. Nucleic Acids Research, 2013, 41(Database issue): D597-D604.
(  0) 0) |
| [27] |
Zhao Z B, He J Z, Quan Z, et al. Fertilization changes soil microbiome functioning, especially phagotrophic protists[J]. Soil Biology and Biochemistry, 2020, 148: 107863. DOI:10.1016/j.soilbio.2020.107863
(  0) 0) |
| [28] |
Schulz G, Schneider D, Brinkmann N, et al. Changes in trophic groups of protists with conversion of rainforest into rubber and oil palm plantations[J]. Frontiers in Microbiology, 2019, 10: 240. DOI:10.3389/fmicb.2019.00240
(  0) 0) |
| [29] |
Xiong W, Alexandre J, Guo S, et al. Soil protist communities form a dynamic hub in the soil microbiome[J]. The ISME Journal, 2018, 12(2): 634-638.
(  0) 0) |
| [30] |
Kalinowska R, Pawlik-Skowrońska B. Response of two terrestrial green microalgae(Chlorophyta, Trebouxiophyceae)isolated from Cu-rich and unpolluted soils to copper stress[J]. Environmental Pollution, 2010, 158(8): 2778-2785.
(  0) 0) |
| [31] |
Chen Q L, Ding J, Zhu D, et al. Rare microbial taxa as the major drivers of ecosystem multifunctionality in long-term fertilized soils[J]. Soil Biology and Biochemistry, 2020, 141: 107686.
(  0) 0) |
| [32] |
Selph K, Landry M, Laws E. Heterotrophic nanoflagellate enhancement of bacterial growth through nutrient remineralization in chemostat culture[J]. Aquatic Microbial Ecology, 2003, 32: 23-37.
(  0) 0) |
| [33] |
Ripple W J, Estes J A, Beschta R L, et al. Status and ecological effects of the world's largest carnivores[J]. Science, 2014, 343(6167): 1241484.
(  0) 0) |
| [34] |
Chen B B, Xiong W, Qi J J, et al. Trophic interrelationships drive the biogeography of protistan community in agricultural ecosystems[J]. Soil Biology and Biochemistry, 2021, 163: 108445.
(  0) 0) |
| [35] |
Wu X, Zhang T, Zhao J N, et al. Variation of soil bacterial and fungal communities from fluvo-aquic soil under chemical fertilizer reduction combined with organic materials in North China plain[J]. Journal of Soil Science and Plant Nutrition, 2021, 21(1): 349-363.
(  0) 0) |
| [36] |
Petchey O L. Prey diversity, prey composition, and predator population dynamics in experimental microcosms[J]. Journal of Animal Ecology, 2000, 69: 874-882.
(  0) 0) |
| [37] |
Votýpka J, Modrý D, Oborník M, et al. Apicomplexa// Archibald J, Simpson A, Slamovits C. eds. Handbook of the Protists[M]. Springer, Cham. 2017: 1—58.
(  0) 0) |
 2023, Vol. 60
2023, Vol. 60


