2. 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008;
3. 草地农业研究所,新西兰北帕默斯顿 4442;
4. 中国科学院东北地理与农业生态研究所,长春 130102
2. State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China;
3. AgResearch Limited, Grasslands Research Centre, Palmersoon North 4442, New Zealand;
4. Northeast Institute of Geography and Agroecology, Chinese Academy of Sciences, Changchun 130102, China
甲烷(CH4)是一种痕量的温室气体。目前,大气中的CH4平均浓度达到1.855 μL·L–1 [1],较工业革命前的平均浓度0.720 μL·L–1高出257%。土壤甲烷氧化菌是大气甲烷的唯一生物汇,尽管对大气甲烷的氧化仅占全球甲烷汇的5%~15%[2],但对保持大气甲烷浓度平衡、减缓温室效应有重要意义。
好氧甲烷氧化主要发生在旱地土壤的表层,由好氧甲烷氧化菌完成。尽管早在20世纪初首株甲烷氧化菌就被分离培养出来[3],但直至20世纪70年代初,甲烷氧化微生物才开始被系统地研究[4]。好氧甲烷氧化菌根据形态、代谢途径、膜结构以及主要磷脂酸成分等特征可分为I型和II型两个主要类群,分别属于γ-变形菌纲(γ-Proteobacteria)和α-变形菌纲(α-Proteobacteria)。近年来,随着分子研究技术水平的提高,对甲烷氧化菌的研究也不断深入,在极端嗜热、嗜酸环境中也发现了疣微菌门(Verrucomicrobia)的好氧甲烷氧化菌[5]。
大气中甲烷浓度仅为1.85 μL·L–1左右,因此能氧化该浓度甲烷的甲烷氧化菌需具有极高的底物亲和力。传统观点认为大气中的甲烷主要被一类特殊的高亲和力的甲烷氧化菌所氧化[6],该类甲烷氧化菌被称为Upland Soil Clusters(USCα和USCγ)和Jasper Ridge Clusters(JR1,JR2和JR3)。此外,IIa型的甲基孢囊菌属(Methylocystis)和甲基弯曲菌属(Methylosinus)含有两套颗粒型甲烷氧化酶(particulate methane monooxygenase,pMMO),其中pMMO2酶已被证实能氧化大气浓度甲烷[7]。该类甲烷氧化菌相比于大气甲烷氧化菌,对于环境的适应能力较高,能够适应甲烷浓度变化范围较大的环境。它们能在旱地土壤短期淹水产生高浓度甲烷期间完成自身的代谢和生长繁殖,同时储备营养物质以供在大气低甲烷浓度环境下继续生长并维持甲烷氧化能力[8]。但最新的研究[9]表明,高亲和力的大气甲烷氧化菌也能在特定的条件下氧化高浓度甲烷,改变了以往的认识。
草地是仅次于森林的第二大CH4汇[10]。集约化放牧是草地的主要利用方式,随着放牧率、放牧制度和放牧季节的改变,甲烷氧化的潜力也随之发生变化。放牧强度和放牧季节是上述因素中最主要的可控影响因素。研究发现,不同草地类型因地理位置[11]、植被类型[11]、放牧强度[12-13]等的差异,致使甲烷氧化潜力各异。在我国的半干旱草地生态区,放牧增加了甲烷吸收,在无、低、中、高放牧强度下,草地甲烷吸收速率分别为51.55±40.86、89.26± 83.85、75.34±53.89、73.41±49.67 mg·m–2·h–1(以CH4计)[10]。针对青藏高原高寒草甸的研究也表明放牧促进大气CH4的吸收[11]。但有研究者[12]发现在内蒙古典型草地冬季放牧会显著降低CH4的吸收。黄土高原地理位置特殊,牧草的青储量不能完全满足冬季牲畜的需求,因而冬季放牧是该地区普遍存在的现象。但由于冬季牧场放牧时间短、植物多样性弱而被忽略,导致目前相关的研究非常少。
黄土高原位于我国的黄河中上游,包括太行山以西、日月山以东、秦岭以北、阴山以南62.4万km2的黄土沉积区,是世界最脆弱的生态区之一。目前仅有少量的原位观测发现该地区的草地具有甲烷氧化能力,以及放牧可影响甲烷氧化的现象,但并未从土壤微生物方面揭示其原因[14]。目前关于草地甲烷氧化菌群落特征和CH4氧化研究主要集中在青藏高原的高寒草甸[12,15]和内蒙古典型草原[16-18]。尽管黄土高原草地面积约占黄土高原总面积的1/3[19],但本地区已有的研究[20]主要是放牧对该试验区草地生态系统的植被、土壤性质与养分循环和整体土壤微生物群落等的影响,忽视了放牧对甲烷氧化菌的影响。本文假设放牧会引起该地区甲烷氧化菌群落丰度和多样性的变化,进而使CH4氧化速率发生改变。为此,本研究采集黄土高原典型草原长期(17年)不同强度滩羊放牧区的土壤样品,通过室内甲烷氧化活性及微生物组成的分析证实上述假设,以期为黄土高原草地生态系统甲烷汇的评估提供基础数据支撑。
1 材料与方法 1.1 土壤样品采集研究区位于甘肃省环县甜水镇兰州大学草地农业科技学院野外试验站(37.12°N,106.82°E),该地区平均海拔1 650 m,平均气温7.1℃,年平均降水量359.3 mm,年平均蒸发量1 993.3 mm。该类型草地的优势物种为:长芒草(Stipa bungeana)、胡枝子(Lespedeza davurica)、白草(Pennisetum flaccidum)、茵陈蒿(Artemisia capillaris)和狗尾草(Setaria viridis)。该试验地于2001年建立,由每公顷0(无放牧,CK)、2.67(低放牧强度,LG)、5.33(中放牧强度,MG)和8.67(高放牧强度,HG)只羊的放牧试验样地组成,每种放牧强度设置3块随机分布重复样地,每块样地面积约为50 m×100 m。每年从10月底至12月中旬进行连续滩羊放牧(冬季牧场)。试验所需的土壤样本于2018年5月采集自不同放牧强度的样地,每块样地用直径10 cm的土钻用“Z”字取样法取10个0~5 cm深度的土柱,混合后作为一个土壤样品(约200 g),用冷藏盒将土壤带回实验室。在24 h内,对带回的样品剔去杂质,随后将样品等分,一份储存在–20℃用于DNA的提取,一份储存于4℃,用于土壤理化性质等测定。
土壤理化性质的测定方法如下:采用105℃恒重干燥法测定土壤含水量(soil moisture,SM)。土壤pH采用pH计(FE20-K,上海梅特勒-托莱多仪器有限公司)测定,土-水比为1:5。土壤全碳(total carbon,TC)和全氮(total nitrogen,TN)使用碳氮元素分析仪(Vario Max CN,德国)测定。用土壤:溶液比为1:10的2 mol·L–1 KCl溶液,在200 r·min–1下振荡60 min,提取铵态氮(ammonium nitrogen,
在室内测定不同放牧强度土壤样品的大气甲烷氧化潜力,将6 g新鲜土壤置于120 mL血清瓶中,设置三个重复。用黑色丁基橡胶塞密封并用铝盖封口。密封瓶顶部空间的空气首先被清空,然后用氩气(Ar2)冲洗三次。最后加入约110 mL的环境空气(浓度2.57μL·L–1,0时刻),在28℃的黑暗环境中培养。用气相色谱(GC-7890A,美国)测定培养0、63、72、146 h后培养瓶内甲烷浓度。用0时刻的甲烷浓度与培养63 h后测定的甲烷浓度的差值计算甲烷氧化速率(methane oxidation rate,MOR)。
| $\mathrm{MOR}=\left(\Delta C_{\mathrm{CH} 4} \times \mathrm{V} \times \rho\right) /(t \times \mathrm{m}) $ | (1) |
式中,MOR为甲烷氧化速率,nmol·g–1·h–1(以CH4计);ΔCCH4是CH4每小时顶空浓度的变化,µL·L–1;V为瓶子内空气的体积(110 mL);ρ为标准条件下的CH4气体密度,g·L–1;t为培养时间,h;m为干土质量,g。
1.3 基因组DNA提取取0.5 g新鲜土壤样本,用FastDNA® 土壤试剂盒(MP Biomedicals,Cleveland,Ohio,美国),按照说明书操作,提取所有土壤样品的基因组DNA。DNA的纯度和质量通过紫外-可见分光光度计(Nanodrop® ND-1000,NanoDrop Technologies,Wilmington,DE,美国)和1.2%的琼脂糖凝胶电泳检查,并将DNA储存于–20℃备用。
1.4 实时荧光定量PCR测定甲烷氧化菌的丰度使用CFX96荧光定量PCR仪(Bio-Rad Laboratories Inc.,Hercules,CA,美国)对甲烷氧化菌的pmoA基因进行定量,来表征甲烷氧化菌的丰度。使用A189F(5'-GGNGACTGGGACTTCTGG- 3')和mb661R(5'-CCGGMGCAACGTCYTTACC-3')[22]扩增pmoA基因片段。获得上述微生物标靶基因的重组质粒后,以10倍梯度稀释重组质粒,用于标准曲线制定。定量PCR反应体系(20 µL)如下:10 µL SYBR Premix ExTaq(TaKaRa Biotech,大连)、0.25 µL引物(10 µmol·L–1)、1.0 µL DNA模板,用DNase/RNase-free水补足至20 µL。在所有分析中,灭菌的超纯水代替土壤DNA作为空白对照。得到的定量结果中,pmoA基因PCR的扩增效率在84.8% 和84.5%,标准曲线R2均为1.00。
1.5 高通量测序16S rRNA基因利用通用引物对515F(5’-GTGCCAGCMGC CGCGG-3’)和907R(5’-CCGTCAATTCMTTTRAG TTT-3’)[23]扩增细菌16S rRNA基因,其中正向引物515F的5'末端含有12 bp的标签序列用于区分样品。PCR混合体系(50 μL)包括25μL TaKaRa Premix Ex Taq,1.0 μL引物(10 μmol·L–1),2 μL DNA模板,用DNase/RNase-free水补足至50 μL。将上述获得的PCR产物利用MiniBEST DNA Fragment Purification Ver.3.0试剂盒(TaKaRa Biotech,大连)纯化,后溶于30 μL DNase/RNase-free水中,用1.2%琼脂糖凝胶电泳检测纯化效果。最后利用Nanodrop® ND-1000紫外-可见分光光度计测定扩增产物的浓度。随后将不同样品的纯化产物等摩尔体积混合后使用TruSeq Nano DNA LT样品制备试剂盒组A(24个样品)构建测序文库,使用MiSeq试剂盒v3(600个循环)进行测序。使用Mothur软件(版本1.43.3)对测序结果进行读取、合并和质量过滤[24]。使用'make.contigs'命令(deltaq = 5)将双端序列合并,使用'trim.seqs'命令拆分样品、去除引物序列和筛选序列长度(留下长度在370和380 bp之间的序列)。随后使用'chimera.vsearch' 命令检查并去除序列中的嵌合体;最后,使用'classify.seqs' 命令将高质量序列直接分类,详细过程参考Cai等[25]。
1.6 pmoA基因高通量测序利用引物A189F(5'-GGNGACTGGGACTTCT GG-3')、mb661R(5'-CCGGMGCAACGTCYTTACC- 3')和A650R(5’-ACGTCCTTACCGAAGGT-3’)[26]扩增pmoA基因,其中A189F引物的5'末端连接有6 bp的标签序列用于区分不同的样品。PCR混合体系(50 μL)包括25 μL TaKaRa Premix Ex Taq、1.0 μL A189F(10 μmol·L–1)、0.5 μL mb661R、0.5 μL A650R(10 μmol·L–1)、2 μL DNA模板,用DNase/RNase-free水补足至50 μL。获得扩增后的PCR产物后使用与1.5部分相同的方法完成测序和结果分析。
1.7 数据分析土壤理化性质、群落组成等数据整理采用Excel 365。所有数据采用SPSS 20.0进行统计分析。处理之间差异采用单因素方差分析(one-way ANOVA)检验不同放牧强度处理土壤理化性质差异的显著性,平均值比较采用邓肯(Duncan)检验(P < 0.05)。使用R语言vegan软件进行加权UniFrac距离矩阵的非度量多维尺度(Non-metric multidimensional scaling,NMDS)分析。使用Origin2021进行作图。使用R语言分析大气甲烷氧化速率、土壤理化性质、甲烷氧化菌丰度和不同甲烷氧化菌的绝对数量(绝对数量=基于pmoA基因测序结果的不同类型甲烷氧化菌在总甲烷氧化菌中的占比×pmoA基因拷贝数)之间的皮尔森(Pearson)相关性。
2 结果 2.1 不同放牧强度下土壤理化性质土壤理化性质受不同放牧强度的影响(图 1):放牧强度对土壤pH无显著影响;土壤含水量在放牧处理中显著高于CK(P < 0.01);
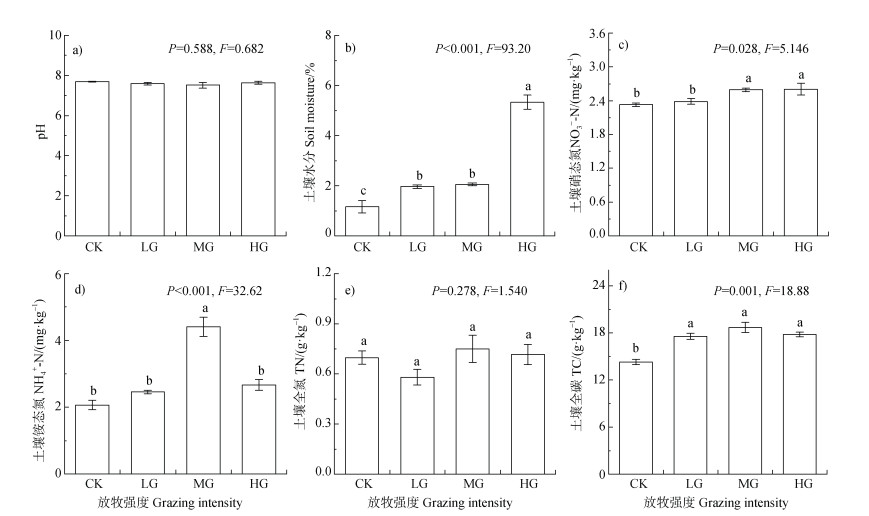
|
注:CK、LG、MG、HG分别表示无放牧强度、低放牧强度、中放牧强度和高放牧强度。不同小写字母表示处理间差异在0.05水平上显著。下同。 Note:CK,LG,MG,and HG represent no grazing intensity,low grazing intensity,medium grazing intensity and high grazing intensity,respectively. Different lowercase letters indicate a significant difference between treatments at the 0.05 level. The same below. 图 1 冬季放牧草地不同放牧强度下土壤性质的差异 Fig. 1 Differences in soil properties in different grazing intensities in winter pasture |
室内培养结果表明:所有土壤样本均能够氧化大气浓度CH4。不同放牧强度的土壤氧化CH4的速率不同,表明放牧强度会影响CH4的氧化活性。土壤培养63 h时,培养瓶内的甲烷浓度从初始的2.78 μL·L–1下降至1.17~1.83 μL·L–1(图 2a)。不同放牧强下,MOR的范围在0.008 6~0.014 5 nmol·h–1·g–1之间。与CK相比,HG和MG的MOR更高(P < 0.01)。这种趋势在LG中相反,与CK相比,LG的MOR显著降低(P < 0.01)(图 2b)。
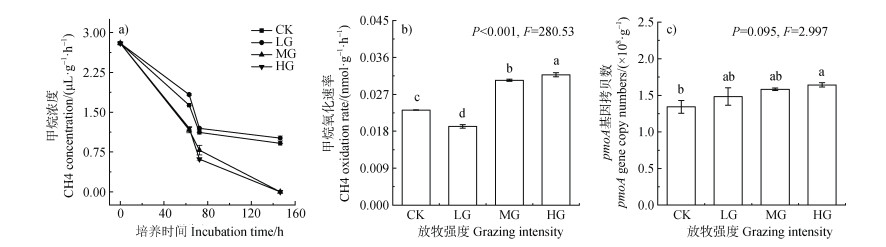
|
图 2 不同放牧强度下土壤氧化大气甲烷的动态变化(a)与大气甲烷氧化速率(b)及pmoA基因丰度(c) Fig. 2 Soil CH4 oxidation potential estimated by atmospheric concentration CH4 incubated with soils from different grazing intensities(a), the atmospheric CH4 oxidation rate(b)and soil methanotroph abundance estimated by pmoA gene abundance in the soil at different grazing intensities(c) |
土壤样品的 pmoA基因的qPCR结果表明,甲烷氧化菌的平均丰度在不同放牧强度的土壤之间存在差异。不同放牧强度下,甲烷氧化菌的基因拷贝数在1.34×108~1.64×108 copies·g–1之间。与CK相比,LG和MG的平均丰度增加,但在统计上无显著差异。HG下,平均相对丰度显著增加(图 2c)。
2.4 不同放牧强度下土壤甲烷氧化菌的多样性16S rRNA和pmoA基因测序结果均表明:不同放牧强度的土壤中甲烷氧化菌群落以USCγ为主,同时也存在传统的I型(Methylocaldum、甲基八叠球菌属(Methylosarcina))和II型(Methylocystis、Methylosinus)甲烷氧化菌。不同放牧强度下甲烷氧化菌的物种丰富度大体相似,但甲烷氧化菌的相对丰度受到放牧强度的影响(图 3)。在16S rRNA基因的结果中,USCγ为优势种,在总微生物中的占比为0.08%~0.11%。其次是Methylocaldum,占比为0.014%~0.051%。相比于CK,USCγ在MG和HG中占比增加,Methylocaldum明显减少。但在LG中Methylocaldum明显高于其他处理(图 3a)。土壤pmoA基因的高通量测序表明,土壤甲烷氧化菌群落以USCγ和USCγ-like JR3为主,占比达到87.01%~95.59%,传统甲烷氧化菌占比仅有3.72%~11.69%。相比于CK,放牧使USCγ的相对丰度在MG中增加,而使USCγ类的JR3和gp23在CK和LG中的占比较高(图 3b)。
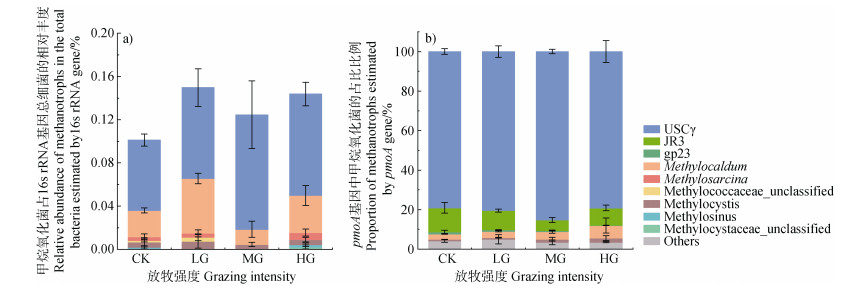
|
图 3 基于16S rRNA(a)和pmoA(b)基因扩增子测序得出的土壤甲烷氧化菌群落组成 Fig. 3 Soil methanotroph community composition estimated by amplicon sequencing of 16S rRNA(a)and pmoA(b)genes |
非度量多维尺度分析(NMDS)的甲烷氧化菌的β多样性表明,不同放牧强度下甲烷氧化菌的多样性存在差异(图 4a);USCγ的绝对数量与MOR的线性回归分析表明两者存在显著的相关性(图 4b)。皮尔森相关性的结果进一步证明了土壤中USCγ的绝对数量与MOR之间存在显著的正相关(P < 0.01)(图 4c),这说明USCγ是冬季放牧草地土壤中大气CH4氧化的潜在驱动者。同时,本研究发现土壤的
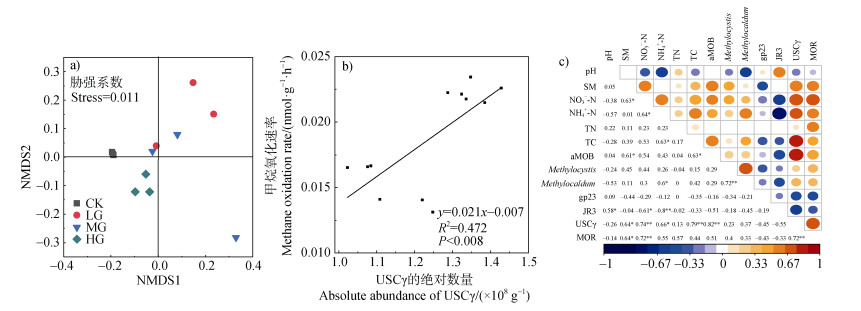
|
注:aMOB指甲烷氧化菌的丰度;*表示P < 0.05;**表示P < 0.01。 Note:aMOB refers to the abundance of methanotrophs;* means P < 0.05;** means P < 0.01. 图 4 非度量多维尺度分析(NMDS)微生物的β多样性(a)、CH4氧化速率与USCγ绝对数量之间的相关性分析(b)及甲烷氧化菌的绝对数量、CH4氧化速率与土壤性质之间的皮尔森相关性(c) Fig. 4 Non-metric multidimensional scaling(NMDS)plot illustrating the β diversity of methanotrophs(a), Correlation analysis between CH4 oxidation potential and the absolute number of USCγ by pmoA gene(b)and Pearson correlation illustrating the relationships between the absolute abundance of methanotrophs, CH4 oxidation potential and soil properties of 16S rRNA(c)genes |
本研究证实了黄土高原典型天然草地是大气甲烷汇,甲烷氧化速率在0.019 2到0.031 7 nmol·h–1·g–1之间(图 2a,图 2b),明显低于该地区野外测定甲烷吸收量(9.06×106 nmol·h–1·g–1)[27],也低于内蒙古典型草原(3.84 ± 0.18~10.04 ± 0.84 ng·g–1·h–1)以及青藏高原(5.73±0.54~16.74±1.17 ng·g–1·h–1)[11]。上述差异可能与不同类型草地土壤的理化性质有关。例如,内蒙古草原土壤pH较高(pH > 8),这有利于USCγ类群生长;此外内蒙古草原土壤中较高的含沙量(24.37%±1.62%~92.64%±3.27% [11]),可能增强土壤孔隙中CH4的扩散以及氧气的输送,从而促进甲烷氧化菌活性。与本实验土壤相比,青藏高原草甸草原具有较高的甲烷氧化潜力,可能源于土壤中甲烷氧化菌的多样性和丰度[15]较高。Methylocystis属普遍存在于青藏高原草甸土壤中,而Baani和Liesack[7]发现Methylocystis sp. SC2具有更好的环境适应能力,并且能氧化大气浓度CH4。
本研究结果表明,与CK相比,LG降低甲烷氧化速率,HG和MG显着增加了土壤CH4氧化能力(图 2a,图 2b),该结果与胡俊奇[14]在该样地原位测定的结果一致。但却与Wang等[10]发现的不同放牧强度均会促进甲烷的吸收且低强度促进效果最好的结果不一致。王跃思等[28]认为轻度放牧可能维持了半干旱地区甲烷氧化菌的最佳土壤湿度。也有研究[29]认为CH4的吸收也受一些生物因素(如净初级生产力、土壤微生物C/N供应和土壤微生物活动)的影响,而不是对土壤温度和水分的影响,很明显该说法与本研究不吻合。本研究认为LG低于CK和中高放牧强度,可能是因为土壤中USCγ的相对丰度及绝对数量低,Methylocaldum占比高(图 2c,图 3)造成的。
当然,本研究的结果与Wang等[30]报道的典型草地不同放牧强度影响甲烷吸收的趋势一致,最大的甲烷吸收量出现在中度放牧强度下。在冬季牧场中,动物的采食行为会直接影响地上生物、地下生物和微生物的生境,造成植被数量减少,而植物的残枝落叶增加。草地上枯落物的分解为甲烷氧化微生物的生活提供了必需的碳氮源,从而促进生长[31]。其次,放牧过程中,动物会对植物啃食和践踏,使地表解冻,缺水的土壤水分含量增加,植被的覆盖度减少和表层的土壤松动,大面积与空气接触,为甲烷氧化过程提供氧气,进而促进甲烷吸收[32]。最后,在半干旱土壤中,甲烷氧化菌不仅利用CH4,而且还具有利用土壤有机碳的能力。本研究中,相比CK,放牧处理下,土壤中的TC含量在放牧处理中显著增加,且与甲烷氧化菌的丰度、USCγ的绝对数量呈现显著的正相关(图 4c)。因此,TC也是间接影响MOR的主要因素。
放牧影响甲烷的氧化潜力,主要是通过影响甲烷氧化菌的丰度[17]。土壤甲烷氧化菌的丰度是土壤甲烷库容量的重要指标。在本研究中不同放牧强度下甲烷氧化菌的pmoA基因拷贝数在1.21×108~1.83×108 copies·g–1之间(图 3c),该数值在此前报道[17,33]的草地土壤甲烷氧化菌拷贝数的范围内。本研究中甲烷氧化的潜力与甲烷氧化菌的丰度存在极显著的正相关(图 4b),可以认为放牧影响了甲烷氧化菌的丰度,进而影响了甲烷的氧化速率。Zheng等[33]发现中强度放牧时,地上生物量(冠层高度)以及植物的生长因放牧而发生显着变化。在本研究中,未涉及植物,但结果发现,相比于CK,MG和HG增加了土壤的
甲烷氧化的潜力也受到甲烷氧化菌菌群结构的影响(图 4a)。不同放牧强度下,甲烷氧化菌的组成相似,仅相对丰度存在差异(图 3a,图 3b);pmoA测序结果显示,本研究中的草地土壤中以高亲和力的USCγ类群为主,同时也存在传统低亲和力甲烷氧化菌(图 3a)。这与16S rRNA基因的结果(图 3b)一致。甲烷氧化菌菌群是长期自然选择的结果,Knief等[34]研究认为,微生物多样性的改变最可能的原因是土壤的异质性、地理条件和气候,这可能是同一地区不同放牧条件下甲烷氧化菌组成类似的原因。本研究显示高亲和力的USCγ为优势的甲烷氧化菌,USCγ和USCγ-like JR3占pmoA基因总数的90%以上,Ma等[17]和Zhou等[18]也报道了在中国内蒙古草原USCγ占主导地位。本研究中典型草原的土壤环境条件与内蒙古草原土壤相似,说明这些土壤具有适宜的USCγ生长和生存环境条件。传统的II型Methylocystis和Methylosinus属也存在于本研究土壤样品中,其相对丰度含量较低,但不能忽视它们含双甲烷单加氧酶系统的事实[7]。在天然草地中,冰雪消融或雨季时,土壤水分含量急剧增加,导致氧气浓度减少并形成厌氧微域,进而导致产甲烷古菌的活性增强,释放出大量甲烷。此时,Methylocystis和Methylosinus属可能依赖厌氧土层释放的高浓度甲烷生长,并且储备营养物质以供其在大气低浓度的坏境下继续生长并氧化大气浓度甲烷。在本研究中,USCγ和USCγ-like JR3的占比高,且USCγ的绝对数量与MOR存在显著的正相关(图 4b),因此,USCγ是黄土高原典型草地的原位大气甲烷氧化的过程作用者。
在DNA水平上,对甲烷氧化菌绝对数量与环境因子进行皮尔森相关性分析,发现MOR与土壤水分、
本研究进一步证实了黄土高原典型草原冬季牧场土壤具有CH4氧化能力,并为滩羊放牧对甲烷氧化菌丰度、组成和甲烷氧化活性的影响提供了证据。本研究发现放牧能增加甲烷的氧化。USCγ和USCγ-like JR3类甲烷氧化菌在原位甲烷氧化菌群落中占主导地位,并可能是有大气浓度甲烷氧化的贡献者。MOR也与土壤中的土壤水分和
| [1] |
Denman K L. Couplings between changes in the climate system and biogeochemistry. Climate change 2007: The physical science basis[R]. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change, 2007.
(  0) 0) |
| [2] |
Cicerone R J, Oremland R S. Biogeochemical aspects of atmospheric methane[J]. Global Biogeochem Cycles, 1988, 2(4): 299-327. DOI:10.1029/GB002i004p00299
(  0) 0) |
| [3] |
Söhngen N L. Über bakterien, welche methan als kohlenst off nahrung und energiequelle gebrauchen[J]. Zentrabl Bakteriol Parasitenk Infektionskr, 1906, 15: 513-517.
(  0) 0) |
| [4] |
Whittenbury R, Phillips K C, Wilkinson J F. Enrichment, isolation and some properties of methane-utilizing bacteria[J]. Journal of General Microbiology, 1970, 61(2): 205-218. DOI:10.1099/00221287-61-2-205
(  0) 0) |
| [5] |
den Camp H J M O, Islam T, Stott M B, et al. Environmental, genomic and taxonomic perspectives on methanotrophic Verrucomicrobia[J]. Environmental Microbiology Reports, 2009, 1(5): 293-306. DOI:10.1111/j.1758-2229.2009.00022.x
(  0) 0) |
| [6] |
Kolb S, Knief C, Stubner S, et al. Quantitative detection of methanotrophs in soil by novel pmoA-targeted real-time PCR assays[J]. Applied and Environmental Microbiology, 2003, 69(5): 2423-2429. DOI:10.1128/AEM.69.5.2423-2429.2003
(  0) 0) |
| [7] |
Baani M, Liesack W. Two isozymes of particulate methane monooxygenase with different methane oxidation kinetics are found in Methylocystis sp. strain SC2[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(29): 10203-10208. DOI:10.1073/pnas.0702643105
(  0) 0) |
| [8] |
Hao Q Q, Liu F H, Zhang Y C, et al. Methylobacter accounts for strong aerobic methane oxidation in the Yellow River Delta with characteristics of a methane sink during the dry season[J]. Science of the Total Environment, 2020, 704: 135383. DOI:10.1016/j.scitotenv.2019.135383
(  0) 0) |
| [9] |
Tveit A T, Hestnes A G, Robinson S L, et al. Widespread soil bacterium that oxidizes atmospheric methane[J]. Proceedings of the National Academy of Sciences of the United States of America, 2019, 116(17): 8515-8524. DOI:10.1073/pnas.1817812116
(  0) 0) |
| [10] |
Wang Y F, Chen H, Zhu Q A, et al. Soil methane uptake by grasslands and forests in China[J]. Soil Biology and Biochemistry, 2014, 74: 70-81. DOI:10.1016/j.soilbio.2014.02.023
(  0) 0) |
| [11] |
Kou Y P, Li J B, Wang Y S, et al. Scale-dependent key drivers controlling methane oxidation potential in Chinese grassland soils[J]. Soil Biology and Biochemistry, 2017, 111: 104-114. DOI:10.1016/j.soilbio.2017.04.005
(  0) 0) |
| [12] |
Abell G C J, Stralis-Pavese N, Sessitsch A, et al. Grazing affects methanotroph activity and diversity in an alpine meadow soil[J]. Environmental Microbiology Reports, 2009, 1(5): 457-465. DOI:10.1111/j.1758-2229.2009.00078.x
(  0) 0) |
| [13] |
Wang Y F, Ji B M, Chen Z Z, et al. Preliminary results of a study on CH4 flux in Xilin River Basin steppe under different grazing intensities (In Chinese)[J]. Acta Phytoecologica Sinica, 2000, 24(6): 693-696. [王艳芬, 纪宝明, 陈佐忠, 等. 锡林河流域放牧条件下草原CH4通量研究结果初报[J]. 植物生态学报, 2000, 24(6): 693-696.]
(  0) 0) |
| [14] |
胡俊奇. 滩羊轮牧和氮添加对陇东典型草原氮素矿化和温室气体排放的影响[D]. 兰州: 兰州大学, 2017. Hu J Q. Effects of Tan sheep rotational grazing and N addition on soil N mineralization and GHG emissions of typical steppe in eastern Gansu Loess Plateau[D]. Lanzhou: Lanzhou University, 2017. (  0) 0) |
| [15] |
Deng Y C, Che R X, Wang F, et al. Upland Soil Cluster Gamma dominates methanotrophic communities in upland grassland soils[J]. Science of the Total Environment, 2019, 670: 826-836. DOI:10.1016/j.scitotenv.2019.03.299
(  0) 0) |
| [16] |
Liu C Y, Holst J, Brüggemann N, et al. Winter-grazing reduces methane uptake by soils of a typical semi-arid steppe in Inner Mongolia, China[J]. Atmospheric Environment, 2007, 41(28): 5948-5958. DOI:10.1016/j.atmosenv.2007.03.017
(  0) 0) |
| [17] |
Ma T L, Chen H, Wang Y F, et al. Effects of enclosure time on the community composition of methanotrophs in the soils of the Inner Mongolia grasslands[J]. Journal of Soils and Sediments, 2016, 16(3): 1022-1031. DOI:10.1007/s11368-015-1305-1
(  0) 0) |
| [18] |
Zhou X Q, Wang Y F, Huang X Z, et al. Effects of grazing by sheep on the structure of methane-oxidizing bacterial community of steppe soil[J]. Soil Biology and Biochemistry, 2008, 40(1): 258-261. DOI:10.1016/j.soilbio.2007.05.020
(  0) 0) |
| [19] |
Zhang X S. Vegetation of China and its geographic pattern: Illustration of the vegetation map of the People's Republic of China(1:1000000) (In Chinese). Beijing: Geological Publishing House, 2007. [张新时. 中国植被及其地理格局: 中华人民共和国植被图(1:1 000 000)说明书[M]. 北京: 地质出版社, 2007.]
(  0) 0) |
| [20] |
Wang Z, Wan X L, Tian M, et al. Grazing season alters soil respiration in a semiarid grassland on the Loess Plateau[J]. Nutrient Cycling in Agroecosystems, 2020, 118(2): 177-191. DOI:10.1007/s10705-020-10092-8
(  0) 0) |
| [21] |
Zhou X, Fornara D, Wasson E A, et al. Effects of 44 years of chronic nitrogen fertilization on the soil nitrifying community of permanent grassland[J]. Soil Biology and Biochemistry, 2015, 91: 76-83. DOI:10.1016/j.soilbio.2015.08.031
(  0) 0) |
| [22] |
Costello A M, Lidstrom M E. Molecular characterization of functional and phylogenetic genes from natural populations of methanotrophs in lake sediments[J]. Applied and Environmental Microbiology, 1999, 65(11): 5066-5074. DOI:10.1128/AEM.65.11.5066-5074.1999
(  0) 0) |
| [23] |
Stubner S. Enumeration of 16S rDNA of Desulfotomaculum lineage 1 in rice field soil by real-time PCR with SybrGreen detection[J]. Journal of Microbiological Methods, 2002, 50(2): 155-164. DOI:10.1016/S0167-7012(02)00024-6
(  0) 0) |
| [24] |
Schloss P D, Westcott S L, Ryabin T, et al. Introducing mothur: Open-source, platform-independent, community-supported software for describing and comparing microbial communities[J]. Applied and Environmental Microbiology, 2009, 75(23): 7537-7541. DOI:10.1128/AEM.01541-09
(  0) 0) |
| [25] |
Cai Y F, Zhou X, Shi L M, et al. Atmospheric methane oxidizers are dominated by upland soil cluster alpha in 20 forest soils of China[J]. Microbial Ecology, 2020, 80(4): 859-871. DOI:10.1007/s00248-020-01570-1
(  0) 0) |
| [26] |
Bourne D G, Mcdonald I R, Murrell J C. Comparison of pmoA PCR primer sets as tools for investigating methanotroph diversity in three Danish soils[J]. Applied and Environmental Microbiology, 2001, 67(9): 3802-3809. DOI:10.1128/AEM.67.9.3802-3809.2001
(  0) 0) |
| [27] |
Yang H L, Chen X J, Hou F J. Greenhouse gases emissions of rangeland and livestock manure in the eastern Gansu Loess Plateau in summer (In Chinese)[J]. Pratacultural Science, 2016, 33(8): 1454-1459. [杨晗蕾, 陈先江, 侯扶江. 陇东黄土高原草地与畜粪夏季的温室气体排放[J]. 草业科学, 2016, 33(8): 1454-1459.]
(  0) 0) |
| [28] |
Wang Y S, Ji B M, Huang Y, et al. Effects of grazing and cultivating on emission of nitrous oxide, carbon dioxide and uptake of methane from grasslands (In Chinese)[J]. Envionmental Science, 2001, 22(6): 7-13. [王跃思, 纪宝明, 黄耀, 等. 农垦与放牧对内蒙古草原N2O, CO2排放和CH4吸收的影响[J]. 环境科学, 2001, 22(6): 7-13.]
(  0) 0) |
| [29] |
Zhang L H, Guo D F, Niu S L, et al. Effects of mowing on methane uptake in a semiarid grassland in northern China[J]. PLoS One, 2012, 7(4): e35952. DOI:10.1371/journal.pone.0035952
(  0) 0) |
| [30] |
Wang X Y, Zhang Y J, Huang D, et al. Methane uptake and emissions in a typical steppe grazing system during the grazing season[J]. Atmospheric Environment, 2015, 105(3): 14-21.
(  0) 0) |
| [31] |
Zhang Z J, Huang Y F, Guo X F, et al. Grazing behavior of goats on artificial pastures in southern China and its effects on herbage biomass (In Chinese)[J]. Chinese Journal of Grassland, 2013, 35(3): 67-71. [张子军, 黄桠锋, 郭晓飞, 等. 南方人工草地山羊牧食行为及对牧草生物量的影响[J]. 中国草地学报, 2013, 35(3): 67-71.]
(  0) 0) |
| [32] |
Hou F J, Yang Z Y. Effects of grazing of livestock on grassland (In Chinese)[J]. Acta Ecologica Sinica, 2006, 26(1): 244-264. [侯扶江, 杨中艺. 放牧对草地的作用[J]. 生态学报, 2006, 26(1): 244-264.]
(  0) 0) |
| [33] |
Zheng Y, Yang W, Sun X, et al. Methanotrophic community structure and activity under warming and grazing of alpine meadow on the Tibetan Plateau[J]. Applied Microbiology and Biotechnology, 2012, 93(5): 2193-2203. DOI:10.1007/s00253-011-3535-5
(  0) 0) |
| [34] |
Knief C, Vanitchung S, Harvey N W, et al. Diversity of methanotrophic bacteria in tropical upland soils under different land uses[J]. Applied and Environmental Microbiology, 2005, 71(7): 3826-3831. DOI:10.1128/AEM.71.7.3826-3831.2005
(  0) 0) |
| [35] |
Pan H, Li Y, Meng C M, et al. Effects of nitrogen levels on interactions between active methanotrophsand nitrifiers (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(2): 557-567. [潘红, 李勇, 孟春梅, 等. 氮素水平对土壤甲烷氧化和硝化微生物相互作用的影响[J]. 土壤学报, 2022, 59(2): 557-567.]
(  0) 0) |
| [36] |
Liu B, Elberling B, Jia Z J. The emergence of novel methane oxidizers in greenland permafrost soil under periodically water saturated conditions (In Chinese)[J]. Soils, 2020, 52(1): 90-96. [刘蓓, Elberling B, 贾仲君. 不同水分条件下格陵兰岛冻土活性甲烷氧化菌群落分异规律[J]. 土壤, 2020, 52(1): 90-96.]
(  0) 0) |
| [37] |
van den Pol-van Dasselaar A, van Beusichem M L, Oenema O. Effects of soil moisture content and temperature on methane uptake by grasslands on sandy soils[J]. Plant and Soil, 1998, 204(2): 213-222.
(  0) 0) |
 2023, Vol. 60
2023, Vol. 60


