2. 江苏省土壤利用与农业可持续发展工程研究中心, 南京 210023;
3. 江苏省地理信息资源开发与利用协同创新中心, 南京 210023
2. Engineering Research Center for Soil Utilization and Agricultural Sustainable Development of Jiangsu Province, Nanjing 210023, China;
3. Collaborative Innovation Center for the Development and Utilization of Jiangsu Geographic Information Resources, Nanjing 210023, China
植物生长于土壤,从土壤中获取水分和养分,同时改变土壤性质,进而影响植物自身和后续植物的生长,这一现象称为植物-土壤反馈效应(Plant- Soil Feedback,PSF)[1]。对于自然陆地生态系统,PSF是土壤发育、植物演替和植物多样性形成的重要驱动因素[2-4]。对于作物由人类选择,果实被人类收获,植物多样性不足且物质循环开放度高的农田生态系统,PSF通常表现为负效应,最为典型的即为作物连作障碍,是制约农业可持续发展的关键障碍因素。在农业生产的不同发展阶段,PSF效应的表现症状不同。在传统农业生产阶段,主要表现为因作物收获而导致的土壤有机质含量下降和养分贫化。化肥的生产和施用极大地缓解了农业生产导致的土壤养分贫化问题,但也带来了一系列生态环境问题。在现代集约化农业中,因单一作物种植,地上植物多样性下降,产量提高,作物土传病频发成为负PSF效应的主要表现症状[5],给农业生产造成了巨大的经济损失[6]。经过科学工作者长期的努力,虽然已经发展出了消除或缓解负PSF效应的多种方法以防控作物土传病,包括土壤灭菌、接种有益(或拮抗)微生物、大量施用有机肥等,但仍未从根本上解决集约化农业生产的作物土传病频发问题。本文探讨利用土壤微生物有机物质偏好,通过在作物生长过程中添加有益菌偏好利用或具有抑制病原菌生长的有机物质,激活土壤微生物,抑制作物土传病的理论基础和现实可能性。
1 植物-土壤反馈效应的产生机理植物生长对土壤性质的影响是全方位的,包括对土壤剖面结构、物理、化学和生物学性质的影响,这些影响改变土壤环境,进而影响植物生长,即,植物-土壤反馈效应(PSF)。PSF效应是陆地生态系统的客观存在。与裸露土壤相比,植物覆盖保护土壤免受风蚀和水蚀,改变土壤温度和水分含量;根系穿插挤压土壤颗粒,根系死亡腐烂后留下孔隙等改变土壤剖面结构和水分迁移特性。根分泌物溶蚀土壤矿物,促进养分元素的释放;植物与固氮菌共生活化大气氮,主动或被动地从土壤中摄取磷、钾等大量、中量和微量营养元素,并以凋落物、死亡根等回归土壤,不仅为土壤微生物提供了有机物质,而且不断积累有效养分[7]。因此,不受人为干扰的自然陆地生态系统,植物对土壤物理和化学性质的影响多表现为正反馈效应,尤其在土壤形成发育的初期,植物的生长是土壤形成、演化不可或缺的驱动因素。在干旱、半干旱区灌丛形成的“肥岛”[2]很典型地体现了正PSF效应。但是,在干旱、半干旱区,深根系、耗水量大的植物则可能在土壤剖面的某一层次形成“干土层”,对后续植物的生长产生严重的不利影响[8]。在湿润的气候条件下,被植物活化的盐基离子易随水迁移出土壤,加剧土壤酸化;一些植物根系分泌酸性物质而使土壤酸化,不利于后续植物的生长,产生负PSF效应[9]。
植物源有机物质是土壤生物最基本的能源和碳源。植物生长改变土壤生物群落结构和功能,转而影响植物本身及其后续植物的生长。植物根系生长改变根际环境,如pH、水分和有效养分浓度等,并为根际微生物提供可利用的有机物质,包括病原微生物偏好利用的化感物质等。植物为了自身生长的需要,可以与多种微生物形成共生关系,最为典型的是共生固氮菌、各种菌根菌和内生菌。根系还可分泌信号物质,招募植物促生菌或其他有益菌[10-11]。由于根分泌物为微生物生长提供了可利用的有机物质,根际通常具有更大的微生物生物量。但由于不同种类的微生物对生长环境和利用有机物质的偏好不同,偏好根际环境且偏好以根分泌物、脱落物为碳源和能源的微生物在根际相对富集,导致根际微生物的多样性下降[10,12],植物病原生物绝对或相对富集[13]。植物改变土壤微生物群落,富集病原生物导致后续同种(科)植物的土传病害发病率提高,通常不利于后续同种(科)植物的生长,即大多表现为负PSF效应,鲜有正PSF效应的发生。但是,植物-土壤在土壤微生物方面的负PSF效应却是形成植物多样性和驱动植物演替的关键因素[3-4]。当具有生长优势的植物种类丰度不断增加,伴随该种类植物的土传病原生物开始富集,土传病发病率提高,导致该种类植物丰度下降,为其他种类植物的生长留出了空间,在同一区域内形成植物多样性。由于地上植物多样性与地下生物多样性的正相关性[14],地上植物多样性增加的同时,地下生物多样性随之增加[15],反馈抑制该植物土传病原菌的致病性[16],最终使该植物在一定的丰度范围内达到动态平衡状态[3]。因此,PSF效应在自然陆地生态系统形成相对稳定、多样化的地上植物群落中发挥着关键性作用(图 1)。

|
图 1 自然陆地生态系统土传病原菌、土壤微生物多样性和植物多样性相互作用示意图(实线表示已知的过程,虚线表示可能存在的过程;红色箭头表示抑制,蓝色箭头表示促进) Fig. 1 Schematic diagram of the interactions between soil-borne pathogens, soil microbial biodiversity and plant biodiversity in natural terrestrial ecosystems(Solid lines represent known processes, and dashed lines represent possible processes; red arrows refer to suppression, blue arrows refer to promotion) |
不同于自然陆地生态系统,农田生态系统的植物(作物)由人类选择,植物积累的光合产物大部分被人类收获而移出生态系统,既降低了植物对土壤的保护作用,加重了土壤侵蚀[17],又带走了植物生产的有机物质和从土壤中吸收的养分,导致土壤有机质含量下降,养分日益贫化。因此,自然陆地生态系统开垦成为农田后,土壤有机质含量普遍下降[18]。农田生态系统单一作物种植和清除杂草,地上植物多样性低,进而降低土壤生物多样性[5,19],削弱对作物土传病原生物的抑制作用(图 1),因而作物土传病频发。由此可见,由于人类的干扰,农田生态系统多表现为负PSF效应,土壤生产力持续下降是客观存在的自然规律。其中,同种或同科作物连续种植的连作障碍现象是最典型的负PSF效应。先人们在原始的农业生产阶段即已注意到了单一作物连续种植带来的连作障碍问题,发现轮作是消除连作障碍的最佳途径。早在公元前814年,欧洲已经开始采用休闲和包括豆科植物的轮作以消除负PSF效应[1]。
为了消除负PSF效应对农田可持续生产力的制约作用,在利用农田收获物后,先人们尽量将残余物回归土壤,以减缓土壤有机质含量和有效养分的下降速度,保持“地力常新壮”[20]。但是,这样的回归不可能完全,养分亏缺始终是制约传统农业作物产量提高和可持续发展的关键因素。1840年李比希矿质营养学说的建立不仅明确了植物的无机营养本质,还推动了化肥工业的发展。以1842年劳韦斯(Lawew J.)建立以骨粉和硫酸为原料生产过磷酸钙的化工厂为标志,开启了农业史上的化肥农业时代。1913年氮肥实现工业化生产后,作物养分不足的瓶颈问题逐渐得以缓解,作物产量大幅度提高,为满足全球人口不断增加对粮食的需求做出了不可替代的贡献[21]。然而,因此也带来了一系列副作用,其中之一是化肥的不合理施用或过量施用严重威胁生态环境安全[22]。权衡粮食安全和生态环境安全是施用化肥必须遵循的原则。
化肥的广泛施用极大地提高了作物产量,但不断提高的作物产量激发了作物土传病原生物的活性,作物土传病成为制约集约化农业可持续发展的瓶颈问题。为了解决集约化农业生产面临的作物土传病频发问题,科学工作者从种植制度、育种、植保和土壤管理等不同的领域角度出发,提出了一系列对策措施,如轮作、培育抗病品种、土壤灭菌、接种拮抗菌、增施有机肥等。其中,在种植作物前对土壤灭菌是消除生物负PSF效应的常用方法。溴甲烷作为化学灭菌的熏蒸剂,曾经在发达国家广泛应用,在土壤灭菌方面取得了显著的成效。但由于其对大气臭氧的破坏作用,而被《关于耗损臭氧层物质的蒙特利尔议定书》禁用[23]。为了替代溴甲烷熏蒸灭菌方法,科学工作者不断研发出新的土壤灭菌方法,如强还原土壤灭菌[24]等。
在作物生长过程中,抑制生物负PSF效应的发生则是维持集约化农业生产土壤健康的另一种思路,措施之一是接种生防菌制剂或施用具有抑病效果的生物有机肥,抑制作物土传病原生物丰度的提高或其致病性。据报道,截止2021年11月,我国登记注册的生物农药已达542种,登记注册宣称具有抑病效果的生物有机肥则更数以千计[25]。生防菌剂和生物有机肥在商业上取得了较大的成功,但在生产实际中的抑病效果仍有待进一步的验证[25-27]。接种合成菌群似乎具有更好的土传病害防治效果[26-27]。但是,合成菌群仍然未能克服接种到土壤中的有益菌或拮抗菌在土壤中的存活率低,抑病效果未能如在实验室条件下充分发挥的障碍[26,28]。这一障碍的发生一般归之于接种的生防菌难以与土壤中原有微生物竞争资源或者土壤环境不适宜于接种微生物的生存等[28],但是鲜有将这些障碍因素进一步具体化的研究报道,因而多流于概念,至今仍然缺少消除接种菌株存活和定殖难的针对性方法、技术和措施。
土壤是最重要的微生物种质资源库,以微生物与作物的关系划分,包括有益菌、中性菌和病原菌。事实上,商品化的生防菌或有益菌大多从土壤中分离而来。通过土壤管理,激发土壤原有有益微生物的生长,抑制土传病原菌对作物的侵染,可能是防控作物土传病害的另一条途径[28]。为此,我们必须回答一个关键问题:如何激活土壤有益微生物?
3 有机物质塑造根际微生物群落结构及功能土壤中占主导的是化能有机营养型微生物,包括土传病原菌,它们从分解植物凋落物、根脱落物、根分泌物等植物源有机物质中获取能量、碳和其他营养元素。虽然土壤微生物从植物源有机物质中获取能量和营养元素的详细过程及其影响因素至今仍有大量未能回答的科学问题,但是一般认为地上植物多样性驱动土壤生物多样性的介质是植物为土壤各种生物提供所需的多样化的有机物质[14]。土壤微生物总体上处于有机物质供应不足的饥饿状态,植物源有机物质的供应速率制约着土壤微生物的生长和活性,特别是营r-策略土壤微生物的生长和活性[29]。由于可利用的有机物质不足,土壤中处于活跃状态的微生物一般不超过2%,添加可利用有机物质可大幅度激发土壤微生物活性[30]。优越环境条件下繁殖的拮抗菌和有益菌,接种到土壤后可供其利用的有机物质不足可能是其存活难的主要原因。
生物和非生物因素在根际微生物组装中同时发挥着作用,然而,对于处于饥饿状态的土壤微生物而言,植物提供的有机物质组成对塑造根际微生物群落似乎有着更为重要的作用。一个有力的证据是植物凋落物在原地的分解速率大于异地分解速率,这一现象称为主场优势(Home-field advantage)[31]。已经证明,化能有机营养型微生物可以利用多种有机物质,但存在一定的偏好[32]。植物凋落物在原地分解形成主场优势表明该植物提供的有机物质促进了偏好利用该植物源有机物质的土壤微生物的生长和富集,进而加速对新输入的同种植物凋落物的分解。不同种类的植物共存则为土壤微生物提供多样化的植物源有机物质,供有机物质偏好不同的土壤微生物利用,因而能够保持土壤微生物的多样性[14]。
对于农田生态系统,根分泌物是土壤微生物最主要的可利用的有机物质来源,起着塑造根际微生物群落结构的作用[33]。由于根分泌物的组成成分因作物种类、作物品种、生长阶段、土壤养分供应状况、土壤微生物库等而异,因而作物根际微生物群落结构和丰度分布表现出丰富和多变的特性[6]。抗病品种和敏感品种根分泌物组成成分的差异很可能是同种作物抗病性不同的原因之一[34-35]。
虽然轮作、间作、覆盖作物等种植制度通常并非专门为抑制土传病原生物而设计,最初的目的主要在于充分利用光能、水资源和养分资源,减少土壤侵蚀,避免连作障碍而蒙受经济损失等[36-37],但这些种植制度客观上增加了地上生物多样性,因而具有增加土壤微生物多样性,抑制土传病害的作用[38]。轮作、间作和覆盖作物在提高土壤微生物多样性,防控作物土传病害方面的作用已有大量的成功案例报道[39-40]。然而,由于缺乏各类土壤微生物偏好利用的有机物质组分的基础知识,且对根分泌物中土壤微生物可利用成分的认识有限,如以抑制土传病原菌、提高土壤微生物多样性为目标,轮作、间作和覆盖作物的选择存在很大的盲目性,效果的可预期性极低。
嫁接是提高瓜果作物抗病性的有效手段[41]。Ling等[42]的分析表明,将西瓜嫁接于葫芦上,嫁接西瓜的根分泌物同时含有葫芦根分泌物的成分和西瓜根分泌物的成分。因此,嫁接作物根系分泌物中有机物质组分多样性的提高可能也是其抗病性提高的作用机理之一。
当前对根分泌物塑造根际微生物群落的研究多从根分泌物中的化感物质和信号物质着手,分离出了一系列具有抑制或促进病原微生物生长的代谢产物[43-44],很少从根分泌物组成对根际微生物群落组成和丰度分布的塑造作用角度进行研究。可以设想,即使化感物质、信号物质激发起特定种类土壤微生物的活性,若无有机物质为其提供碳源和能量,它们仍然难以有效发挥作用。
4 选择添加有机物质激发土壤有益微生物活性,防控作物土传病害从上述分析可以看出,保持土壤微生物可利用有机物质种类多样性是维持土壤微生物多样性的关键。农田生态系统由于地上植物的单一性,导致供给土壤微生物可利用的有机物质种类单一,微生物多样性下降,削弱对土传病原生物的抑制作用,从而导致作物土传病频发(图 1)。因此,在理论上存在这样的可能,即:在作物生长过程中,有针对性地添加多种有机物质,维持土壤微生物可利用的有机物质种类多样性,达到保持农田生态系统土壤微生物多样性,抑制作物发生土传病的目的。我们的初步研究结果证明了这一可能性,并且发现,在接种青枯菌的土壤中种植番茄,在番茄生长过程中,添加不同种类的有机物质,随着添加的有机物质种类增加,抑制番茄青枯病的效率提高,当添加的有机物质种类数量大于6种时,番茄青枯病得到有效抑制,其中碳水化合物和脂肪酸类有机物质抑病效果优于氨基酸类有机物质[32]。
施用化肥的经验教训告诉我们,根据土壤养分供应水平和作物需求,选择适宜的化肥品种,适时、适量地施用化肥,方可最大程度地发挥化肥的作用,提高作物产量,同时减少化肥对生态环境的危害。化肥种类选择不当或营养元素配比不当,施用时间和施用量不合适,不仅难以实现预期产量目标,而且对土壤肥力和生态环境产生不利影响。与此相类似,如果添加的有机物质种类、剂量、时间等不合适,就有可能不但不能抑制作物土传病,反而有可能加重作物土传病。有机肥防控作物土传病的实际效果很好地说明了这一点。施用不同的有机肥提高土壤微生物可利用有机物质的多样性[45],因而可以抑制土传病原生物的致病性,这样的案例已有大量的报道[46]。但是,由于有机肥成分的复杂性及缺乏对土壤微生物偏好利用的有机物质种类的认知,有机肥在抑制作物土传病害方面的作用效果不一。可以设想如果施用的有机肥组成更偏好于土传病原菌利用,则不但难以起到抑制作物土传病害的作用,反而会促进土传病原菌生长,提高作物土传病的发病率,这样的案例也不在少数[46]。因此,添加有机物质,为土壤有益微生物提供碳源和能量,从概念到研制成可应用的由多种有机物质组成的有机制剂,需要解决大量的科学和技术问题,其中,最为基础的则是掌握土壤各种微生物偏好利用的有机物质种类。
由于土壤微生物种类繁多,明确全部土壤微生物种类的有机物质偏好似乎是一项难以完成的任务。已有的研究表明,抑病土壤区分为一般性抑病土壤和特异性抑病土壤,前者依靠土壤微生物群体(多样性)抑制土传病原菌,后者依靠专一性有益菌或拮抗菌抑制土传病原菌[47]。我们的研究表明,即使是非专一性抑病菌株,随着合成菌群的菌种数增加,抑制番茄青枯病的有效性提高,当合成菌群的菌株数达到8种,且添加的有机物质种类足够多时,即可抑制番茄青枯病[32]。由此可以推测,发挥抑病作用的只是那些处于活跃状态的微生物种类,而不是土壤微生物全部种类。因此,以活性微生物多样性代替包括处于休眠状态的微生物多样性可能更能真实地反映微生物多样性与抑病性的关系。考虑到土壤微生物仅有不足2%处于活性状态的事实[30],明确处于活性状态的土壤微生物偏好利用的有机物质种类可能并不是一件不可完成的任务。
根分泌物含有多种有机物质,包括高分子量的蛋白质、植物粘液和低分子量的初级代谢产物和次级代谢产物,前者如氨基酸、糖、羧酸盐等,后者如索尔孕酮、黄酮、香豆素等[48]。添加区区几种有机物质,对于有机物质种类总数量的影响似乎并不大。一种可能性是根分泌物中只有绝少部分成分发挥塑造根际微生物群落结构的关键作用。然而,是哪些成分?它们成为关键成分是因为它们在根分泌物中的相对丰度还是因为它们发挥的生理和生化特性?这些都是有待回答的科学问题。
添加有机物质抑制作物土传病害必然受各种环境条件的限制,如土壤和作物类型,作物生长期等,需要进行大量的研究和试验,不断地总结和归纳。我们的研究表明,土壤微生物对有机物质的利用大多只是偏好,而非专性利用或专性排斥[32]。在可利用有机物质贫乏的环境下,首先接触可利用有机物质的微生物,即使无偏好,由于先发优势而可能利用这类有机物质以继续维持其生命活动。如果土传病原菌丰度高,且处于活跃状态,它们有可能首先利用无偏好利用的添加到土壤的有机物质。所以,当土传病原菌丰度高时,种植之前进行土壤灭菌仍然是必要的。总之,为达到最佳抑病效果,需要进行大量的研究和实践,以确定各种作物在不同生长阶段需要的有机物质适宜添加剂量、添加时间和添加方法等。
5 展望基于农田生态系统土壤微生物主要依赖根分泌物和脱落物保持其活性,微生物可利用有机物质种类多样性塑造土壤微生物多样性的事实,在作物生长过程中,施肥为作物补充无机营养,针对性地添加有益菌/拮抗菌偏好利用的有机物质,保持土壤微生物可利用有机物质种类多样性,促进活性微生物多样性,消除或缓解土传病障碍(图 2),可能是一条维持集约化农业土壤生物健康的有效途径。虽然将这一设想转化成为现实涉及大量科学和技术问题,但这可能不仅是一条抑制作物土传病的新途径,而且可能发展出生产和销售农用有机制剂的产业。接种有益菌/拮抗菌时,添加该类菌剂偏好利用的有机制剂,可能促进其在土壤中的定殖;配合滴灌技术,将有机制剂精准输入到根系,或制成缓释有机制剂施用于根际,缓慢释放有机物质,有可能抑制作物土传病,维持土壤健康,对于多年生果树等则可延长其生产周期。因此,在集约化生产条件下,添加有机物质,激活土壤微生物,保持土壤微生物多样性,抑制作物土传病,是一条值得探索的途径。
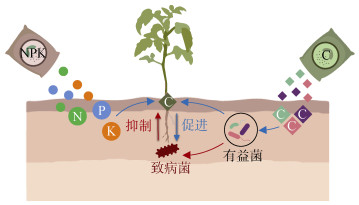
|
图 2 在集约化生产中,有针对性地添加土壤有益/拮抗微生物偏好利用的有机物质(C),维持农田土壤生物多样性,促进作物健康示意图 Fig. 2 Schematic diagram of the targeted addition of organics(C) preferentially used by soil beneficial/antagonistic microbes to maintain farmland soil biodiversity and promote crop health in intensive production(red arrows refer to suppression, blue arrows refer to promotion) |
| [1] |
van der Putten W H, Bardgett R D, Bever J D, et al. Plant-soil feedbacks: The past, the present and future challenges[J]. Journal of Ecology, 2013, 101: 265-276. DOI:10.1111/1365-2745.12054
(  0) 0) |
| [2] |
Ochoa-Hueso R, Eldridge D J, Delgado-Baquerizo M, et al. Soil fungal abundance and plant functional traits drive fertile island formation in global drylands[J]. Journal of Ecology, 2018, 106: 242-253. DOI:10.1111/1365-2745.12871
(  0) 0) |
| [3] |
Chen L, Swenson N G, Ji N N, et al. Differential soil fungus accumulation and density dependence of trees in a subtropical forest[J]. Science, 2019, 366: 124-128. DOI:10.1126/science.aau1361
(  0) 0) |
| [4] |
Lalibert E, Lambers H, Burgess T I, et al. Phosphorus limitation, soil-borne pathogens and the coexistence of plant species in hyperdiverse forests and shrublands[J]. New Phytologist, 2015, 206: 507-521. DOI:10.1111/nph.13203
(  0) 0) |
| [5] |
Mariotte P, Mehrabi Z, Bezemer T M, et al. Plant-soil feedback: Bridging batural and agricultural sciences[J]. Trends in Ecology & Evolution, 2018, 33: 129-142.
(  0) 0) |
| [6] |
Wong J W H, Plett J M. Root renovation: how an improved understanding of basic root biology could inform the development of elite crops that foster sustainable soil health[J]. Functional Plant Biology, 2019, 46: 597-612. DOI:10.1071/FP18200
(  0) 0) |
| [7] |
Bennett J A, Klironomos J. Mechanisms of plant-soil feedback: Interactions among biotic and abiotic drivers[J]. New Phytologist, 2019, 222: 91-96. DOI:10.1111/nph.15603
(  0) 0) |
| [8] |
Wang Y Q. Spatial distribution and influence factors of dried soil layers across the Loess Plateau[D]. Beijing: Graduate University of Chinese Academy of Sciences, 2010.[王云强. 黄土高原地区土壤干层的空间分布与影响因素[D]. 北京: 中国科学院研究生院, 2010.]
(  0) 0) |
| [9] |
Kanbar H J, Matar Z, Safa G A A, et al. Selective metal leaching from technosols based on synthetic root exudate composition[J]. Journal of Environmental Science, 2020, 96: 85-92. DOI:10.1016/j.jes.2020.04.040
(  0) 0) |
| [10] |
Bakker P A H M, Berendsen R L, van Pelt J A, et al. The soil-borne identity and microbiome-assisted agriculture: Looking back to the future[J]. Molecular Plant, 2020, 13: 1394-1401. DOI:10.1016/j.molp.2020.09.017
(  0) 0) |
| [11] |
Ulbrich T C, Rivas-Ubach A, Tiemann L K, et al. Plant root exudates and rhizosphere bacterial communities shift with neighbor context[J]. Soil Biology and Biochemistry, 2022, 172: No108753. DOI:10.1016/j.soilbio.2022.108753
(  0) 0) |
| [12] |
Ling N, Wang T T, Kuzyakov Y. Rhizosphere bacteriome structure and functions[J]. Nature Communications, 2022, 13: No836. DOI:10.1038/s41467-022-28448-9
(  0) 0) |
| [13] |
Balendres M A, Nichols D S, Tegg R S, et al. Metabolomes of potato root exudates: Compounds that stimulate resting spore germination of the soil-borne pathogen Spongospora subterranea[J]. Journal of Agricultural and Food Chemistry, 2016, 64: 7466-7474. DOI:10.1021/acs.jafc.6b03904
(  0) 0) |
| [14] |
Hooper D U, Bignell D E, Brown V K, et al. Interactions between aboveground and belowground biodiversity in terrestrial ecosystems: Patterns, mechanisms, and feedbacks[J]. BioScience, 2000, 50: 1049-1061. DOI:10.1641/0006-3568(2000)050[1049:IBAABB]2.0.CO;2
(  0) 0) |
| [15] |
Keesing F, Ostfeld R S. Is biodiversity good for your health?[J]. Science, 2015, 349: 235-236. DOI:10.1126/science.aac7892
(  0) 0) |
| [16] |
Rottstock T, Joshi J, Kummer V, et al. Higher plant diversity promotes higher diversity of fungal pathogens, while it decreases pathogen infection per plant[J]. Ecology, 2014, 95: 1907-1917. DOI:10.1890/13-2317.1
(  0) 0) |
| [17] |
Montgomery D R. Soil erosion and agricultural sustainability[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104: 13268-13272.
(  0) 0) |
| [18] |
Song G H, Li L Q, Pan G X, et al. Topsoil organic carbon storage of China and its loss by cultivation[J]. Biogeochemistry, 2005, 74: 47-62. DOI:10.1007/s10533-004-2222-3
(  0) 0) |
| [19] |
Mommer L, Cotton T E A, Raaijmakers J M, et al. Lost in diversity: The interactions between soil-borne fungi, biodiversity and plant productivity[J]. New Phytologist, 2018, 218: 542-553. DOI:10.1111/nph.15036
(  0) 0) |
| [20] |
Yan L, He Y. Analysis of the thought of "land productivity maintains strong" in Chinese traditional agriculture (In Chinese)[J]. Rural Economics, Science and Technology, 2020, 31: 4-7. [阎莉, 贺扬. 中国传统农业的"地力常新壮"思想探析[J]. 农村经济与科技, 2020, 31: 4-7.]
(  0) 0) |
| [21] |
Erisman J W, Sutton M A, Galloway J, et al. How a century of ammonia synthesis changed the world[J]. Nature Geoscience, 2008, 1: 636-639. DOI:10.1038/ngeo325
(  0) 0) |
| [22] |
Galloway J N, Townsend A R, Erisman J W, et al. Transformation of the nitrogen cycle: Recent trends, questions, and potential solutions[J]. Science, 2008, 320: 889-892. DOI:10.1126/science.1136674
(  0) 0) |
| [23] |
Colla P, Gilardi G, Gullino M L. A review and critical analysis of the European situation of soilborne disease management in the vegetable sector[J]. Phytoparasitica, 2012, 40: 515-523. DOI:10.1007/s12600-012-0252-2
(  0) 0) |
| [24] |
Cai Z C, Zhang J B, Huang X Q, et al. Application of reductive soil disinfestation to suppress soil-borne pathogens (In Chinese)[J]. Acta Pedologica Sinica, 2015, 52(3): 469-476. [蔡祖聪, 张金波, 黄新琦, 等. 强还原土壤灭菌防控作物土传病的应用研究[J]. 土壤学报, 2015, 52(3): 469-476.]
(  0) 0) |
| [25] |
Meng J, Zhang X, Han X, et al. Application and development of biocontrol agents in China[J]. Pathogens, 2022, 11: No1120. DOI:10.3390/pathogens11101120
(  0) 0) |
| [26] |
Mazzola M, Freilich S. Prospects for biological soilborne disease control: Application of indigenous versus synthetic microbiomes[J]. Phytopathology, 2017, 107: 256-263. DOI:10.1094/PHYTO-09-16-0330-RVW
(  0) 0) |
| [27] |
Niu B, Wang W, Yuan Z, et al. Microbial interactions within multiple-strain biological control agents impact soil-borne plant disease[J]. Frontiers in Microbiology, 2020, 11: No585404. DOI:10.3389/fmicb.2020.585404
(  0) 0) |
| [28] |
Maraha N, Backman A, Jansson J K. Monitoring physiological status of GFP-tagged Pseudomonas fluorescens SBW25 under different nutrient conditions and in soil by flow cytometry[J]. FEMS Microbiology Ecology, 2004, 51: 123-132. DOI:10.1016/j.femsec.2004.07.007
(  0) 0) |
| [29] |
Joergensena R G, Wichern F. Alive and kicking: Why dormant soil microorganisms matter[J]. Soil Biology and Biochemistry, 2018, 116: 419-430. DOI:10.1016/j.soilbio.2017.10.022
(  0) 0) |
| [30] |
Blagodatskaya E, Kuzyakov Y. Active microorganisms in soil: Critical review of estimation criteria and approaches[J]. Soil Biology and Biochemistry, 2013, 67: 192-211. DOI:10.1016/j.soilbio.2013.08.024
(  0) 0) |
| [31] |
Wang X T, Gossart M, Guinet Y, et al. The consistency of home-field advantage effects with varying climate conditions[J]. Soil Biology and Biochemistry, 2020, 149: No107934. DOI:10.1016/j.soilbio.2020.107934
(  0) 0) |
| [32] |
Zhou X, Liu L L, Zhao J, et al. High carbon resource diversity enhances the certainty of successful plant pathogen and disease control[J]. New Phytologist, 2023, 237: 1333-1346. DOI:10.1111/nph.18582
(  0) 0) |
| [33] |
Sasse J, Martinoia E, Northen T. Feed your friends: Do plant exudates shape the root microbiome?[J]. Trends in Plant Science, 2018, 23: 25-41. DOI:10.1016/j.tplants.2017.09.003
(  0) 0) |
| [34] |
Li X G, Zhang T L, Wang X X, et al. The composition of root exudates from two different resistant peanut cultivars and their effects on the growth of soil-borne pathogen[J]. International Journal of Biological Sciences, 2013, 9: 64-173.
(  0) 0) |
| [35] |
Zhang Z Q, Xu Y, Song G M, et al. Phytophthora sojae zoospores differ in chemotaxis to the root and root exudates of host soybean and nonhost common bean[J]. Journal of General Plant Pathogen, 2019, 85: 201-210. DOI:10.1007/s10327-019-00839-9
(  0) 0) |
| [36] |
Nyawade S O, Gachene C K K, Karanja N N, et al. Controlling soil erosion in smallholder potato farming systems using legume intercrops[J]. Geoderma Regional, 2019, 17: Noe00225. DOI:10.1016/j.geodrs.2019.e00225
(  0) 0) |
| [37] |
Umesh M R, Chittapur B M, Jagadeesha N. Solar radiation utilization efficiency in cereal-legume intercropping systems: A review[J]. Agricultural Reviews, 2017, 38: 72-75.
(  0) 0) |
| [38] |
Eisenhauer N. Plant diversity effects on soil microorganisms: Spatial and temporal heterogeneity of plant inputs increase soil biodiversity[J]. Pedobiologia, 2016, 59: 175-177. DOI:10.1016/j.pedobi.2016.04.004
(  0) 0) |
| [39] |
Yang J M, Ren X Y, Liu M Y, et al. Suppressing soil-borne Fusarium pathogens of bananas by planting different cultivars of pineapples, with comparisons of the resulting bacterial and fungal communities[J]. Applied Soil Ecology, 2022, 169: No104211. DOI:10.1016/j.apsoil.2021.104211
(  0) 0) |
| [40] |
Motisi N, Montfort F, Faloya V, et al. Growing Brassica juncea as a cover crop, then incorporating its residues provide complementary control of Rhizoctonia root rot of sugar beet[J]. Field Crops Research, 2009, 113: 238-245. DOI:10.1016/j.fcr.2009.05.011
(  0) 0) |
| [41] |
Gilardi G, Gullino M L, Garibaldi A. Critical aspects of grafting as a possible strategy to manage soil-borne pathogens[J]. Scientia Horticuturae, 2013, 149: 19-21. DOI:10.1016/j.scienta.2012.07.014
(  0) 0) |
| [42] |
Ling N, Zhang W, Wang D, et al. Root exudates from grafted-root watermelon showed a certain contribution in inhibiting Fusarium oxysporum f. sp. niveum[J]. PLoS ONE, 2013, 8: Noe63383. DOI:10.1371/journal.pone.0063383
(  0) 0) |
| [43] |
Baetz U, Martinoia E. Root exudates: The hidden part of plant defense[J]. Trends in Plant Science, 2014, 19: 90-98. DOI:10.1016/j.tplants.2013.11.006
(  0) 0) |
| [44] |
Kalinova J, Radova S. Effects of rutin on the growth of Botrytis cinerea, Alternaria alternata and Fusarium solani[J]. Acta Phytopathologica et Entomologica Hungarica, 2009, 44: 39-47. DOI:10.1556/APhyt.44.2009.1.5
(  0) 0) |
| [45] |
Koninger J, Lugato E, Panagos P, et al. Manure management and soil biodiversity: Towards more sustainable food systems in the EU[J]. Agricultural Systems, 2021, 194: No103251. DOI:10.1016/j.agsy.2021.103251
(  0) 0) |
| [46] |
Bonanomi G, Antignani V, Capodilupo M, et al. Identifying the characteristics of organic soil amendments that suppress soilborne plant diseases[J]. Soil Biology and Biochemistry, 2010, 42: 136-144. DOI:10.1016/j.soilbio.2009.10.012
(  0) 0) |
| [47] |
Raaijmakers J M, Mazzola M. Soil immune responses[J]. Science, 2016, 352: 1392-1393. DOI:10.1126/science.aaf3252
(  0) 0) |
| [48] |
Chai Y N, Schachtman D P. Root exudates impact plant performance under abiotic stress[J]. Trends in Plant Science, 2022, 27: 80-91. DOI:10.1016/j.tplants.2021.08.003
(  0) 0) |
 2023, Vol. 60
2023, Vol. 60

