2. 中国科学院土壤环境与污染修复重点实验室(南京土壤研究所), 南京 210008
2. Key Laboratory of Soil Environment and Pollution Remediation, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China
全球气候变化已成为各国政府和民众日益关注的热点问题,其对作物生长的影响也成为人们关注的主题。作物遭受由气候变化导致环境恶化引起的非生物胁迫(如干旱、盐渍、极端温度和重金属等)和由集约化种植以及连作导致的生物胁迫(如昆虫、病原菌和病毒等)被认为是影响农业可持续性的重要因素[1]。根据联合国粮食及农业组织的数据,目前世界人口约为76亿,正以指数速度增长,预计2050年将达到98亿,2100年将达到112亿,新增大约1/2的人口需要养活[2]。因此,大幅提高农业产量并确保粮食安全成为人们的生存保障[3]。除了不断增加的人口,我国农业生产过程中耕地大面积盐渍化、荒漠化和淡水资源短缺等问题日益加剧,使作物生产面临的挑战更加严峻,已严重制约我国农业的可持续发展[4]。此外,农业生产中化肥、农药的高消费率和低利用率导致土壤有益微生物多样性降低,进而影响作物的产量和品质,甚至引发环境退化问题,故引发了大家对农业可持续发展的探索和研究[5]。鉴于人们的环保意识日渐提高和对绿色农业的重视,有益微生物特别是植物促生菌(plant growth-promoting bacteria,PGPB)的应用被认为是提高农业生产率和改善土壤及环境健康的有效措施[1]。迄今为止,PGPB已广泛应用于农业,然而对于其在各种环境胁迫下对植物的抗逆和促生机制仍缺乏全面系统的研究。基于此,有必要对PGPB与植物的互作机制及其在现代可持续农业中的发展应用进行全面的了解。
本文论述了PGPB在植物生存环境中面临胁迫时的促生作用机制,及其在农业应用中的菌剂制备和施用方式的最新研究进展,并对PGPB在未来农业生产中的研究与应用进行了展望,以期有助于更好完成“第二次绿色革命”,保障可持续农业的良好发展并进一步提高作物产量和品质,为之后PGPB与植物之间的互作研究提供有力的理论。
1 植物促生菌的定义及其种类植物促生菌是指自由生活在根际土壤或植物内部的一类促进植物生长的有益细菌[6]。PGPB主要存在于根际土壤中、植物组织(内生层)和叶/茎的空气表面(叶状层)。根据其生活方式可分为根际自由生长的细菌、定居在根表面的细菌以及在植物组织内的细菌[7]。其中,根际是植物根系周围土壤的狭窄区域,也是土壤中微生物最活跃的区域之一,被广泛的微生物类群占据,包括原核生物[古细菌(archaea)和细菌(bacterium)]和真核生物[(真菌(fungus)、卵菌(oomycetes)、线虫(nematode)、原生动物(protozoan)、藻类(algae)和节肢动物(arthropod)]。植物根际促生菌(plant growth promoting rhizobacteria,PGPR)主要包括伯克霍氏菌属(Burkholderia)、弗兰克氏菌属(Frankia)、固氮菌属(Azotobacter)、芽孢杆菌属(Bacillus)、黄单胞菌属(Xanthomonas)、节杆菌属(Arthrobacter)、不动杆菌属(Acinetobacter)、无色菌属(Achromobacter)、产碱杆菌属(Alcaligenes)、假单胞菌属(Pseudomonas)和嗜冷杆菌属(Psychrobacter)等。相比于根际促生菌,植物内生促生菌(plant growth promoting endophytic bacteria,PGPE)由于定殖在植物组织内部,生存环境更加稳定,在外界生物或非生物胁迫下表现出更明显的促生作用[8]。内生促生菌主要包括根瘤菌属(Rhizobium)、伯克氏菌属(Burkholderia)、链霉菌属(Strephtomyces)、肠杆菌属(Enterobacter)、假单胞菌属和芽孢杆菌属等[9]。
2 植物促生菌的功能与作用机制PGPB能够通过各种机制直接或间接地提高作物产量、品质以及土壤肥力[10]。其中,直接作用机制包括产生植物激素以调节植物生长、改善植物营养供应(固定大气中的氮元素、溶解土壤中难溶性磷和分解含钾矿物等);间接作用机制是指生物控制,如诱导植物系统抗性,通过合成抗生素和几丁质酶对抗植物病原体,竞争根际的生态位或土壤中的有效铁。图 1描述了PGPB的作用机制、功能及其在农业中的应用。
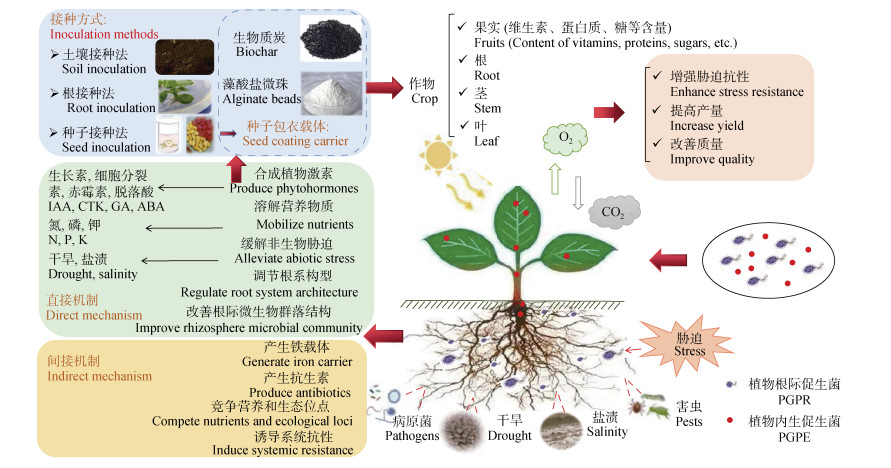
|
图 1 植物促生菌(PGPB)的功能及其在农业上的应用 Fig. 1 Functions of plant growth-promoting bacteria (PGPB) and their applications in agriculture |
PGPB通过合成生长素(indole-3-acetic acid,IAA)、细胞分裂素(cytokinin,CTK)、赤霉素(gibberellin,GA)、乙烯(ethylene,ETH)和脱落酸(abscisic acid,ABA)等植物激素来影响细胞分裂、伸长、分化和植物发芽、生根、开花、结实等生理过程。它们除各自的独特作用外,还能互相促进或抑制,调节不同时期植物的生长发育并缓解生长过程中的各种胁迫[11]。
2.1.1 合成并分泌生长素IAA作为一种在植物体内发挥重要调节作用的植物激素,除了植物自身能够合成外,微生物(如细菌和真菌)也能够合成。由多种PGPB(如假单胞菌、根瘤菌、固氮螺菌和芽孢杆菌等)外源合成的IAA在适宜的浓度下同样能够促进植物生长[12]。当PGPB定殖到种皮或植物根系时,合成的IAA将会被植物吸收形成内源生长素,然后通过参与植物生理生化的调节机制(如细胞的伸长、形成层细胞的分裂和维管组织的分化等)来促进植物生长。其中,PGPB利用根系分泌物中的色氨酸和其他小分子,将其转换为IAA而被植物利用,并激活植物内源生长素信号通路,促进植物细胞生长和增殖[13]。
2.1.2 合成细胞分裂素CTK作为一类独特的植物生长调节剂,从胚胎形成至死亡的整个生命过程中对植物均有潜在的影响[13]。由PGPB合成的CTK能够参与植物复杂功能的协调,进行包括植株的腋芽分支、顶端优势的释放、根分生细胞模式和侧根的产生等诸多生理过程的调节[14]。它促进细胞分裂的同时,还能使细胞体积扩大。与IAA不同的是,CTK是通过细胞横向扩大增粗,而不是促进细胞纵向伸长来增大细胞体积[15]。
2.1.3 赤霉素PGPB还能通过合成GA促进植物细胞分裂和伸长,进而调控植物株高和器官大小。此外,还通过抑制植株成熟、侧芽休眠、衰老、块茎形成等调节植物生长发育[16]。除环境因素外,GA是植物开花的最重要的效应物,也是人工控制植物开花的有效调节剂。Joo等[17]发现根际细菌蜡样芽胞杆菌(Bacillus cereus)MJ-1通过干扰植物根部及茎部组织的内源性GA促进红辣椒的生长。
2.1.4 合成1-氨基环丙烷-1-羧酸脱氨酶降解乙烯在正常生长条件下植物体内的ETH含量是较低的,用于促进花的老化及果实的成熟,但面对各种胁迫(如极端温度、干旱、洪水和高盐等)时,体内会合成“应激ETH”,对植物产生一定的危害。在高等植物的乙烯分解代谢过程中,产1-氨基环丙烷-1-羧酸(1-aminocyclopropane-1-carboxylate,ACC)脱氨酶的PGPB可通过降低应激ETH和ACC水平来促进发芽、抑制根伸长、刺激花和叶的衰老,并增加植物对各种生物和非生物胁迫的耐受性,这也是测定PGPB促生能力的重要指标之一[18]。含有ACC脱氨酶活性的PGPB可将ACC分解生成α-酮丁酸盐和氨,减少抑制植物生长的应激ETH的产生。Kang等[11]筛选到一株产生ACC脱氨酶的非脱羧勒克氏菌(Leclercia adecarboxylata) MO1显著促进了番茄(Lycopersicon esculentum)植株生长,并提高了其产量和耐盐性。
2.1.5 合成脱落酸在胁迫条件下利用PGPB能够产ABA的能力而介导气孔关闭和离子交换活性,能够更好地帮助植物控制水分散失,降低蒸腾速率[19]。ABA有助于保护植物免受极端温度、干旱和盐胁迫的影响,并参与植物的发育过程保持正常的生产力[20]。Shahzad等[19]发现解淀粉芽孢杆菌(Bacillus amyloliquefaciens)RWL-1通过合成ABA来增加水稻(Oryza sativa)对盐胁迫的抗性。有研究[21]表明,外源ABA还可使高温胁迫下菠菜(Spinacia oleracea)气孔导度增加,并进一步影响净光合速率。
2.2 固氮和活化营养物质在全球气候变化背景下,对植物适应性、产量和环境胁迫耐受性进行调控,正成为提高作物产量的关键。而PGPB可通过生物固氮过程固定大气中的N2,还能通过分泌有机酸和功能酶溶解土壤中难溶的矿物营养元素(如磷酸盐等),并充当生物肥料的角色[22]。
2.2.1 固定氮元素植物在生长过程中通过根系获取土壤中的氮素,缺氮则直接影响其生长发育[23]。大气中氮元素含量虽高,但均以N2分子态的惰性形式存在,不能被植物吸收利用。在自然界中,存在着一类固氮微生物,它们能够通过固氮酶的复杂酶系统在适宜的温度下将大气中游离的氮转化为植物可利用的氨[24]。根瘤菌作为最常见的固氮微生物,其与豆科植物的共生固氮为宿主甚至其他植物提供生长发育所需的氮源[25]。除根瘤菌外,还有很多菌属,如荧光假单胞菌(Pseudomonas fluorescens)能够通过固氮作用,促进小麦[26](Triticum aestivum)、番茄[27]等作物的生长。研究表明,接种了嗜根链霉菌(Streptomyces rhizophilus)、球形芽孢杆菌(Bacillus sphaericus)和解淀粉芽孢杆菌的油菜可通过氨化作用促进有机氮向无机氮的转化,以提高油菜(Brassica napus)的总氮含量[28]。
2.2.2 溶解磷元素尽管土壤中丰富的磷以有机和无机的形式存在,但由于其与土壤中的金属离子络合而大多不能被植物吸收利用,故多年来对磷肥的需求和使用一直在增加,以维持植物中磷的持续供应[29]。在土壤中存在着一类溶磷细菌(phosphate- solubilizing bacteria,PSB),具有将不溶性磷转化为植物可利用形式磷(H2PO4–和HPO42–)的潜力。PSB在农业中的使用可显著提高作物的磷吸收和利用效率,它们能够通过分泌有机酸(如柠檬酸、草酸和琥珀酸等)、酶(如磷酸酶和肌醇六磷酸酶等)和离子螯合剂(如铁载体)等途径使植物获得可利用的磷元素[30]。
2.2.3 溶解钾元素土壤中的钾仅有极少量可被植物直接利用,大部分的钾元素被固定在长石和云母等硅酸盐矿物中而无法被植物吸收[31]。研究发现,在PGPB中存在具有解钾能力的钾溶菌(potassium- solubilizing bacteria,KSB)可通过酸解、螯合、交换和络合反应以及有机物的分解等途径从硅酸盐矿物中释放钾,促进植物对钾的吸收和利用。例如,胶质芽孢杆菌和巨大芽孢杆菌能够促进蔬菜作物对钾元素的吸收,在提高产量和品质的同时,缓解了盐渍化的压力[32]。此外,KSB因其能够提高土壤中可利用钾的含量以及具备产生铁载体、植物激素和抑制病原菌的特性,赋予作物具备抵抗胁迫环境的能力[33]。Rashid等[34]发现巨大芽孢杆菌能够通过溶解钾元素和磷元素,产生胞外多糖、植物激素,提高了番茄的生物量及其在干旱胁迫下的耐受性。
2.3 缓解非生物胁迫作物的产量由于生物和非生物胁迫造成的损失可高达50%~80%[1]。非生物胁迫是限制全球范围内农业生产的主要因素,PGPB已被证明能够提高小麦、玉米、水稻、黄瓜和番茄等作物对非生物胁迫的耐受性[35]。前期研究发现干旱和高盐作为降低全球主要作物生产力的两个最重要的非生物胁迫因素,对植物的生长发育以及PGPB的活性和定殖能力均能产生影响[11]。
2.3.1 缓解干旱胁迫干旱胁迫是造成作物减产的重要因素之一,它制约了农作物的生长、发育和生产力,是一个遍及全球的农业问题。干旱胁迫对植物的生长参数和应激反应基因均有广泛的影响,有限的水分条件引起植物的形态结构、生理功能和分子特征的变化(如植株高度降低、乙烯产量增加、脂质过氧化、光合器官损伤、光合作用抑制和细胞死亡),以及由于自由基积累引起的叶绿素含量、膜功能和蛋白质构象的变化[36]。为了实现农业可持续发展,PGPB已被广泛地用于提高农作物对生物和非生物胁迫的耐受性[11]。Ansari等[36]基于对水分胁迫的耐受性、促生性能和体外生物膜形成能力,筛选出一株偶氮假单胞菌(Pseudomonas zaotoformans)FAP5,在干旱胁迫下接种该菌株的小麦植株的生长特性(吲哚乙酸、磷酸盐增溶和铁载体的产生)和光合色素效率等生理特性均有显著改善。可见,该菌株可通过多种促生机制缓解干旱胁迫对小麦植株生长的抑制作用。
2.3.2 缓解盐胁迫盐是水和土壤中的天然成分,植物组织中过量的盐是有害的,在盐胁迫下植物的种子萌芽、结瘤过程、农业生产力、水分和养分吸收、作物产量、生态和物理化学平衡以及固氮等作用机制均会受到较大影响,而渗透耐受性、组织耐受性和叶片对钠的排斥是植物在盐胁迫下生存的主要机制[37]。Szymańska等[38]研究发现假单胞菌ISE12能够通过激活宿主植物的抗氧化防御系统(显著降低了根、茎、叶中的脯氨酸含量和谷胱甘肽含量以及脂质过氧化水平)以及触发细胞壁的重新排列来减轻甘蓝型油菜的盐胁迫损伤。
2.4 防止或消除生物胁迫目前,农业生产中预防病虫害主要基于农用化学品(农药和化肥)的使用。然而,农用化学品的过度使用导致了对环境和人类有害的残留物在土壤中的积累[39]。研究发现,土壤中广泛分布着对抗病原菌的生防细菌,这些PGPB能够通过产生铁载体、抗生素代谢物,竞争营养和空间位点,以及诱导植物的系统抗性等机制来保护植物免受真菌、细菌和病毒以及昆虫和线虫等害虫的侵害,可替代农业生产中农药的使用,并作为防治土传病害、保护植物健康的有效手段之一。
2.4.1 产生铁载体在农业生产中PGPB可产生铁载体,通过在根际螯合铁减少依赖土壤中有效铁的病原菌对铁的利用,促进作物对铁元素的吸收利用并保护植物免受病原菌的侵害[40]。根际微生物和根系分泌物均能直接或间接地影响和参与土壤中根际铁的活化。例如,大量的低分子初级(糖、氨基酸和有机酸)和次级(酚类、黄酮类和萜类)代谢物及一些无机分子(CO2和H2O)被释放至植物根际直接参与铁的溶解、还原和络合过程,同时也为PGPB合成铁载体提供重要的底物来源[41]。PGPB通过呼吸、硝化和根际磷酸盐溶解作用释放的质子和有机酸均能溶解含铁矿物质。Freitas等[42]研究发现枯草芽孢杆菌GB03能够促进木薯(Manihot esculenta)积累铁元素,亦或通过植物根际酸化将Fe3+还原为Fe2+,帮助拟南芥(Arabidopsis thaliana)吸收铁元素。
2.4.2 合成抗生素由微生物衍生的天然产物一直是抗生素及其先导物的传统来源,目前,由PGPB产生的抗生素在生物农药中仍占据着主要的地位[43]。PGPB产生的表面活性素和2,3-丁二醇具有抗真菌作用,促进植物生长并诱导植物产生对病原菌的抵抗力。Wu等[44]研究发现,由解淀粉芽孢杆菌产生的挥发性有机化合物中2-壬酮、2-庚酮和2,3-丁二酮具有很强的抗真菌特性,促进拟南芥的生长并诱导系统抗性。此外,由枯草芽孢杆菌产生的三种脂肽(风菌素、表面活性素和霉菌枯草菌素)因其破坏菌丝细胞壁结构及抑制孢子形成和萌发的能力可保护植物免受镰刀菌病侵害,有用作生物防治产品的潜力[45]。
2.4.3 竞争营养和生态位点竞争作用是PGPB发挥生防作用的重要机制之一,主要包括营养竞争和位点竞争。当两种或多种微生物争相获取一种或多种有限资源(如光、水、养分和空间等)时,就会发生竞争。正如在使用PGPB对植物病原体进行生物防治时,PGPB作为较强的竞争者,通常能够抢先占据营养较丰富的有利空间(如植物的根和种子),使抑制植物生长的病原菌难以获得使其存活的营养物质[46]。此外,近年来PGPB被尝试用不同的接种方法和措施使之能够高效定殖,便拥有了能够占据更多有利位点的优势,而病原菌便少了对植物进行侵染和破坏的位点和可能性[47]。
2.4.4 诱导系统抗性PGPB与根系的互作可诱导植物产生对致病细菌、真菌和病毒的抗性,这种现象被称为诱导系统抗性(induced systemic resistance,ISR)。ISR涉及的一些信号分子(如乙烯和茉莉酸等)同样会激发宿主植物对多种植物病原菌的防御反应[48]。PGPB能够通过介导ISR以提高植株自身产生抗病能力。例如,PGPB可诱导青枯假单胞菌(Pseudomonas solanacearum)[49]、辣椒疫霉(Phytophthora capsici)[50]和灰葡萄孢(Botrytis cinerea)[51]等植物病原体的抗病性。Tahir等[48]发现芽孢杆菌SYST2分泌的挥发性有机化合物(volatile organic compound,VOC)(沙丁胺醇和1,3-丙二醇)通过诱导抗病基因的过量表达激活烟草(Nicotiana tabacum)幼苗的ISR,防治青枯劳尔氏菌(Ralstonia solanacearum)引起的枯萎病。
2.5 调控根系构型PGPB主要通过活化根际养分和促进根系发育提高植物对养分的利用效率。根系是植物吸收水分及养分的主要门户,而调控根系构型(root system architecture,RSA)是提高根际养分吸收利用效率的重要途径。大多数PGPB能够分泌丰富的代谢物,通过调控植物根系发育信号途径影响和调控RSA,促进植物主根的伸长及侧根和根毛的发育[52]。如伯克氏菌(Burkholderia cepacia)PSJN能增加拟南芥主根长度、增加根毛数量以及根生物量[53]。其中,PGPB合成的IAA,是一种天然生长素、生长素前体或生长素信号模拟物,而生长素信号传导是植物根发育过程中的关键激素,可调节根生长、侧根的出现和根毛的形成。Raya-Gonzalez等[54]发现枯草芽孢杆菌、苜蓿中华根瘤菌和荧光假单胞菌产生的VOC中均有N,N-二甲基十六胺的存在,其影响细胞的分裂和伸长,同时促进拟南芥幼苗的侧根形成及根毛的生长和密度。
2.6 调节根际微生物群落结构鉴于根际细菌独特的生态位与植物健康的密切关系,探索PGPB的接种对根际微生物群落结构的影响具有非常重要的意义。PGPB接种可通过调节优势菌的相对丰度来协调根际微生物群落的生态功能,不同处理间微生物分布的差异在一定程度上反映了菌剂对根际细菌种群的影响[55]。此外,通过PGPB的接种刺激粮食产量的增加可能与根际细菌的丰度和物种丰富度的增加有关。前期研究报道了接种PGPB可调节宿主根际细菌群落组成,不同的接种剂对根际细菌群落具有不同的作用,间接地影响植物生长,例如,Wang等[56]用剑菌(Ensifer sphaericus)NYM3、不动杆菌(Acinetobacter sphaericus)P16和黄杆菌(Flavobacterium sphaericus)KYM3以不同比例构建的微生物复合菌剂接种黄瓜(Cucumis sativus),发现上述菌株显著影响了土著细菌群落;其中,三者以2:1:2的比例构建的复合接种剂的酸碱度、总氮和转化酶活性最高,从而通过调节固氮的细菌群落结构和功能来提高黄瓜产量;而以1:10:1的比例构建的有效磷、硝态氮、尿素活性和碱性磷酸酶活性最高,通过调节尿素氮水解的细菌群落结构来提高黄瓜产量。此外,有效调控根际微生物群落还有助于植物病害的控制。Liu等[57]发现,解淀粉芽孢杆菌SQR9和含有氨基酸的有机肥(鸡粪)通过改变根际细菌群落组成来抑制番茄病害。
3 植物促生菌的筛选与施用为了以绿色和环境可持续的方式提高农业生产,需要减少农用化学品的使用,并提高植物对各种胁迫因素的耐受性。运用PGPB被认为是在可持续和生态友好的农业系统中提高作物生产力、食品质量和安全性的优势技术[5]。而将PGPB加工制成的活菌制剂在农业生产中的恰当使用可达到减少化学药剂的用量、降低生产成本、提高农产品质量、改良土壤条件和保护生态环境等效果,也符合人与自然和谐共生的农业生产目标。目前国内外关于以PGPB制成的菌剂对植物促生作用的研究甚广[58-60]。其中,可利用两种及以上且互不拮抗的有益微生物菌种经工业化扩繁后加工制成活菌制剂,相对于施用单一微生物菌剂而言,其施用能更好地达到减少化学药剂施用量、改良土壤微生态环境和促进植物生长的效果[61]。例如,Molina-Romero等[62]研究发现,由四种可共存且不会与植物产生拮抗作用的菌株组成的细菌聚生体接种玉米后,与未接种的对照或单次接种相比,接种细菌聚生体增加了枝条和根干物质量、株高和株径。
3.1 PGPB菌剂制备菌种的筛选、载体的选择以及保质期的确定是PGPB菌剂研发过程中的关键因素[59]。菌剂能否成功运用取决于其稳定性、功效、经济可行性和易用性之间的平衡,以及在农业生产中的实际应用效果。
3.1.1 菌种的筛选菌种的选育主要来自于三条途径:(1)直接从特定环境中(被污染的或是其他胁迫环境等)富集、筛选,包括从生长的植物组织中分离筛选出的内生细菌以及从根际土壤中分离筛选出的根际细菌。比如,从高盐土壤中或生长在高盐土壤中的植物根际筛选得到的菌株很可能具有缓解宿主植物盐胁迫的作用[63];(2)通过对现有菌种的驯化,使其产生能对特定化合物进行分解的代谢途径和代谢酶类,继而获得这些物质的降解菌种;(3)通过基因改良技术改造菌种的特性,使其优良性得到提高或者获得新的优良性能,比如通过定点基因突变技术提高降解菌株的底物范围和活性[64]。无论是单菌还是复合菌均可根据以上三条途径进行富集、筛选,但相较于单菌而言,用于筛选复合菌的培养基较为复杂,一般根据单因素及正交实验或响应曲面法来优化培养基,从而确定最适宜发酵的培养基和培养条件[63]。培养基的成分如碳源、氮源和无机盐均会对菌体量产生影响,而适宜的培养条件(包括初始pH、温度、接种量、发酵时间和溶氧量等)能够提高菌株繁殖速率[65]。
3.1.2 载体的选择土壤的异质性可导致接种的细菌无法在其中找到合适的生态位,故成为接种剂成功应用的巨大障碍。接种的细菌必须与适应能力更强的本土微生物群竞争,并在土壤微型动物的捕食中存活下来。因此,一种能够高效生产、配制和应用的载体应保证菌剂发挥所有应当展现的益处,使PGPB在储存和使用过程中保持较高的存活率[59]。近年来,生物质炭(biochar)和藻酸盐微珠(alginate beads)被认为是较为理想的PGPB载体。
通过在有限的氧气供应下热分解生物质获得的生物质炭,由于其吸附性、多孔性和相对高的营养成分含量,成为固定PGPB的有效载体,常用作农业生产和重金属转化中的土壤调理剂[3]。用于生产生物质炭的农业废弃物、森林残留物和肥料等有机物的丰富存在,决定了其可持续性[66]。生物质炭的高孔隙率和大表面积为PGPB的生存提供了良好的微环境,保护其免受螨虫、原生动物、线虫和弹尾虫等土壤动物捕食者的侵害[67]。此外,它自身优异的化学性质使其成为一种控释肥料配方的支持材料,有助于PGPB的定殖与生长。与光滑表面相比,生物质炭不规则或粗糙的表面也促进了PGPB细胞的更好固定或粘附[68]。王孝芳等[69]研究以玉米秸秆、木块(松木)和稻壳为原料制成的生物质炭载体的作用,发现3种生物质炭均能有效吸附根系分泌物,促进有益菌的定殖,有效固持、吸附青枯菌,抑制土传青枯病的发生。
藻酸盐微珠使用简单,作为PGPB的载体时可被土壤微生物降解,本质上无毒,含有大量均匀的细菌群体,并能长时间缓慢释放细菌且不会造成生态污染,还可通过适当的工业大规模生产。此外,藻酸盐微珠能够在相对较小的体积中长期储存,且不会对细菌种群产生任何影响[70]。El-Fattah等[71]对比了不同载体(如泥炭、麦麸、稻壳、蛭石、黏土和海藻酸盐)对圆褐固氮菌(Azotobacter chroococcum)的存活和生物活性的影响,发现使用海藻酸盐提高了固氮菌存活的稳定性,且固氮菌在其中的活性高于在其他载体材料中的活性。
3.1.3 保质期的延长充足的保质期是菌剂得以生产和广泛应用的关键因素。菌剂中的微生物在接种种子上的存活时间取决于有利于细胞初始负载条件(如菌龄、湿度状态、纯度、初始密度和接种物分类的同一性等)和支持长期稳定性条件之间的权衡[68]。孕育剂应开发成具有长期储存稳定性的产品,对其保质期的要求从室温下的2~3个月至1~2年不等,最大化接种剂活细胞的初始量是弥补快速劣化率的策略[59]。应该优化储存条件以支持细胞长期存活,通常储存在低温和低水分含量下的包衣种子能够保持较高的微生物生存力和活力。此外,聚合物黏合剂或涂层材料可通过调节水分吸附和解吸来减少相对湿度波动的影响,提高细胞的存活率和延长菌剂的保质期[68]。
3.2 PGPB的接种方式PGPB可直接接种至种子、叶子、幼苗根系或土壤中,它们在根际或植物体内定殖,增强植物对胁迫环境的耐受性,通过提高营养物质的利用率、调节植物激素和间接诱导系统抗性等途径促进植物生长[72]。在土壤中,PGPB生活在根际区域,并与植物形成互利共生关系[11]。高效的微生物作用效率通常取决于接种方法、接种物数量和根定殖能力等;然而根际定殖又随微生物在根际的繁殖和分布、微生物拮抗作用、植物生理状态、土壤理化性质(湿度、pH、温度)、宿主植物和根分泌物的变化而变化[73]。可见,不同的接种方式会影响PGPB的定殖效率,最终影响植物生长及其生物量。PGPB菌剂的施用方式与惯用的施用方式类似,但需保证将种子根部或小苗能与接种剂充分接触,达到接种微生物的目的。依据接种剂的形态,主要可分为液剂和粉剂两种,分为不同的施用方式。
3.2.1 种子外包覆法对于较大型(直径3 mm以上)的种子,由PGPB制成的微生物制剂可通过包覆在种子外表面引入土壤,使功能微生物在面对土壤中的土著微生物群落及胁迫环境时更好地生存下来发挥促生作用,提高种子质量(生存力和活力)和作物产量[66]。若是液剂,则可借助载体对种子进行包衣处理,使菌剂更均匀地包覆在种子上;若是粉剂,则可选择用清水或者黏着剂使种子上外覆上一层粉剂即可。Hernández-Montiel等[73]研究发现,用微胶囊接种为微生物提供了良好的保护,由于PGPB接种物的释放是渐进的,改善了PGPB的黏附性、稳定性及其在根部的定殖和生存能力。生物质炭的高表面积和离子交换性使其极为适合改善土壤肥力状况。Zafar-Ul-Hye等[74]将复合菌剂(粪产碱杆菌和解淀粉芽孢杆菌)和菠菜种子与灭菌的黏土、泥炭和糖溶液以及生物质炭混合后播种,显著提高了菠菜的生长能力,并显著降低了根部的铅浓度,扮演着土壤改良剂的角色。
3.2.2 土壤(或栽培基质)直接施用法对于较小(直径在3 mm以下)的作物种子或者是苗期的作物可采用拌种、浸种、灌根或窝(穴)施等施用方法。在种子即将播种前,可将种子放入液体菌剂中进行浸种或拌种,使功能微生物进入种子内或固着在种子表面。抑或在种子播种出苗后,均可用液体菌剂进行灌根,或在根部用粉剂进行窝(穴)施。其中,浸种是将种子浸泡在已知浓度的功能微生物溶液中,利用种子萌发过程中的分泌物作为营养来源,并在根形成时定殖下来[72]。Misra等[75]在盐胁迫下用华癸酵海鲜球菌剂处理玉米、番茄和秋葵种子能够显著增加产量并改善盐胁迫。然而,Ullah等[76]研究发现,与种子接种相比,根瘤菌在水稻根部的接种在增加株高和穗长方面更有效。此外,Bhattacharya等[77]研究了芽孢杆菌PBE1菌剂与化学杀菌剂“百菌清”对番茄枯萎病的作用,在番茄感染了尖孢镰刀菌后,通过灌根的方法将菌剂施用于幼苗,结果发现,与化学杀菌剂相比,芽孢杆菌PBE1的生物保护干预可作为一种生态友好的、更有效的番茄枯萎病防治方法。可见,施用方式也要因作物而异。
3.2.3 叶面喷施法该方法主要将液体微生物菌剂在稀释一定倍数后喷洒至植株的叶片上,而粉剂需要用水或特定的溶液进行配制后再喷施至叶片上,在选择叶面喷施时主要在植株生长后期,根系吸收能力减弱时,是追施的一种形式,具有用量少、效率高及利用率高的优点。Guo等[78]用100倍稀释的解淀粉芽孢杆菌Ba13悬浮液喷施在番茄植株的第一片真叶,在接种3周后进行番茄黄化曲叶病毒感染,结果表明,Ba13菌剂通过激活番茄中与系统抗性相关的基因表达和酶活性来提高番茄对黄化曲叶病的防御能力;在Ba13处理的番茄植株中,感染率和症状、疾病水平和叶病毒量显著降低,同时还促进番茄根系发育和地上部生长,提高叶片绿度,并减少了根际中病原真菌的数量。
3.2.4 土壤灌施法在作物育苗或生长过程中需要补充水分时,对于液体微生物菌剂,可稀释一定倍数,随灌溉水一起灌入土壤中。固态菌剂可直接掺入土壤中,也可先加水或特定的溶液,再稀释灌入土壤中,从而使微生物菌剂均匀混入土壤中供作物吸收利用,作为基肥或者追肥使用。Sang等[79]将发芽的辣椒种子播种于每克灌施盆栽土含有108个细菌细胞的育苗盘中,以10 mmol·L–1硫酸镁缓冲液用作未处理的对照,发现菌株皱褶假单胞菌CCR04、CCR80和吲哚黄杆菌ISE14均能充分保护辣椒植株在整个发育过程中免受辣椒疫病的侵害。可见,上述菌剂可通过土壤灌施处理作为农用化学品的替代品以控制辣椒疫霉病。
3.3 PGPB的应用针对全球滥用和过度使用农用化学品(农药和化肥等)的问题,微生物接种剂在农业应用中获得了特别的重视。微生物农药和肥料在有机和传统农业实践中发挥着重要作用。
3.3.1 作为微生物菌剂的应用由PGPB制成的微生物菌剂是指目标菌株经过工业化生产扩繁后加工制成的活菌制剂。在植物生长过程中,不同的PGPB接种剂及复合菌剂会增加细菌群落的丰富度和多样性,从而影响根际细菌种群的相互作用[60]。比如,球形芽孢杆菌和解淀粉芽孢杆菌通过增加假单胞菌和黄杆菌科的相对丰度,在更大程度上帮助植物选择性富集营养有益菌;嗜根芽孢杆菌则通过吸引蓝细菌和放线菌的重氮营养成员,刺激氨化作用。可见,三种PGPB菌剂均通过影响根际细菌群落的组成来促进植物生长[30]。Chaudhary等[80]探索了内生细菌绿豆根瘤菌MB-17a的促生潜力,在经过基因组测序等检测后发现该PGPE能够合成铁载体、吲哚乙酸、氨和ACC脱氨酶,并能溶解磷酸盐;绿豆在接种后,植株的干鲜物质量、根瘤数量和根瘤鲜物质量均显著增加;此外,MB-17a的功能基因组注释确定了不同蛋白质和转运蛋白的存在,该蛋白质和转运蛋白决定其胁迫耐受性和植物促生性能。
3.3.2 作为微生物农药的应用由PGPB制成的生物防控剂可用于保护农产品免受昆虫、病原体和杂草的侵害[81]。Báez-Vallejo等[82]从玉米根际筛选出的芽孢杆菌和假单胞菌显著降低番茄早疫病菌的生长,其中芽孢杆菌通过产生可挥发性化合物(如2-壬酮、2-十一烷酮和二甲基二硫化物等)对番茄早疫病的直接抑制率可达63%,从而降低发病率。青枯病菌引起的青枯病是番茄生产的严重威胁,Farahat等[83]从青枯病侵染的健康番茄植株中分离筛选出具有最高拮抗性能的荧光假单胞菌HRA32和枯草芽孢杆菌HRA69,均表现出氨、吲哚乙酸和铁载体合成以及磷酸盐溶解的能力,可将疾病发生率从对照处理中的87.22%降低至16.66%,生物防治效果达到80.23%。此外,Mohammed等[84]从番茄植株的根际分离和鉴定出了假单胞菌属,均可抑制青枯菌的生长,并通过产生脂肪酶、蛋白酶和α-淀粉酶促进番茄生长。可见,PGPB的应用是一种很有前景的番茄青枯病生物防治方法。
3.3.3 作为微生物肥料的应用诸多温室和田间试验表明,不同的作物均对微生物接种反应良好。特别是根瘤菌剂经常被应用于豆科植物,可提供高达90%的豆科植物的氮需求。据报道,多功能生物肥料的开发减少了大约1/3至1/2的化肥施用量[85]。Takeshi等[86]发现蜡状芽孢杆菌KI-2在花诱导期间的应用增加了草莓的总产量和果实中的蔗糖含量,表明PGPB在保持果实品质的同时具有提高产量参数的潜力。磷是蔬菜生长的主要养分,特别是马铃薯的生长需要很高的土壤磷含量才能保证高生物量,磷酸盐溶解细菌通常能够促进马铃薯块茎的生长并提高其生物量。此外,解钾细菌可通过增加根际钾的生物可利用性来提高马铃薯的产量[87]。目前,虽然现代有机农业也可通过改善根部的养分供应来提高农作物的产量,但Altuntas[88]研究发现,与对照和化学肥料处理相比,PGPB生物肥料的应用使西蓝花的产量分别提高了50%和20%。
4 结论与展望本文系统阐述了PGPB促进作物生长的作用机制,探究了PGPB菌剂的制备和施用方式,综述了PGPB在现代农业中的应用研究,为之后研究土壤-植物-微生物在根际圈的相互作用提供了重要基础。此外,PGPB在农业中的应用能够创造良好的植物根际生态环境,改善土壤理化性质和土壤的供肥能力,降低作物对化学品的过分依赖并抑制病虫害的发生,以实现农业的可持续发展。基于对PGPB功能、作用机制与应用现状的梳理,认为今后需加强以下几个方面的研究:
(1) 目前的研究多侧重于PGPB如何诱导植物的形态、生化和生理变化的作用机制,但其分子层面的作用机制尚不清楚,应借助现代分子生物学手段深入研究PGPB与植物及其他功能微生物和外部环境因素之间的互作关系。
(2) 深入探讨通过改性、功能化等方式研发出更多绿色、高效、经济的新型复合固定化载体(如改性载体材料、磁性纳米载体材料、生物缓释载体材料和大孔聚合物载体材料等),协同PGPB使其更高效更稳定地发挥作用。
(3) 需进一步深入探究关于PGPB的微生物组,采用微生物组测序并构建微生物网络,找出重要核心微生物,结合当前信息化网络,通过识别、培养和筛选,最终获得用于促生、抗病等多功能的微生物组,并在农业中广泛应用。
| [1] |
Kumar A, Patel J S, Meena V S, et al. Recent advances of PGPR based approaches for stress tolerance in plants for sustainable agriculture[J]. Biocatalysis and Agricultural Biotechnology, 2019, 20: 101271. DOI:10.1016/j.bcab.2019.101271
(  0) 0) |
| [2] |
Ahmad M, Wang X K, Hilger T H, et al. Evaluating biochar-microbe synergies for improved growth, yield of maize, and post-harvest soil characteristics in a semi-arid climate[J]. Agronomy, 2020, 10(7): 1055. DOI:10.3390/agronomy10071055
(  0) 0) |
| [3] |
Glaser B, Lehr V I. Biochar effects on phosphorus availability in agricultural soils: A meta-analysis[J]. Scientific Reports, 2019, 9(1): 9338. DOI:10.1038/s41598-019-45693-z
(  0) 0) |
| [4] |
Lü Y. Analysis of agricultural resources and sustainable development of agriculture (In Chinese)[J]. South China Agriculture, 2020, 14(29): 143-144. [吕悦. 农业资源与农业可持续发展探析[J]. 南方农业, 2020, 14(29): 143-144.]
(  0) 0) |
| [5] |
Kumar S M, Reddy G C, Phogat M, et al. Role of bio- fertilizers towards sustainable agricultural development: A review[J]. Journal of Pharmacognosy and Phytochemistry, 2018, 7(6): 1915-1921.
(  0) 0) |
| [6] |
Hashem A, Tabassum B, Abd_Allah E F. Bacillus subtilis: A plant-growth promoting rhizobacterium that also impacts biotic stress[J]. Saudi Journal of Biological Sciences, 2019, 26(6): 1291-1297. DOI:10.1016/j.sjbs.2019.05.004
(  0) 0) |
| [7] |
Gouda S, Kerry R G, Das G, et al. Revitalization of plant growth promoting rhizobacteria for sustainable development in agriculture[J]. Microbiological Research, 2018, 206: 131-140. DOI:10.1016/j.micres.2017.08.016
(  0) 0) |
| [8] |
Ma Y, Rajkumar M, Zhang C, et al. Beneficial role of bacterial endophytes in heavy metal phytoremediation[J]. Journal of Environmental Management, 2016, 174: 14-25. DOI:10.1016/j.jenvman.2016.02.047
(  0) 0) |
| [9] |
Ma Y, Luo Y M, Teng Y, et al. Effects of endophytic bacteria enhancing phytoremediation of heavy metal contaminated soils (In Chinese)[J]. Acta Pedologica Sinica, 2013, 50(1): 195-202. [马莹, 骆永明, 滕应, 等. 内生细菌强化重金属污染土壤植物修复研究进展[J]. 土壤学报, 2013, 50(1): 195-202.]
(  0) 0) |
| [10] |
Ma Y, Dias M C, Freitas H. Drought and salinity stress responses and microbe-induced tolerance in plants[J]. Frontiers in Plant Science, 2020, 11: 591911. DOI:10.3389/fpls.2020.591911
(  0) 0) |
| [11] |
Kang S M, Shahzad R, Bilal S, et al. Indole-3-acetic-acid and ACC deaminase producing Leclercia adecarboxylata MO1 improves Solanum lycopersicum L. growth and salinity stress tolerance by endogenous secondary metabolites regulation[J]. BMC Microbiology, 2019, 19(1): 80. DOI:10.1186/s12866-019-1450-6
(  0) 0) |
| [12] |
Souza M S T, Baura V A, Santos S A, et al. Azospirillum spp. from native forage grasses in Brazilian Pantanal floodplain: Biodiversity and plant growth promotion potential[J]. World Journal of Microbiology and Biotechnology, 2017, 33(4): 81. DOI:10.1007/s11274-017-2251-4
(  0) 0) |
| [13] |
Kamínek M. Tracking the story of cytokinin research[J]. Journal of Plant Growth Regulation, 2015, 34(4): 723-739. DOI:10.1007/s00344-015-9543-4
(  0) 0) |
| [14] |
Liu Y, Wang H, Sun X L, et al. Study on mechanisms of colonization of nitrogen-fixing PGPB, Klebsiella pneumoniae NG14 on the root surface of rice and the formation of biofilm[J]. Current Microbiology, 2011, 62(4): 1113-1122. DOI:10.1007/s00284-010-9835-7
(  0) 0) |
| [15] |
Aremu A O, Fawole O A, Makunga N P, et al. Applications of cytokinins in horticultural fruit crops: Trends and future prospects[J]. Biomolecules, 2020, 10(9): 1222. DOI:10.3390/biom10091222
(  0) 0) |
| [16] |
Chen S, Wang X J, Tan G F, et al. Gibberellin and the plant growth retardant Paclobutrazol altered fruit shape and ripening in tomato[J]. Protoplasma, 2020, 257(3): 853-861. DOI:10.1007/s00709-019-01471-2
(  0) 0) |
| [17] |
Joo G J, Kim Y M, Kim J T, et al. Gibberellins-producing rhizobacteria increase endogenous gibberellins content and promote growth of red peppers[J]. Journal of Microbiology, 2005, 43(6): 510-515.
(  0) 0) |
| [18] |
Nascimento F X, Rossi M J, Glick B R. Ethylene and 1-aminocyclopropane-1-carboxylate (ACC) in plant–bacterial interactions[J]. Frontiers in Plant Science, 2018, 9: 114. DOI:10.3389/fpls.2018.00114
(  0) 0) |
| [19] |
Shahzad R, Khan A L, Bilal S, et al. Inoculation of abscisic acid-producing endophytic bacteria enhances salinity stress tolerance in Oryza sativa[J]. Environmental and Experimental Botany, 2017, 136: 68-77. DOI:10.1016/j.envexpbot.2017.01.010
(  0) 0) |
| [20] |
Hewage K A H, Yang J F, Wang D, et al. Chemical manipulation of abscisic acid signaling: A new approach to abiotic and biotic stress management in agriculture[J]. Advanced Science, 2020, 7(18): 2001265. DOI:10.1002/advs.202001265
(  0) 0) |
| [21] |
Long C Y, Gu H H, Wang Z X, et al. Effects of exogenous abscisic acid on the photosynthesis and chlorophy ll fluorescence parameters of spinach under high temperature stress (In Chinese)[J]. Journal of Sichuan Agricultural University, 2017, 35(1): 24-30. DOI:10.16036/j.issn.1000-2650.2017.01.004 [隆春艳, 古洪辉, 汪正香, 等. 外源脱落酸对高温胁迫下菠菜光合与叶绿素荧光参数的影响[J]. 四川农业大学学报, 2017, 35(1): 24-30.]
(  0) 0) |
| [22] |
Wang J P, Huang R Z, Zhu L Q, et al. Effects of different fertility improvement measures on microbial community structures in biological red soil crusts of woodland (In Chinese)[J]. Pedologica Sinica, 2023, 60(1). DOI:10.11766/trxb202108130311 [王金平, 黄荣珍, 朱丽琴, 等. 肥力提升措施对林地红壤生物结皮层微生物群落结构的影响[J]. 土壤学报, 2023, 60(1).]
(  0) 0) |
| [23] |
Xiong Y, Zheng L, Shen R F, et al. Effects of nitrogen deficiency on microbial community structure in rhizosphere soil of wheat (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(1): 218-230. [熊艺, 郑璐, 沈仁芳, 等. 缺氮胁迫对小麦根际土壤微生物群落结构特征的影响[J]. 土壤学报, 2022, 59(1): 218-230.]
(  0) 0) |
| [24] |
Ke X B. Key microbial communities and functions of nitrogen transformation in agricultural soils[D]. Beijing: Biotechnology Research Institude, Chinese Academy of Agricultural Sciences, 2016.[柯秀彬. 农业土壤中氮素转化关键微生物群落及功能[D]. 北京: 中国农业科学院生物技术研究所, 2016.]
(  0) 0) |
| [25] |
Dong R, Cao Y R. Research progress on the immune regulation of symbiotic nitrogen fixation between legumes and rhizobia (In Chinese)[J]. Biotechnology Bulletin, 2019, 35(10): 25-33. DOI:10.13560/j.cnki.biotech.bull.1985.2019-0716 [董汝, 曹扬荣. 豆科植物-根瘤菌共生固氮的免疫调控机制[J]. 生物技术通报, 2019, 35(10): 25-33.]
(  0) 0) |
| [26] |
Nawaz A, Shahbaz M, Asadullah, et al. Potential of salt tolerant PGPR in growth and yield augmentation of wheat (Triticum aestivum L.) under saline conditions[J]. Frontiers in Microbiology, 2020, 11: 02019. DOI:10.3389/fmicb.2020.02019
(  0) 0) |
| [27] |
Haque M M, Mosharaf M K, Khatun M, et al. Biofilm producing rhizobacteria with multiple plant growth- promoting traits promote growth of tomato under water-deficit stress[J]. Frontiers in Microbiology, 2020, 11: 542053. DOI:10.3389/fmicb.2020.542053
(  0) 0) |
| [28] |
Liu Y, Gao J, Bai Z H, et al. Unraveling mechanisms and impact of microbial recruitment on oilseed rape (Brassica napus L.) and the rhizosphere mediated by plant growth-promoting rhizobacteria[J]. Microorganisms, 2021, 9(1): 161. DOI:10.3390/microorganisms9010161
(  0) 0) |
| [29] |
Jiang H H, Li J Q, Chen G, et al. Phosphate solubilizing microorganisms and application progress in saline- alkaline soil (In Chinese)[J]. Soils, 2021, 53(6): 1125-1131. DOI:10.13758/j.cnki.tr.2021.06.004 [姜焕焕, 李嘉钦, 陈刚, 等. 解磷微生物及其在盐碱土中的应用研究进展[J]. 土壤, 2021, 53(6): 1125-1131.]
(  0) 0) |
| [30] |
Rawat P, Das S, Shankhdhar D, et al. Phosphate- solubilizing microorganisms: Mechanism and their role in phosphate solubilization and uptake[J]. Journal of Soil Science and Plant Nutrition, 2021, 21(1): 49-68. DOI:10.1007/s42729-020-00342-7
(  0) 0) |
| [31] |
Suo Y K, Liu L H, Zhang L, et al. Research progress of potassium solubilization by potassium solubilizing bacteria (In Chinese)[J]. Contemporary Chemical Industry, 2021, 50(4): 924-929. DOI:10.3969/j.issn.1671-0460.2021.04.039 [索雲凯, 刘丽红, 张雷, 等. 解钾菌解钾作用研究进展[J]. 当代化工, 2021, 50(4): 924-929.]
(  0) 0) |
| [32] |
Geng L P, Fan J, Wang J Y, et al. Study on salt tolerance of functional microbes with ability to dissolve insoluble phosphate and potassium (In Chinese)[J]. Journal of Soil and Water Conservation, 2020, 34(4): 370-375. [耿丽平, 范俊, 王婧瑶, 等. 解磷、钾功能性微生物耐盐效应研究[J]. 水土保持学报, 2020, 34(4): 370-375.]
(  0) 0) |
| [33] |
Lin Y, Si C C, Zhang H X. Research status of potassium-resolving microorganisms and its application and prospects in agricultural production (In Chinese)[J]. Jiangsu Agricultural Sciences, 2020, 48(12): 1-5. [林英, 司春灿, 章慧璇. 解钾微生物研究现状及其在农业生产中的应用和展望[J]. 江苏农业科学, 2020, 48(12): 1-5.]
(  0) 0) |
| [34] |
Rashid U, Yasmin H, Hassan M N, et al. Drought-tolerant Bacillus megaterium isolated from semi-arid conditions induces systemic tolerance of wheat under drought conditions[J]. Plant Cell Reports, 2022, 41(3): 549-569. DOI:10.1007/s00299-020-02640-x
(  0) 0) |
| [35] |
Abd EI-Daim I, Bejai S, Meijer J. Bacillus velezensis 5113 induced metabolic and molecular reprogramming during abiotic stress tolerance in wheat[J]. Scientific Reports, 2019, 9(1): 16282. DOI:10.1038/s41598-019-52567-x
(  0) 0) |
| [36] |
Ansari F A, Jabeen M, Ahmad I. Pseudomonas azotoformans FAP5, a novel biofilm-forming PGPR strain, alleviates drought stress in wheat plant[J]. International Journal of Environmental Science and Technology, 2021, 18(12): 3855-3870. DOI:10.1007/s13762-020-03045-9
(  0) 0) |
| [37] |
Li X Z, Sun P, Zhang Y N, et al. A novel PGPR strain Kocuria rhizophila Y1 enhances salt stress in maize by regulating phytohormone levels, nutrient acquisition, redox potential, ion homeostasis, photosynthetic capacity and stress-responsive genes expression[J]. Environmental and Experimental Botany, 2020, 174: 104023. DOI:10.1016/j.envexpbot.2020.104023
(  0) 0) |
| [38] |
Szymańska S, Dabrowska G B, Tyburski J, et al. Boosting the Brassica napus L. tolerance to salinity by the halotolerant strain Pseudomonas stutzeri ISE12[J]. Environmental and Experimental Botany, 2019, 163: 55-68. DOI:10.1016/j.envexpbot.2019.04.007
(  0) 0) |
| [39] |
Yang T J, Wang Y X, Wang J N, et al. Effects of different bioorganic fertilizers on tomato bacterial wilt and plant growth promotion (In Chinese)[J]. Soils, 2021, 53(5): 961-968. [杨天杰, 王玉鑫, 王佳宁, 等. 不同基质生物有机肥防控番茄土传青枯病及促生效果研究[J]. 土壤, 2021, 53(5): 961-968.]
(  0) 0) |
| [40] |
He X, Zhang Q, Li C, et al. Screening of the pathogenic bacteria with siderophore-producing activity and the effect of intervention in iron uptake on its growth (In Chinese)[J]. Plant Protection, 2020, 46(3): 85-93. [何翔, 张庆, 李楚, 等. 具铁载体活性病原细菌的筛选及铁摄取干预对其生长影响[J]. 植物保护, 2020, 46(3): 85-93.]
(  0) 0) |
| [41] |
Gargallo-Garriga A, Preece C, Sardans J, et al. Root exudate metabolomes change under drought and show limited capacity for recovery[J]. Scientific Reports, 2018, 8(1): 12696.
(  0) 0) |
| [42] |
Freitas M A, Medeiros F H, Carvalho S P, et al. Augmenting iron accumulation in cassava by the beneficial soil bacterium Bacillus subtilis (GBO3)[J]. Frontiers in Plant Science, 2015, 6: 596.
(  0) 0) |
| [43] |
He H Y, Huang S L, Li D L, et al. Screening and identification of strains producing agricultural antibiotics and preliminary study on active products (In Chinese)[J]. Feed Research, 2021, 44(18): 67-72. [何海燕, 黄舒琳, 李东霖, 等. 产农用抗生素的菌种筛选鉴定及活性产物的初步研究[J]. 饲料研究, 2021, 44(18): 67-72.]
(  0) 0) |
| [44] |
Wu Y C, Zhou J Y, Li C G, et al. Antifungal and plant growth promotion activity of volatile organic compounds produced by Bacillus amyloliquefaciens[J]. MicrobiologyOpen, 2019, 8(8): e813.
(  0) 0) |
| [45] |
Mihalache G, Balaes T, Gostin I, et al. Lipopeptides produced by Bacillus subtilis as new biocontrol products against fusariosis in ornamental plants[J]. Environmental Science and Pollution Research, 2018, 25(30): 29784-29793.
(  0) 0) |
| [46] |
Ma Y, Luo Y M, Teng Y, et al. Plant growth promoting rhizobacteria and their role in phytoremediation of heavy metal contaminated soils (In Chinese)[J]. Acta Pedologica Sinica, 2013, 50(5): 1021-1031. [马莹, 骆永明, 滕应, 等. 根际促生菌及其在污染土壤植物修复中的应用[J]. 土壤学报, 2013, 50(5): 1021-1031.]
(  0) 0) |
| [47] |
Liu Y L, Yu Y, Lei H X, et al. Research progress on mechanism of bio-control factors for plant diseases and its application (In Chinese)[J]. China Plant Protection, 2019, 39(3): 23-28. [刘亚苓, 于营, 雷慧霞, 等. 植物病害生防因子的作用机制及应用进展[J]. 中国植保导刊, 2019, 39(3): 23-28.]
(  0) 0) |
| [48] |
Tahir H A S, Gu Q, Wu H J, et al. Effect of volatile compounds produced by Ralstonia solanacearum on plant growth promoting and systemic resistance inducing potential of Bacillus volatiles[J]. BMC Plant Biology, 2017, 17(1): 133.
(  0) 0) |
| [49] |
Cao Y, Pi H L, Chandrangsu P, et al. Antagonism of two plant-growth promoting Bacillus velezensis isolates against Ralstonia solanacearum and Fusarium oxysporum[J]. Scientific Reports, 2018, 8(1): 4360.
(  0) 0) |
| [50] |
Sang M K, Jeong J J, Kim J, et al. Growth promotion and root colonisation in pepper plants by phosphate- solubilising Chryseobacterium sp. strain ISE14 that suppresses Phytophthora blight[J]. Annals of Applied Biology, 2018, 172(2): 208-223.
(  0) 0) |
| [51] |
Jiang C H, Liao M J, Wang H K, et al. Bacillus velezensis, a potential and efficient biocontrol agent in control of pepper gray mold caused by Botrytis cinerea[J]. Biological Control, 2018, 126: 147-157.
(  0) 0) |
| [52] |
Fu Y S, Li Y C, Xu Z H, et al. Research progressing in signals and molecular mechanisms of plant growth- promoting rhizobacteria to regulate plant root development (In Chinese)[J]. Biotechnology Bulletin, 2020, 36(9): 42-48. [付严松, 李宇聪, 徐志辉, 等. 根际促生菌调控植物根系发育的信号与分子机制研究进展[J]. 生物技术通报, 2020, 36(9): 42-48.]
(  0) 0) |
| [53] |
Zúñiga A, Poupin M J, Donoso R, et al. Quorum sensing and indole-3-acetic acid degradation play a role in colonization and plant growth promotion of Arabidopsis thaliana by Burkholderia phytofirmans PsJN[J]. Molecular Plant-Microbe Interactions, 2013, 26(5): 546-553.
(  0) 0) |
| [54] |
Raya-González J, Velázquez-Becerra C, Barrera-Ortiz S, et al. N, N-dimethyl hexadecylamine and related amines regulate root morphogenesis via jasmonic acid signaling in Arabidopsis thaliana[J]. Protoplasma, 2017, 254(3): 1399-1410.
(  0) 0) |
| [55] |
Liu C, Huang W M, Han L Z. Effect of PGPR compound flora on peanut seedling growth and rhizosphere soil microorganism (In Chinese)[J]. Southwest China Journal of Agricultural Sciences, 2019, 32(10): 2367-2372. [刘畅, 黄文茂, 韩丽珍. PGPR复合菌系对花生生长及根际土壤微生物的影响[J]. 西南农业学报, 2019, 32(10): 2367-2372.]
(  0) 0) |
| [56] |
Wang J J, Li Q Q, Xu S, et al. Traits-based integration of multi-species inoculants facilitates shifts of indigenous soil bacterial community[J]. Frontiers in Microbiology, 2018, 9: 1692.
(  0) 0) |
| [57] |
Liu H J, Xiong W, Zhang R F, et al. Continuous application of different organic additives can suppress tomato disease by inducing the healthy rhizospheric microbiota through alterations to the bulk soil microflora[J]. Plant and Soil, 2018, 423(1): 229-240.
(  0) 0) |
| [58] |
Singh U B, Malviya D, Singh S, et al. Salt-tolerant compatible microbial inoculants modulate physio-biochemical responses enhance plant growth, Zn biofortification and yield of wheat grown in saline-sodic soil[J]. International Journal of Environmental Research and Public Health, 2021, 18(18): 9936.
(  0) 0) |
| [59] |
Lobo C B, Tomás M S J, Viruel E, et al. Development of low-cost formulations of plant growth-promoting bacteria to be used as inoculants in beneficial agricultural technologies[J]. Microbiological Research, 2019, 219: 12-25.
(  0) 0) |
| [60] |
Li J T, Yang H, Chen Y, et al. Development and preliminary application of compound bacterial agent for degrading carbendazim and acetamiprid residues (In Chinese)[J]. Soils, 2022, 54(3): 646-652. [李锦涛, 杨涵, 陈洋, 等. 降解多菌灵和啶虫脒残留的复合菌剂研发及初步应用[J]. 土壤, 2022, 54(3): 646-652.]
(  0) 0) |
| [61] |
Wang J Z, Zhang Q, Gao Z X, et al. Effects of two microbial agents on yield, quality and rhizosphere environment of autumn cucumber cultured in organic substrate (In Chinese)[J]. Scientia Agricultura Sinica, 2021, 54(14): 3077-3087. [王君正, 张琪, 高子星, 等. 两种微生物菌剂对有机基质袋培秋黄瓜产量、品质及根际环境的影响[J]. 中国农业科学, 2021, 54(14): 3077-3087.]
(  0) 0) |
| [62] |
Molina-Romero D, Baez A, Quintero-Hernández V, et al. Compatible bacterial mixture, tolerant to desiccation, improves maize plant growth[J]. PLoS One, 2017, 12(11): e0187913.
(  0) 0) |
| [63] |
Yuan H, He P F, Wu Y X, et al. Effects of the beneficial bacteria promoting maize growth under salt stress (In Chinese)[J]. Journal of Maize Sciences, 2019, 27(1): 69-74. [袁海, 何鹏飞, 吴毅歆, 等. 盐胁迫下益生菌对玉米的促生效应研究[J]. 玉米科学, 2019, 27(1): 69-74.]
(  0) 0) |
| [64] |
Mondello F J, Turcich M P, Lobos J H, et al. Identification and modification of biphenyl dioxygenase sequences that determine the specificity of polychlorinated biphenyl degradation[J]. Applied and Environmental Microbiology, 1997, 63(8): 3096-3103.
(  0) 0) |
| [65] |
Yang X L, Li J H, Yao T, et al. Optimization of fermentation conditions of three growth promoting strains and evaluation of effects on highland barley (In Chinese)[J]. Acta Agrestia Sinica, 2022, 30(1): 212-219. [杨晓蕾, 李建宏, 姚拓, 等. 复合促生菌剂发酵条件优化及其对青稞促生效果评价[J]. 草地学报, 2022, 30(1): 212-219.]
(  0) 0) |
| [66] |
Ajeng A A, Abdullah R, Ling T C, et al. Bioformulation of biochar as a potential inoculant carrier for sustainable agriculture[J]. Environmental Technology & Innovation, 2020, 20: 101168.
(  0) 0) |
| [67] |
EI-Hadidy A. Performance of some new bioformulations against tomato fusarium wilt[J]. Egyptian Journal of Desert Research, 2019, 69(1): 1-19.
(  0) 0) |
| [68] |
Ma Y. Seed coating with beneficial microorganisms for precision agriculture[J]. Biotechnology Advances, 2019, 37(7): 107423.
(  0) 0) |
| [69] |
Wang X F, Mei X L, Huang D P, et al. Effects of probiotics with biochar as carrier inhibiting tomato soil-borne bacterial wilt (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(2): 536-544. [王孝芳, 梅新兰, 黄大鹏, 等. 生物质炭载体联合有益菌防控番茄土传青枯病的效果研究[J]. 土壤学报, 2022, 59(2): 536-544.]
(  0) 0) |
| [70] |
Fariba F, Roohallah F R, Pejman K. Survivability and controlled release of alginate-microencapsulated Pseudomonas fluorescens VUPF506 and their effects on biocontrol of Rhizoctonia solani on potato[J]. International Journal of Biological Macromolecules, 2021, 183: 627-634.
(  0) 0) |
| [71] |
El-Fattah D A A, Eweda W E, Zayed M S, et al. Effect of carrier materials, sterilization method, and storage temperature on survival and biological activities of Azotobacter chroococcum inoculant[J]. Annals of Agricultural Sciences, 2013, 58(2): 111-188.
(  0) 0) |
| [72] |
Lopes M J D S, Dias-Filho M B, Gurgel E S C. Successful plant growth-promoting microbes: Inoculation methods and abiotic factors[J]. Frontiers in Sustainable Food Systems, 2021, 5: 606454.
(  0) 0) |
| [73] |
Hernández-Montiel L G, Chiquito-Contreras C J, Murillo-Amador B, et al. Efficiency of two inoculation methods of Pseudomonas putida on growth and yield of tomato plants[J]. Journal of Soil Science and Plant Nutrition, 2017, 17(4): 1003-1012.
(  0) 0) |
| [74] |
Zafar-Ul-Hye M, Tahzeeb-Ul-Hassan M, Abid M, et al. Potential role of compost mixed biochar with rhizobacteria in mitigating lead toxicity in spinach[J]. Scientific Reports, 2020, 10(1): 12159.
(  0) 0) |
| [75] |
Misra S, Dixit V K, Mishra S K, et al. Demonstrating the potential of abiotic stress-tolerant Jeotgalicoccus huakuii NBRI 13E for plant growth promotion and salt stress amelioration[J]. Annals of Microbiology, 2019, 69: 419-434.
(  0) 0) |
| [76] |
Ullah M A, Mahmood I A, Ali A, et al. Effect of inoculation methods of biozote-max (plant growth promoting rhizobacteria-PGPR) on growth and yield of rice under naturally salt-affected soil[J]. Research in Plant Biology, 2017, 7: 24-26.
(  0) 0) |
| [77] |
Bhattacharya A, Giri V P, Singh S P, et al. Intervention of bio-protective endophyte Bacillus tequilensis enhance physiological strength of tomato during Fusarium wilt infection[J]. Biological Control, 2019, 139: 104074.
(  0) 0) |
| [78] |
Guo Q, Li Y, Lou Y, et al. Bacillus amyloliquefaciens Ba13 induces plant systemic resistance and improves rhizosphere microecology against tomato yellow leaf curl virus disease[J]. Applied Soil Ecology, 2019, 137: 154-166.
(  0) 0) |
| [79] |
Sang M K, Chun S, Kim K D. Biological control of phytophthora blight of pepper by antagonistic rhizobacteria selected from a sequential screening procedure[J]. Biological Control, 2008, 46(3): 424-433.
(  0) 0) |
| [80] |
Chaudhary T, Gera R, Shukla P. Deciphering the potential of Rhizobium pusense MB-17a, a plant growth-promoting root endophyte, and functional annotation of the genes involved in the metabolic pathway[J]. Frontiers in Bioengineering and Biotechnology, 2021, 8(1): 617034.
(  0) 0) |
| [81] |
Russo M L, Scorsetti A C, Vianna M F, et al. Effects of endophytic Beauveria bassiana (Ascomycota: Hypocreales) on biological, reproductive parameters and food preference of the soybean pest Helicoverpa geloto-poeon[J]. Journal of King Saud University— Science, 2019, 31: 1077-1082.
(  0) 0) |
| [82] |
Báez-Vallejo N, Camarena-Pozos D A, Monribot- Villanueva J L, et al. Forest tree associated bacteria for potential biological control of Fusarium solani and of Fusarium kuroshium, causal agent of Fusarium dieback[J]. Microbiological Research, 2020, 235: 126440.
(  0) 0) |
| [83] |
Farahat M G, Tahany, Rahman M, et al. Biological control of tomato bacterial wilt disease by endophytic Pseudomonas fluorescens and Bacillus subtilis[J]. Egyptian Journal of Botany, 2016, 56(2): 543-558.
(  0) 0) |
| [84] |
Mohammed A F, Oloyede A R, Odeseye A O. Biological control of bacterial wilt of tomato caused by Ralstonia solanacearum using Pseudomonas species isolated from the rhizosphere of tomato plants[J]. Archives of Phytopathology and Plant Protection, 2020, 53(1/2): 1-16.
(  0) 0) |
| [85] |
Vassilev N, Vassileva M, Lopez A, et al. Unexploited potential of some biotechnological techniques for biofertilizer production and formulation[J]. Applied Microbiology and Biotechnology, 2015, 99(12): 4983-4996.
(  0) 0) |
| [86] |
Takeshi K, Sumika H, Yoshitake S, et al. PGPR improves yield of strawberry species under less-fertilized conditions[J]. Environmental Control in Biology, 2017, 55(3): 121-128.
(  0) 0) |
| [87] |
Ali A M, Awad M Y M, Hegab S A, et al. Effect of potassium solubilizing bacteria (Bacillus cereus) on growth and yield of potato[J]. Journal of Plant Nutrition, 2021, 44(3): 411-420.
(  0) 0) |
| [88] |
Altuntas A. Comparative study on the effects of different conventional, organic and bio-fertilizers on broccoli yield and quality[J]. Applied Ecology and Environmental Research, 2018, 16: 1595-1608.
(  0) 0) |
 2023, Vol. 60
2023, Vol. 60

