2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
水稻(Oryza sativa L.)是人类最重要的口粮作物之一[1]。水稻纹枯病属于土传性真菌病害,由立枯丝核菌(Rhizoctonia solani)引起,该病害的发生和危害程度日益严重,一般可造成水稻减产10% ~ 30%,严重时可达50%[2-4]。土壤环境因素(如pH、营养物质等)会影响寄主和病原菌,既可能促进寄主的生长发育提高抵抗力也可能加剧病害的发生[5]。几丁质和β-1,3-葡聚糖是大多数真菌细胞壁的主要骨架成分[6]。几丁质酶(chitinase,CHT)可以通过破坏菌丝尖端合成的几丁质来抑制病原菌的生长,也可协同β-1,3-葡聚糖酶(β-1,3-glucanase,GLU)等充分发挥抑菌活性[6-7]。因此,CHT和GLU是植物防卫真菌病害途径中重要的病程相关蛋白(pathogenesis related proteins,PR蛋白)[7]。一般而言纹枯病菌侵染植株后,可诱导PR蛋白的增加[6]。左示敏等[4]认为超氧化物歧化酶(superoxide dismutase,SOD)是防御系统中最先表达的一个重要防御酶,其在抗病品种的活性远大于感病品种。当感染纹枯病菌后,寄主还会启动另一个防御体系,即产生过氧化氢酶(catalase,CAT)来阻止病原菌进一步的侵染和破坏[7]。此外,多酚氧化酶(polyphenol oxidase,PPO)与苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)均可参与植物体内木质素等的合成,以此来抑制病害的发展[3,8]。
作为全球气候变化的主要特征,大气CO2浓度([CO2])和空气温度已经并将持续增加。预计到21世纪末,[CO2]可达500~1 000 μmol·mol–1,相应的气温将增加1.0~3.7℃[9]。已有研究表明,高[CO2]和温升会增加纹枯病的病情发展风险[10]。当R. solani侵染后,高[CO2]和温升对植株叶片和茎鞘PR蛋白与相关防御酶的影响,及其与纹枯病发生程度的作用机制尚不清楚。
因此,本研究选用水稻纹枯病易感品种Lemont(Oryza sativa L. japonica)和抗性品种YSBR1(Oryza sativa L. indica)为试验对象,利用开放式自由大气[CO2]升高和温升(T-FACE)平台,模拟未来气候变化下[CO2]升高和温升情景,通过人工接种R. solani探究水稻纹枯病抗性和易感品种病斑发展速率,探究叶片和茎鞘中PR蛋白和相关防御酶、土壤基本理化性状对[CO2]和温度升高的响应及其与纹枯病病斑发展速率的内在相关性。
1 材料与方法 1.1 试验地点和T-FACE平台信息T-FACE平台位于江苏省常熟市古里镇康博村(31°30′N,120°33′E),该试验地点属于典型的亚热带季风气候[11-12]。该平台由12个正八边形的小区组成;每个小区直径8 m,覆盖面积约50 m2;各小区具有相似的土壤性质与农艺历史。该平台共设有4个处理:正常田间环境条件作为对照(CT)、大气[CO2]升高至590 μmol·mol–1(C+T)、冠层温度较对照升高2℃(CT+)以及高[CO2]与温升互作(C+T+)处理,每个处理设3个重复。有关该T-FACE平台的详细描述和设计原理等可见Cai等[11]。
1.2 试验栽培管理供试水稻品种为Lemont(粳稻亚种)和YSBR1(籼稻亚种),于2020年和2021年的水稻试验季种植。其中,Lemont为水稻纹枯病易感品种,YSBR1为高抗性品种[4,13]。Lemont和YSBR1的生育期相近,2020年分别为142 d和146 d,2021年均为143 d。将两品种置于相同的大气环境下及水分管理下育秧,分别于2020年6月22日和2021年6月26日移栽。每穴移栽2颗苗,株行距为16.7 cm × 25 cm(即种植密度24穴·m–2)。在2020和2021年的水稻生长季6—10月,T-FACE运行期间[CO2]平均增幅在183~205 μmol·mol–1,温度平均增幅在1.6~2.2℃。两年的氮肥基肥、分蘖肥和穗肥的量均为6.9、6.0和5.2 g·m–2,并进行统一的田间管理措施[10]。在完成接种调查试验后会进行正常田间病害防治管理,避免影响试验小区其他植株。
1.3 田间人工接种R. solani及病斑发展速率调查试验研究使用中等强度的纹枯病致病菌株(R. solani,YN-7 isolate),由扬州大学病理教研室提供,有关该病株的详细信息见左示敏等[4,14]。接种时,首先将扁平的薄木签截成长1.0 cm、宽2 mm,平铺于空白培养皿中进行高压灭菌。然后加入灭菌后的马铃薯葡萄糖培养液(potato dextrose broth,PDB),并在培养皿中央接入相同大小的R. solani菌丝块,置于28℃黑暗环境中培养至菌丝铺满培养基。将定殖R. solani的木签作为接种物,分别于2020年和2021年8月17日接种到田间对照和处理下生长的水稻植株。每个小区,Lemont和YSBR1均接种12穴,每穴接种3个主茎。具体为将定殖R. solani的木签嵌入到倒3叶鞘中约1 cm深,并在接种后保持叶鞘抱茎的状态不变[4,10,13]。于2020年和2021年的8月17日接种R. solani,9月4日进行病斑调查,侵染试验持续19 d。计算整个侵染试验期间病斑的发展速率:
| $ V = L/D $ | (1) |
式中,V为病斑垂直方向发展速率(mm·d–1);L为感病植株上病斑垂直方向的总长(mm),用尺测量从病斑垂直方向上最低点到最高点的长度;D为发病发展的天数(d),即侵染试验总天数19。
1.4 土壤样品分析及R. solani培养试验于2020年9月5日田间采集不同处理下Lemont和YSBR1的耕作土,根据样品分析标准将土壤样品部分自然风干。风干土过20目筛,用Mettler-Toledo pH计测土壤pH,土水比1:2.5(w/w)。称取5 g过100目筛的风干土,H2SO4-H2O2消煮冷却后定容至50 mL,用火焰光度法测定全钾(total potassium,TK),用元素分析仪(Perkin Elmer 2400,Series II CHNS/O analyzer,Perkin Elmer Inc.,Waltham,MA,美国)测定土壤全氮(total nitrogen,TN)和全磷(total phosphorus,TP)。根据重铬酸钾外加热法测定土壤总有机碳(total organic carbon,TOC)[15]。
利用上述各处理下Lemont和YSBR1过20目筛风干后的耕作土,制作土壤浸液培养基。分别称取100 g土壤样品并加入200 mL超纯水,在摇床180 r·min–1转速下,震荡60 min充分混匀。将液体过滤至空白烧杯锥形瓶中,定容至500 mL,按照每100 mL煎汁:1 g琼脂比进行添加。121℃高压灭菌后转移至灭菌过的超净工作台中,在直径为90 mm的新培养皿中加入相同体积培养基,冷却、凝固后备用。最后,将准备好的R. solani菌丝块接种至新制作的不同处理下的土壤浸提液培养基中间,28℃的黑暗条件下培养,每个温度梯度中不同培养基设置5个重复。36 h后十字交叉法测量菌落生长直径,计算R. solani菌丝生长速率(mm·h–1)[16]。
1.5 PR蛋白和防御酶活性测定于2020年9月4日进行田间取样。每个小区每个品种取3个侵染的单茎,每个单茎分样为接种R. solani的茎秆所对应的剑叶,以及病健交界处的茎鞘(包含茎秆和叶鞘)。取样后,立刻用液氮速冻,–80℃保存备用。关于定量蛋白浓度的测定,分别称取一定量样品置入离心管中,后按质量(g)与0.1 mol·L–1 pH 7.4磷酸盐缓冲液(mL)1︰9的比例在冰水浴下进行匀浆,取上清液用生理盐水按1︰9稀释成1%组织匀浆待测。根据BCA微板法(货号:P0012S,碧云天生物技术公司),在碱性条件下,蛋白将Cu2+还原为Cu+,Cu+与BCA试剂形成紫色的络合物,在562 nm(Thermo Evolution 201,美国)处测得吸光度,最终计算蛋白浓度[9]。关于PR蛋白和防御酶活性的测定,分别称取0.5 g样品加入一定量的PBS(pH=7.4),充分匀浆,离心收集上清液待测。PR蛋白(GLU和CHT)和防御酶(SOD、CAT、PPO和PAL)活性分别用对应的酶联免疫法试剂盒(货号:JL22712、JL13589、JL22719、JL22741、JL22725、JL22714;上海江莱生物科技有限公司)进行测定,具体操作参照试剂盒详细步骤,最终反应液通过酶标仪(Thermo Multiskan Sky,美国)测定在450 nm下的吸光度,酶活性表示为每克蛋白质的活性单位(U·mg–1 pro)[10]。
1.6 数据处理使用IBM SPSS 26对数据进行统计分析,采用单变量方差分析(univariate analysis of variance,ANOVA)来检验品种、[CO2]和温度对PR蛋白和相关防御酶活性及纹枯病病斑发展速率的影响,显著水平为P < 0.05。利用Origin pro 2023进行绘图。
2 结果 2.1 [CO2]升高和温升对土壤基本理化性状的影响就品种而言,Lemont的耕作土的pH显著低于YSBR1(表 1)。就处理影响而言,高[CO2](C+T)显著降低了Lemont和YSBR1耕作土的pH,但显著增加了Lemont和YSBR1耕作土的TN含量和TOC含量。温升(CT+)显著增加了Lemont和YSBR1耕作土的pH、TOC含量,以及YSBR1耕作土的TN含量,但是显著降低了Lemont耕作土的TP含量。此外,[CO2]和温度对Lemont耕作土的pH与YSBR1耕作土的TN含量具有显著交互作用。
|
|
表 1 土壤基本理化性状及[CO2]、温度和品种对理化性质影响的方差分析 Table 1 The basic physical and chemical properties of soil, and summary of the analysis of variance(ANOVA) for the influence of [CO2], temperature, and variety on physical and chemical properties of soil |
就品种而言,Lemont对应的土壤浸提液培养基中R. solani菌丝生长速率整体上显著高于YSBR1,增幅为3.48%~7.64%(图 1)。就处理影响而言,与对照相比,高[CO2]、温升以及两者交互作用下Lemont和YSBR1对应的土壤浸提液培养基中R. solani的生长速率均无显著差异(图 1)。
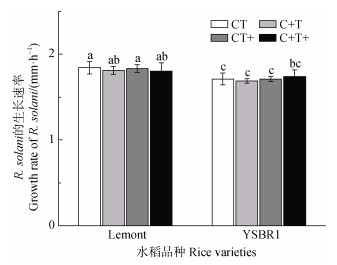
|
注:不同小写字母表示处理间差异达P < 0.05显著水平,下同。 Note: Different lowercase letters indicate significant differences between different treatments, P < 0.05. The same below. 图 1 各处理下Lemont和YSBR1对应土壤浸提液培养基中R. solani生长速率 Fig. 1 Growth rate of R. solani cultured on soil extract medium by cvs Lemont and YSBR1 under different treatments |
就品种而言,在对照以及高[CO2]和温升的处理下,YSBR1感病植株叶片中测定的PR蛋白和相关防御酶活性均显著高于Lemont。就处理影响而言,高[CO2]和温升对两个品种叶片的PR蛋白和相关防御酶活性均无显著影响(图 2,表 2)。高[CO2]和温度对Lemont植株叶片的GLU、SOD和POD,及YSBR1植株叶片的GLU和CHT有显著的交互作用(表 2)。与对照相比,[CO2]和温度同时升高会降低Lemont和YSBR1叶片中的GLU活性(分别降低6.03%和3.72%),但增加了Lemont叶片中的SOD和PPO活性(分别增加4.47%和23.52%)以及YSBR1叶片中CHT的活性(增加6.75%,图 2,表 2)。
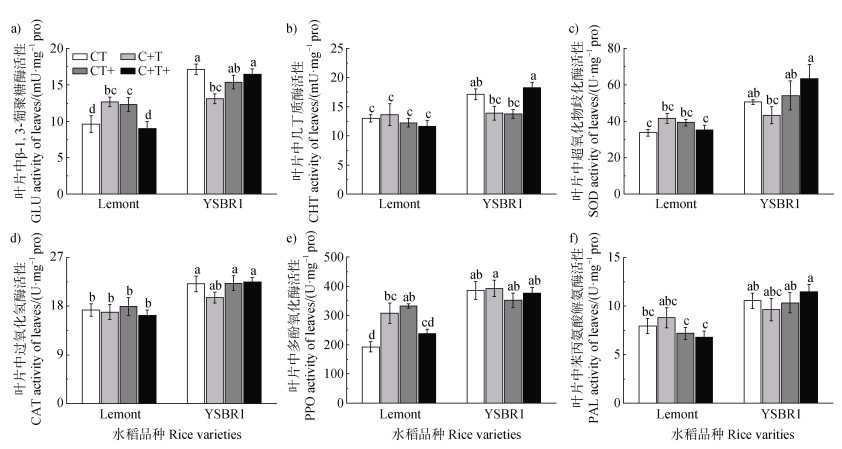
|
图 2 不同[CO2]和温度处理对感病后的Lemont和YSBR1叶片中β-1,3-葡聚糖酶(a)、几丁质酶(b)、超氧化物歧化酶(c)、过氧化氢酶(d)、多酚氧化酶(e)和苯丙氨酸解氨酶(f)活性的影响 Fig. 2 Effects of different [CO2] and temperature treatments on GLU(a), CHT(b), SOD(c), CAT(d), PPO(e) and PAL(f) activities in leaves in infected plants with R. solani for cvs Lemont and YSBR1 |
|
|
表 2 不同[CO2]、温度和品种间感病植株叶片中PR蛋白与相关防御酶活性差异的方差分析 Table 2 Summary of analysis of variance(ANOVA) for the influence of [CO2], temperature and variety on the PR proteins and defense enzymes activities in leaves in infected plants with R. solani |
就品种而言,YSBR1感病茎鞘中部分防御酶(SOD和CAT)活显著高于Lemont(图 3,表 3)。就处理影响而言,高[CO2]会显著降低Lemont茎鞘中CHT活性;温升会显著增加Lemont茎鞘中GLU,CHT,PPO和CAT活性以及YSBR1茎鞘中CHT活性(图 3,表 3)。此外,[CO2]和温度对Lemont茎鞘的CAT和PAL以及YSBR1茎鞘的GLU和SOD有显著交互作用(表 3)。与对照相比,[CO2]和温度同时升高会增加Lemont茎鞘中CAT和PAL活性(36.72%和10.18%)以及YSBR1茎鞘中GLU和SOD活性(12.98%和16.20%,图 3,表 3)。
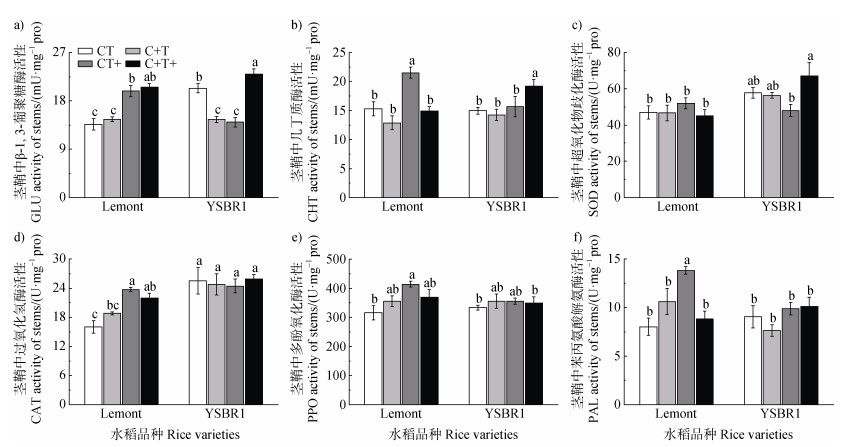
|
图 3 不同[CO2]和温度处理对感病后的Lemont和YSBR1茎鞘中β-1,3-葡聚糖酶(a)、几丁质酶(b)、超氧化物歧化酶(c)、过氧化氢酶(d)、多酚氧化酶(e)和苯丙氨酸解氨酶(f)活性的影响 Fig. 3 Effects of different [CO2] and temperature treatments on GLU(a), CHT(b), SOD(c), CAT(d), PPO(e) and PAL(f) activities in stems in infected plants with R. solani for cvs Lemont and YSBR1 |
|
|
表 3 不同[CO2]、温度和品种间感病植株茎鞘中PR蛋白与相关防御酶活性差异的方差分析 Table 3 Summary of analysis of variance(ANOVA) for the influence of [CO2], temperature and variety on the PR proteins and defense enzymes activities in stems in infected plants with R. solani |
2020年和2021年结果均显示纹枯病易感品种Lemont的病斑发展速率显著高于抗纹枯病品种YSBR1(表 4)。年际间[CO2]升高和温升对水稻植株纹枯病病斑发展速率的影响也是一致的。具体表现为,[CO2]升高对2020年和2021年两个品种纹枯病病斑发展速率均无显著影响;而温升显著增加2020年和2021年两个品种纹枯病病斑发展速率(表 4)。此外,本研究结果还发现,温升对2020年水稻植株纹枯病病斑发展速率的影响表现出明显的品种差异。相关数据表明,温升对2020年Lemont植株的纹枯病病斑发展速率的促进作用要明显高于YSBR1植株。[CO2]和温度对2020年水稻植株纹枯病病斑发展速率有显著的交互作用(表 4)。与对照相比,2020年和2021年温升及其与高[CO2]互作会增加Lemont植株纹枯病病斑发展速率(约为21%~45%)以及YSBR1植株纹枯病病斑发展速率(约为–4%~28%,表 4)。
|
|
表 4 Lemont和YSBR1在CT、C+T、CT+和C+T+处理下纹枯病病斑垂直扩展速率 Table 4 Development rate of the vertical length of ShB lesions for cvs Lemont and YSBR1 under ambient condition, elevated [CO2], elevated temperature, and the combination of elevated [CO2] and elevated temperature treatments |
对叶片的PR蛋白和相关防御酶活性与纹枯病病斑发展速率的相关性分析表明,Lemont植株纹枯病病斑发展速率仅与叶片的PAL呈显著的负相关(表 5)。对茎鞘的PR蛋白和相关防御酶活性与纹枯病病斑发展速率的相关性分析表明,Lemont植株纹枯病病斑发展速率与茎鞘的GLU和CAT呈显著的正相关;YSBR1植株纹枯病病斑发展速率与茎鞘的GLU和PAL呈显著的正相关(表 5)。
|
|
表 5 Lemont和YSBR1纹枯病病斑垂直发展速率与叶片和茎鞘中PR蛋白和相关防御酶活性的相关性 Table 5 Correlation between development rate of vertical length of ShB lesions for cvs Lemont and YSBR1 and PR proteins and defense enzymes activities in leaves and stems |
本研究中,Lemont的耕作土的pH显著低于YSBR1(表 1)。高[CO2]和温升对不同水稻品种耕作土基本理化性质的影响可能会间接影响植株的生长发育。已有研究表明,R. solani喜偏酸性的土壤,田间增施钾肥等有利于降低病害严重程度[1,5,17]。这可能与Lemont耕作土中的生长环境或营养物质更有利于R. solani的生长有关,从而解释了研究结果中Lemont土壤浸提液培养基中R. solani菌丝生长速率较YSBR1明显增加了3.48%~7.64%(图 1)。[CO2]升高显著降低了两水稻品种耕作土的pH,增加了两水稻品种耕作土TN和TOC含量;温升显著增加了两水稻品种耕作土的pH和TOC含量以及YSBR1耕作土的TN含量,但是显著降低了Lemont耕作土的TP含量(表 1)。不同抗性品种的土壤基本理化性状的变化不完全一致,这可能因为不同水稻品种根际养分吸收对高[CO2]和温升的响应不同。相关研究显示,生长环境会直接影响病原菌,而病害的严重程度与寄主防御机制或营养状态相互作用[18]。但是,对于不同纹枯病抗性品种而言,高[CO2]和温升下耕作土制成的土壤浸提液培养基中R. solani菌丝生长速率均无显著影响(图 1)。这说明接种R. solani后,在温升及其与高[CO2]互作处理下,病斑发展速率的加剧与土壤基本理化性质无关。
张国良等[6]研究显示,R. solani的入侵会诱导水稻叶片和叶鞘PR蛋白的增加。水稻接种R. solani后,植株体内SOD、CAT、PPO和PAL等与抗病反应密切相关的防御酶活性会产生显著变化[6-7,14]。由此可见,病原入侵后,PR蛋白和相关防御酶在寄主的防卫系统中起重要作用。本试验中选育的YSBR1是经过多年抗性研究筛选出的抗性高且表现稳定的水稻品种,而Lemont则为对纹枯病高度易感的水稻品种[4,13-14,19]。研究结果显示,当R. solani入侵后,各处理下YSBR1叶片中PR蛋白和相关防御酶以及茎鞘中SOD和CAT活性均显著高于Lemont(图 2和图 3;表 2和表 3)。这表明YSBR1植株的整体防御系统更强,可进一步阻止病原入侵,有力地支持了前人的研究结果[13-14]。同时进一步说明,品种间对纹枯病抗性的差异及其表现出的PR蛋白和防御酶活性的差异在未来[CO2]升高和温升情景下依然持续。
为厘清PR蛋白和防御酶活性在抗性机制中的作用,本研究探究了相关指标与纹枯病病斑发展速率的相关性。研究结果表明,温升及其与高[CO2]互作显著增加两个品种纹枯病病斑发展速率,而且这种促进效应在年际间是一致的(表 4)。与对照相比,2020年和2021年温升(CT+)及其与[CO2]升高互作(C+T+)显著增加了Lemont的纹枯病发展速率约21%~45%,增加YSBR1纹枯病发展速率约–4%~28%(表 4)。前人的研究结果表明,水稻纹枯病喜高温高湿,而且温度本身也会直接影响R. solani生长[20-22]。[CO2]升高也会增加纹枯病在田间的自然发病率[23]。进一步分析表明,对两个品种而言,各处理下纹枯病病斑的发展速率均与茎鞘中的GLU呈显著正相关,而与叶片中PR蛋白和防御酶活性无一致性的相关性(表 5)。因此,本研究表明,未来[CO2]升高和温升对水稻植株纹枯病病斑发展速率的影响会诱导茎鞘中GLU的相应响应变化。
本研究结果显示,[CO2]升高对2020年两个品种植株茎鞘中的GLU均无显著性的影响,而温升仅会显著增加2020年Lemont植株茎鞘中的GLU(表 3)。这与[CO2]升高对2020年两个品种植株纹枯病病斑发展速率均无显著性的影响,而温升会明显增加2020年Lemont植株纹枯病病斑发展速率有关(表 3)。上述结果表明,两个不同抗性品种的纹枯病病斑发展速率对温升及其与[CO2]升高互作的响应差异会诱导茎鞘中的GLU作出相应的响应差异。因此,在R. solani侵染后,YSBR1中较强的防卫反应,应该是其在高[CO2]和温升条件下病情发展速率相对稳定的重要因素。因此,在考虑未来纹枯病抗性品种的选育过程中,可以重点关注PR蛋白与防御酶(尤其是茎鞘中的GLU)相关基因的筛选,这有利于进一步保障未来气候变化下的粮食安全。
4 结论在R. solani侵染水稻植株后,纹枯病抗性品种YSBR1植株中PR蛋白和相关防御酶形成的防卫反应整体显著高于易感品种Lemont,这种品种间的差异表现在当前及未来[CO2]升高和温升情景下同样存在。从而表现出在当前及未来[CO2]升高和温升情景下,YSBR1植株中纹枯病病斑发展速率明显低于Lemont植株。温升及其与[CO2]升高的互作会显著增加Lemont植株的纹枯病发展速率。YSBR1和Lemont植株纹枯病病斑的发展速率与其茎鞘的β-1,3-葡聚糖酶(GLU)显著性正相关。因此,不同水稻品种间纹枯病抗性差异及其对未来[CO2]升高和温升的响应差异可以通过相关的PR蛋白和防御酶(尤其是茎鞘中的GLU)的变化来指征。
致谢 特别感谢南京农业大学刘晓雨和潘根兴老师自2011年以来为常熟T-FACE平台建立与顺利运行提供的帮助和支持;特别感谢扬州大学左示敏老师及其团队为本试验提供的Lemont和YSBR1的水稻种子、纹枯病致病菌株(R. solani,YN-7 isolate),以及对田间纹枯病接种工作的指导和帮助。
| [1] |
Senapati M, Tiwari A, Sharma N, et al. Rhizoctonia solani Kühn pathophysiology: Status and prospects of sheath blight disease management in rice[J]. Frontiers in Plant Science, 2022, 13: 881116. DOI:10.3389/fpls.2022.881116
(  0) 0) |
| [2] |
Mishra D, Rajput R S, Zaidi N W, et al. Sheath blight and drought stress management in rice(Oryza sativa) through Trichoderma spp[J]. Indian Phytopathology, 2020, 73(1): 71-77. DOI:10.1007/s42360-019-00189-8
(  0) 0) |
| [3] |
Wu Y S, Chen Y Z, Meng X M, et al. Change of defence enzyme activity during resistant reaction to rice sheath blight (In Chinese)[J]. Chinese Agricultural Science Bulletin, 2008, 24(5): 327-330. [吴样孙, 陈一壮, 蒙信满, 等. 水稻纹枯病抗性反应中主要防御酶的活性变化[J]. 中国农学通报, 2008, 24(5): 327-330.]
(  0) 0) |
| [4] |
Zuo S M, Zhang Y M, Xue X, et al. Preliminary study on resistance mechanism of the new rice line YSBR1 to sheath blight (In Chinese)[J]. Chinese Journal of Rice Science, 2014, 28(2): 132-140. DOI:10.3969/j.issn.1001-7216.2014.02.004 [左示敏, 张玉梅, 薛芗, 等. 水稻新种质YSBR1抗纹枯病机制的初步研究[J]. 中国水稻科学, 2014, 28(2): 132-140.]
(  0) 0) |
| [5] |
Zhou E X, Yang M, Chen Y L. The effects of soil environmental factors on the saprophytic colonization of Rhizoctonia solani (In Chinese)[J]. Acta Phytopathologica Sinica, 2002, 32(3): 214-218. DOI:10.3321/j.issn:0412-0914.2002.03.004 [周而勋, 杨媚, 陈友林. 土壤环境因素对水稻纹枯病菌腐生定殖能力的影响[J]. 植物病理学报, 2002, 32(3): 214-218.]
(  0) 0) |
| [6] |
Zhang G L, Ding Y, Wang Q Q, et al. Effects of silicon on chitinase and β-1, 3-glucanase activities of rice infected by Rhizoctonia solani and its relation to resistance (In Chinese)[J]. Plant Nutrition and Fertilizer Science, 2010, 16(3): 598-604. [张国良, 丁原, 王清清, 等. 硅对水稻几丁质酶和β-1, 3-葡聚糖酶活性的影响及其与抗纹枯病的关系[J]. 植物营养与肥料学报, 2010, 16(3): 598-604.]
(  0) 0) |
| [7] |
Liu W G, Yuan H X, Tan S E, et al. Temporal changes of both chitinase and β-1, 3-glucanase activities in transgenic rice with extra anti-fungal genes (In Chinese)[J]. Chinese Agricultural Science Bulletin, 2012, 28(27): 5-9. [刘晚苟, 袁红旭, 谭书恩, 等. 转抗真菌基因水稻几丁质酶和β-1, 3-葡聚糖酶活性的时间变化[J]. 中国农学通报, 2012, 28(27): 5-9.]
(  0) 0) |
| [8] |
Wang H H, Lin Q Y, Xie L H, et al. The effects of three cucumber mosaic virus isolates on the defendant enzymes and cell membrane permeability in tobacco cells (In Chinese)[J]. Acta Phytopathologica Sinica, 2001, 31(1): 43-49. [王海河, 林奇英, 谢联辉, 等. 黄瓜花叶病毒三个毒株对烟草细胞内防御酶系统及细胞膜通透性的影响[J]. 植物病理学报, 2001, 31(1): 43-49.]
(  0) 0) |
| [9] |
IPCC. Summary for policymakers//Climate change 2021: The physical science basis. Contribution of Working Group I to the Sixth Assessment Report of the Intergovernmental Panel on climate change[M]. Cambridge: Cambridge University Press, 2021.
(  0) 0) |
| [10] |
Shen M, Cai C, Song L, et al. Elevated CO2 and temperature under future climate change increase severity of rice sheath blight[J]. Frontiers in Plant Science, 2023, 14: 1115614. DOI:10.3389/fpls.2023.1115614
(  0) 0) |
| [11] |
Cai C, Yin X Y, He S Q, et al. Responses of wheat and rice to factorial combinations of ambient and elevated CO2 and temperature in FACE experiments[J]. Global Change Biology, 2016, 22(2): 856-874. DOI:10.1111/gcb.13065
(  0) 0) |
| [12] |
Tao Y, Cai C, Wei W, et al. Effects of elevated atmospheric CO2 concentration on root growth of "strong" and "weak" response rice varieties: A FACE study (In Chinese)[J]. Soils, 2022, 54(4): 763-768. [陶冶, 蔡创, 韦薇, 等. 大气CO2浓度升高对高、低响应水稻品种根系生长的影响——FACE研究[J]. 土壤, 2022, 54(4): 763-768.]
(  0) 0) |
| [13] |
Xue X, Cao Z X, Zhang X T, et al. Overexpression of OsOSM1 enhances resistance to rice sheath blight[J]. Plant Disease, 2016, 100(8): 1634-1642. DOI:10.1094/PDIS-11-15-1372-RE
(  0) 0) |
| [14] |
Zuo S M, Chen X J, Chen H Q, et al. Defense response and physiological difference of rice cultivars with different sheath blight resistance levels to the toxins produced by Rhizoctonia solani (In Chinese)[J]. Chinese Journal of Rice Science, 2014, 28(5): 551-558. DOI:10.3969/j.issn.1001-7216.2014.05.16 [左示敏, 陈夕军, 陈红旗, 等. 不同抗性水平水稻品种对纹枯病菌毒素的防卫反应与生理差异[J]. 中国水稻科学, 2014, 28(5): 551-558.]
(  0) 0) |
| [15] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [16] |
He X X, Cao Q Q, Peng Z K, et al. Comparison of differences in biological characteristics of Rhizoctonia spp. isolated from three kinds of crops (In Chinese)[J]. Journal of Huazhong Agricultural University, 2012, 31(1): 55-61. [贺晓霞, 曹琦琦, 彭正凯, 等. 3种作物纹枯病菌生物学特性差异的比较[J]. 华中农业大学学报, 2012, 31(1): 55-61.]
(  0) 0) |
| [17] |
Prasad D, Singh R, Singh A. Management of sheath blight of rice with integrated nutrients[J]. Indian Phytopathology, 2010, 63(1): 11-15.
(  0) 0) |
| [18] |
Bousset L, Ermel M, Soglonou B, et al. A method to measure redox potential(Eh) and pH in agar media and plants shows that fungal growth is affected by and affects pH and Eh[J]. Fungal Biology, 2019, 123(2): 117-124.
(  0) 0) |
| [19] |
Zuo S M, Wang Z B, Chen X J, et al. Evaluation of resistance of a novel rice germplasm YSBR1 to sheath blight (In Chinese)[J]. Acta Agronomica Sinica, 2009, 35(4): 608-614. [左示敏, 王子斌, 陈夕军, 等. 水稻纹枯病改良新抗源YSBR1的抗性评价[J]. 作物学报, 2009, 35(4): 608-614.]
(  0) 0) |
| [20] |
Biswas B, Dhaliwal L, Chahal S K, et al. Effect of meteorological factors on rice sheath blight and exploratory development of a predictive model[J]. Indian Journal of Agricultural Sciences, 2011, 81(3): 256-260.
(  0) 0) |
| [21] |
Castilla N P, Leaño R M, Elazhour F A, et al. Effects of plant contact, inoculation pattern, leaf wetness regime, and nitrogen supply on inoculum efficiency in rice sheath blight[J]. Journal of Phytopathology, 1996, 144(4): 187-192.
(  0) 0) |
| [22] |
Lee F N, Rush M C. Rice sheath blight: A major rice disease[J]. Plant Disease, 1983, 67(7): 829-832.
(  0) 0) |
| [23] |
Kobayashi T, Ishiguro K, Nakajima T, et al. Effects of elevated atmospheric CO2 concentration on the infection of rice blast and sheath blight[J]. Phytopathology®, 2006, 96(4): 425-431.
(  0) 0) |
 2024, Vol. 61
2024, Vol. 61


