2. 中国科学院大学, 北京 100049;
3. 中国科学院大学南京学院, 南京 211135
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. University of Chinese Academy of Sciences, Nanjing, Nanjing 211135, China
无机肥通常用于补偿作物生长阶段土壤养分的损失,它的施用保证了粮食供应,在农业生产中发挥着重要作用[1]。但持续和单一的无机施肥对土壤健康和长期生产力具有不利影响,如养分利用效率下降、土壤有机碳流失加快、土壤酸化加剧和土壤结构破坏等[2]。因此,如何提升作物产量并控制无机肥的不利影响是农业可持续发展研究的重点。
作物秸秆含有氮、磷和钾等营养元素,以及纤维素、半纤维素、木质素、蛋白质和碳水化合物等有机化合物[3]。畜禽粪便是一种重要的有机资源,富含有机质和多种作物生长所需的营养物质[1],快速发展的畜禽业产生了大量畜禽粪便,但利用效率较低。诸多研究[1,3-4]表明,化肥与秸秆和/或粪肥联合施用是维持土壤健康的有效措施,使有机养分资源得到合理利用,还可部分替代化肥而有效减少化肥用量,并通过增加土壤养分、提高土壤有机质含量、改善土壤结构和保水性以及增加有益微生物等方式,提高土壤肥力和作物产量。例如Ma等[5]研究发现,在施入氮、磷、钾总量相同的情况下,化肥配施粪肥处理较仅施化肥处理对作物产量提升更高。
土壤微生物是土壤生态系统中的重要组成部分,不同施肥措施可通过改变土壤环境和营养状况而影响土壤微生物的群落组成和多样性[6],例如有研究发现,秸秆还田提供的易分解碳源(可溶性有机碳(DOC)、微生物生物量碳(MBC)、颗粒有机碳(POC)和易氧化有机碳(ROC)等)是土壤微生物的重要能量来源,可改变微生物群落结构[7]。土壤微生物群落对作物的生长具有直接或间接影响,例如一些微生物能够促进土壤养分循环,为作物生长增加碳、氮和磷等养分供应;共生微生物对土壤养分和水分的竞争会影响作物生长;一些病原菌不利于作物生长;以及一些微生物能够抑制影响作物生长的病原菌的生长[8]。然而,农业生态系统中与作物生产力高度相关的关键微生物类群清单当前仍需完善[9]。
土壤微生物间相互作用形成生态网络,网络分析可提供土壤微生物之间存在的潜在联系的重要信息,并可识别与作物生产力等相关的关键微生物类群[10]。网络中的模块是处于相似生态位且具有强相互作用的微生物的集合,有研究表明,模块内的差异优势物种在群落结构和功能中发挥着核心和关键作用[11-12]。但不同施肥方式对土壤微生物共生模式的影响尚不清楚。
本研究以设置在河南封丘的长期田间试验为研究平台,研究5种施肥处理的细菌和真菌群落与小麦产量之间的相关性,以期明确秸秆配施化肥和粪肥对土壤细菌和真菌群落结构的影响,并识别影响小麦产量的关键细菌和真菌,以及探究关键微生物影响小麦产量的作用机制。
1 材料与方法 1.1 研究区概况试验地位于河南省新乡市封丘县的中国科学院封丘农业生态实验站(35°01′N,114°24′E)。该区域属半干旱半湿润的暖温带季风气候,年均温度13.9 ℃,年均降雨量615 mm,蒸发量约1 875 mm,全年日照时数2 300~2 500 h。土壤类型为黄河冲积物发育形成的典型潮土,耕层土壤质地为碱性砂质壤土。
1.2 试验设计长期定位试验始于2012年10月,设置5个处理:不施化肥+秸秆离田(N0S0)、不施化肥+秸秆还田(N0S)、常规施化肥+秸秆离田(NS0)、常规施化肥+秸秆还田(NS)和施化肥+秸秆还田+鸡粪替代20%氮肥(NSM),每个处理设3个重复。各小区面积3 m2(2 m×1.5 m),试验小区随机分布。长期试验开始前,土壤(0~20 cm)基础理化性质为:pH 9.14,土壤有机质(SOM)5.47 g·kg–1,全氮(TN)0.31 g·kg–1,全磷(TP)0.81 g·kg–1,全钾(TK)12.96 g·kg–1,硝态氮(NO3–-N)4.39 mg·kg–1,铵态氮(NH4+-N)1.66 mg·kg–1,有效磷(AP)17.84 mg·kg–1。
作物种植方式为夏玉米和冬小麦轮作,玉米品种为郑单958,小麦品种为百农矮抗58。N0S、NS和NSM处理在播种前将该小区上一季作物收获的秸秆粉碎后全部还田,N0S0和NS0处理在作物收获后将该小区作物的地上部分全部移除。
NS0、NS和NSM处理在小麦季的施肥标准为:氮肥(N)250.0 kg·hm–2、磷肥(P2O5)160.0 kg·hm–2、钾肥(K2O)105.0 kg·hm–2;在玉米季的施肥标准为:氮肥(N)210.0 kg·hm–2、磷肥(P2O5)134.4 kg·hm–2、钾肥(K2O)88.2 kg·hm–2。磷肥和钾肥在两季施肥中均为基施。氮肥在小麦季60%为基施,其余40%于返青期作为追肥施用;在玉米季40%为基施,其余60%于大喇叭口期作为追肥施用。小麦季和玉米季所施化肥均为尿素(含N 46.0%)、磷酸二铵(含P2O5 42.0%)和硫酸钾(含K2O 52.0%)。两季施肥中,NSM处理施用的尿素含氮量占氮肥施用标准80%,其余20%使用鸡粪替代,并将磷肥和钾肥施用标准减去所施鸡粪中的P2O5和K2O含量后,使用磷酸二铵和硫酸钾补充以达到施用标准,鸡粪作为基肥施用。
1.3 样品采集与测定土壤样品于2019年6月小麦收获后采集。使用土钻根据S型采样法采集每个小区0~20 cm土样,混合后分成三部分,一部分风干后用于土壤基本理化性质测定,一部分保存于-20℃用于测定土壤DOC、可溶性有机氮(DON)、MBC和微生物生物量氮(MBN),一部分保存于-80℃用于土壤DNA提取。
pH、电导率(EC)、土壤有机碳(SOC)、碱解氮(AHN)、AP和速效钾(AK)采用常规方法[13]测定,DOC、DON采用Multi C/N分析仪(Analytik Jena,Multi 3100,德国)测定;MBC和MBN采用氯仿熏蒸法[13]测定;ROC采用高锰酸钾氧化法[14]测定;POC采用Cambardella和Elliott[15]的方法测定。
1.4 土壤DNA提取与高通量测序土壤DNA使用Fast DNA Spin Kit for Soil(MP Biomedicals,Santa Ana,CA,美国)试剂盒,依据说明书步骤从0.50 g鲜土中提取。使用NanoDrop ND-1000分光光度计(Thermo Fisher Scientific,Waltham,MA,美国)测量DNA纯度和浓度。分别使用引物515F(5′-GTGCCAGCMGCCGCGGTA A-3′)/907R(5′-CCGTCAATTCMTTTRAGTTT-3′)和ITS5F(5′-GGAAGTAAAAGTCGTAACAAGG-3′)/ITS1R(5′-GCTGCGTTCTTCATCGATGC-3′)进行细菌和真菌PCR扩增。PCR扩增物使用Vazyme VAHTSTM DNA Clean Beads(Vazyme,中国)进行纯化。将样品的PCR扩增物等摩尔混合后,使用Illumina MiSeq平台的MiSeq Reagent Kit v3测序仪进行序列分析(委托上海派森诺生物科技股份有限公司测定)。使用QIIME 2(2019.4)处理测序数据,使用demux插件对原始序列数据进行样本拆分,然后使用cutadapt插件切除引物,使用DADA2插件对数据进行去噪、拼接及去除嵌合体,之后将扩增子序列变异(ASVs)进行比对,并用fasttree 2构建系统发育树。采用Blast方法用Greengenes和UNITE数据库分别对细菌和真菌注释。
1.5 数据处理使用SPSS 26.0软件的单因素方差分析(ANOVA)和Duncan多重比较分析不同处理间土壤理化性质、小麦籽粒产量、细菌和真菌的门水平相对丰度、细菌-真菌共现网络中各模块相对丰度以及各模块优势属相对丰度的差异。使用R 4.2.2软件的vegan包进行主坐标分析(principal coordinate analysis,PCoA)、典范对应分析(canonical correspondence analysis,CCA)、冗余分析(redundancy analysis,RDA)和α多样性指数分析;使用置换多元方差分析(permutational multivariate analysis of variance,PERMANOVA)判断不同处理间土壤细菌和真菌群落结构的差异,使用蒙特卡洛置换检验(Monte Carlo permutation test,999 permutatio-ns)对影响土壤细菌和真菌群落结构的土壤理化性质进行显著性检验。使用R 4.2.2软件的Hmisc包进行细菌-真菌共现网络的微生物类群过滤和网络模块划分,使用Gephi 0.9.7软件绘制细菌-真菌共现网络图。计算细菌-真菌共现网络主要模块中细菌和真菌的累计丰度后,使用SPSS 26.0软件对模块累计丰度进行标准化,使用Z分数表示模块相对丰度。使用一元线性回归模型分析细菌-真菌共现网络中主要模块的相对丰度与小麦籽粒产量的关系。计算模块差异优势属相对丰度和土壤理化性质与小麦籽粒产量的皮尔森(Pearson)相关系数(P < 0.05)后,使用Cytoscape 3.9.1软件绘制相关关系图。其余统计分析采用Microsoft Excel 2019、R 4.2.2和Origin 2021软件进行数据处理和绘图。
2 结果 2.1 不同施肥处理土壤理化性质由表 1可见,与N0S0处理相比,NS0处理的AK和DOC含量显著升高(P < 0.05,下同),分别增加39.68%和34.57%,NS0处理的AHN、AP、AK、DON、DOC和MBC含量显著升高,增幅为16.60%~136.52%,NS和NSM处理的EC、SOC、AHN、AP、AK、DON、MBN、DOC、MBC、POC和ROC含量显著升高,增幅分别为40.07%~423.22%和42.35%~463.83%。N0S、NS0、NS和NSM处理的pH相较N0S0处理显著降低,降幅为0.98%~8.04%。
|
|
表 1 不同施肥处理土壤理化性质 Table 1 Soil physicochemical properties relative to treatments |
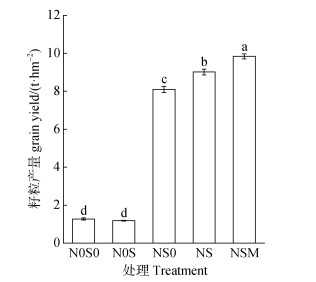
N0S0处理籽粒产量为1.27 t·hm–2,与N0S0处理相比,NS0、NS和NSM处理籽粒产量显著升高,分别增加6.83、7.75和8.57 t·hm–2,而N0S处理籽粒产量与N0S0处理无显著差异(P > 0.05,图 1)。
|
注:图中误差线为标准误,不同小写字母表示不同处理间差异显著(P < 0.05)。 Note: The error lines in the bar chart are standard errors. Different letters indicate a significant difference between treatments(P < 0.05). 图 1 不同施肥处理小麦籽粒产量 Fig. 1 Grain yield of wheat relative to treatments |
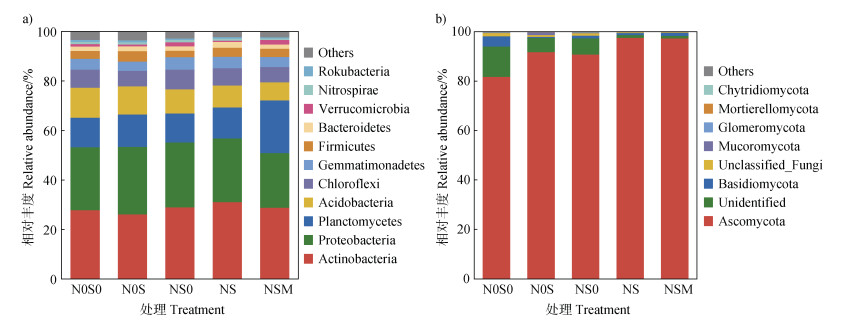
细菌高通量测序序列经过物种注释后归属于42个门、119个纲、286个目、481个科和953个属。各处理的细菌优势菌门均为放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、浮霉菌门(Planctomycetes)、酸杆菌门(Acidobacteria)和绿弯菌门(Chloroflexi),占细菌总丰度的84.29%~85.85%(图 2a)。方差分析结果表明,NS处理的放线菌门相对丰度显著高于其他处理;NSM处理的浮霉菌门相对丰度显著高于其他处理,而变形菌门相对丰度显著低于其他处理;N0S0处理的酸杆菌门相对丰度显著高于NS和NSM处理。
|
图 2 不同施肥处理对门水平土壤细菌(a)和真菌(b)群落组成影响 Fig. 2 Effects of different treatments on the relative abundance of the major soil bacteria(a)and the major fungi(b)at the phylum level |
真菌高通量测序序列经过物种注释后归属于9个门、21个纲、61个目、145个科和297个属。各处理的真菌优势菌门均为子囊菌门(Ascomycota),占真菌总丰度的81.89%~97.66%,其次为担子菌门(Basidiomycota),占真菌总丰度的0.42%~4.13%(图 2b)。方差分析结果表明,与N0S0处理相比,N0S、NS0、NS和NSM处理的子囊菌门相对丰度显著增加,分别增加12.17%、10.96%、19.27%和18.92%;担子菌门的相对丰度在各处理间差异未达到显著水平。
各处理间的细菌Chao1和Shannon指数均无显著性差异;各处理间的真菌Chao1指数无显著性差异,NS和NSM处理的真菌Shannon指数相较N0S0、N0S和NS0处理显著降低(表 2)。
|
|
表 2 不同施肥处理土壤微生物群落α多样性 Table 2 α diversity of soil microbial community relative to treatments |
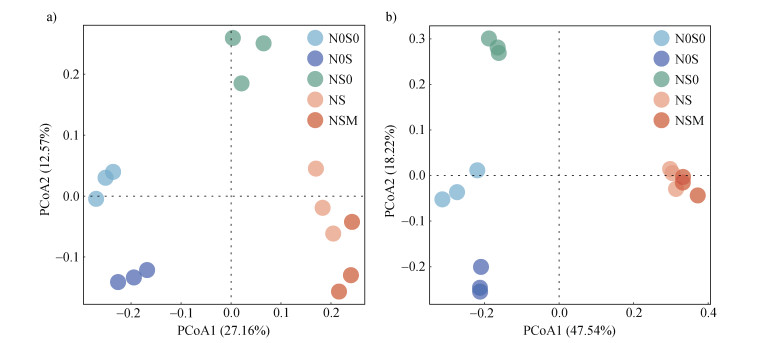
对各处理的细菌和真菌群落组成进行PCoA分析,主坐标的第一轴和第二轴分别解释了细菌群落结构27.16%和12.57%的总方差(图 3a);主坐标第一轴和第二轴分别解释了真菌群落结构47.54%和18.22%的总方差(图 3b)。5个处理的细菌和真菌群落均可分为N0S0+N0S、NS0以及NS+NSM三组,置换多元方差分析(PERMANOVA)表明,在细菌和真菌群落中,N0S0和N0S处理的群落组成相似,NS和NSM处理的群落组成相似,N0S0+N0S、NS0以及NS+NSM三组之间的群落组成两两差异显著。
|
图 3 不同施肥处理土壤细菌群落(a)和真菌群落(b)主坐标分析(PCoA) Fig. 3 Principal coordinate analysis(PCoA)of soil bacterial communities(a)and soil fungal communities(b)under different treatments |
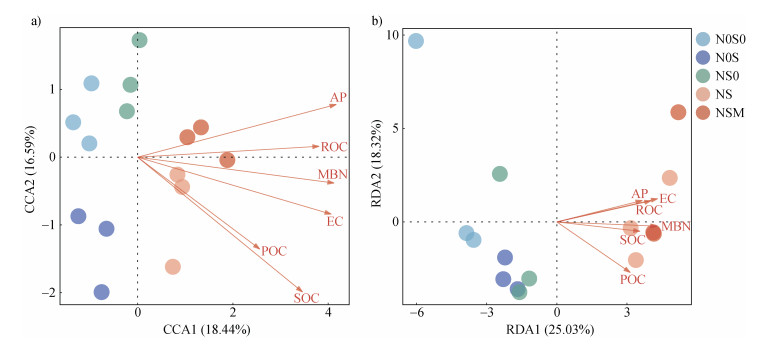
对不同处理的细菌群落组成与土壤理化性质进行CCA分析(图 4a),真菌群落组成与土壤理化性质进行RDA分析(图 4b),并基于蒙特卡洛置换检验(表 3)表明,将重要性从高到低排序,AP、EC、MBN、SOC、ROC和POC是导致不同处理细菌群落结构变化的主要土壤理化性质,EC、MBN、ROC、POC、AP和SOC是导致不同处理真菌群落结构变化的主要土壤理化性质。
|
注:(a)土壤细菌群落组成和理化性质的典范对应分析(CCA);(b)土壤真菌群落组成和理化性质的冗余分析(RDA)。 Note: (a)Canonical correspondence analysis(CCA)of soil bacterial community composition and physicochemical properties; (b)Redundancy analysis(RDA)of soil fungal community composition and physicochemical properties. 图 4 不同施肥处理土壤细菌(a)和真菌(b)群落组成与土壤理化性质的关系 Fig. 4 Relationship between soil bacterial(a)and fungal(b)community composition and soil physicochemical properties relative to treatments |
|
|
表 3 不同施肥处理土壤性质对细菌和真菌群落结构的影响 Table 3 Effects of soil properties on soil bacterial and fungal community structure relative to treatments |
图 5a所示,利用斯皮尔曼相关关系构建细菌-真菌共现网络,网络中细菌种类占56.36%,真菌种类占43.64%。网络相关关系中,61.12%为正相关关系,38.88%为负相关关系,表明微生物之间的协同作用高于竞争作用。网络主要分为4个较大的模块,模块1中,N0S0和N0S处理的相对丰度显著高于NS0、NS和NSM处理;模块4中,NS和NSM处理的相对丰度显著高于N0S0、N0S和NS0处理;模块2和模块3则表现为NS0处理的相对丰度显著高于其他处理(图 5b)。
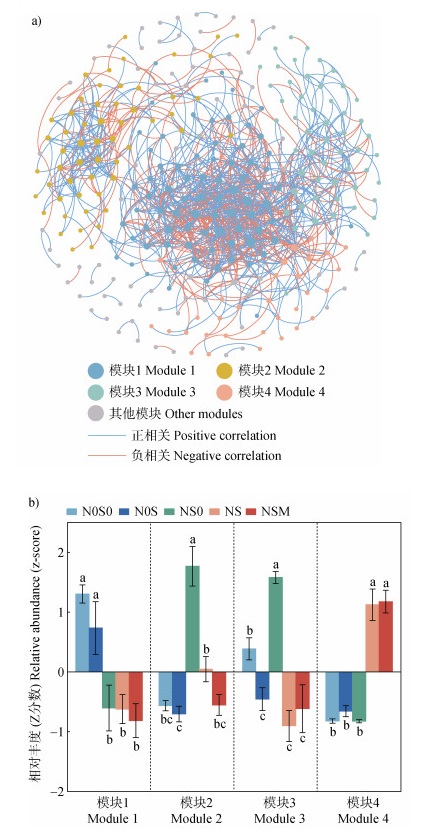
|
注:网络中的OTUs相对丰度高于总丰度的0.05%,且OTUs间具有强相关性(Spearman相关系数值(r)≥ 0.7,校正后的P < 0.01)。蓝线表示正相关关系,红线表示负相关关系,线条越粗表示Spearman相关系数值(r)越大,节点的大小按度(即与该节点连接的边的数量的多少)的大小赋值,连接的边越多,节点越大。 Note: The relative abundance of OTUs in the bacterial-fungal co-occurrence network was higher than 0.05% of the total relative abundance, and there was a strong correlation between OTUs(Spearman's r ≥ 0.7, FDR-adjusted P < 0.01). The blue line represents the positive correlation, while the red line represents the negative correlation. The thicker line indicates the larger Spearman correlation value(r), the size of the node is assigned according to the size of the degree(that is, the number of edges connected to the node), and the more connected edges, the larger the node. 图 5 细菌-真菌共现网络(a)及各模块相对丰度(b) Fig. 5 Co-occurrence networks of soil bacteria and fungi(a)and the relative abundance(z-score)of each module(b) |
线性回归分析表明,模块1相对丰度与籽粒产量呈显著负向线性关系,模块4相对丰度与籽粒产量呈显著正向线性关系(图 6),而模块2和模块3的相对丰度与小麦产量相关性不显著。因此,模块1和模块4为影响小麦产量的关键模块。
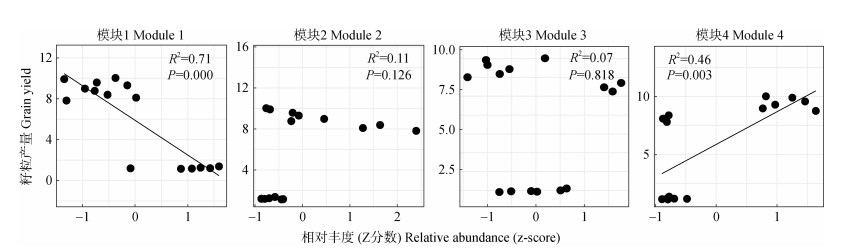
|
图 6 不同施肥处理模块相对丰度与小麦产量的回归分析 Fig. 6 Regression analysis of the relative abundance of each module and grain yield of wheat relative to treatments |
图 7所示,分别将模块1和模块4中相对丰度排名前15%的细菌和真菌视为优势属,模块1中细菌以RB41、芽球菌属(Blastococcus)、鞘氨醇单胞菌属(Sphingomonas)、芽孢杆菌属(Bacillus)、土微菌属(Pedomicrobium)、微枝形杆菌属(Microvirga)为主导,真菌以Dokmaia、葡萄穗霉属(Stachybotrys)、青霉属(Penicillium)、Fusicolla、无色穗孢属(Achroiostachys)为主导;模块4中细菌以类诺卡氏菌属(Nocardioides)、Pir4_lineage、类固醇杆菌属(Steroidobacter)、纤维单胞菌属(Cellulomonas)为主导,真菌以金孢子菌属(Chrysosporium)、无茎真菌属(Acaulium)、裂壳菌属(Schizothecium)为主导。
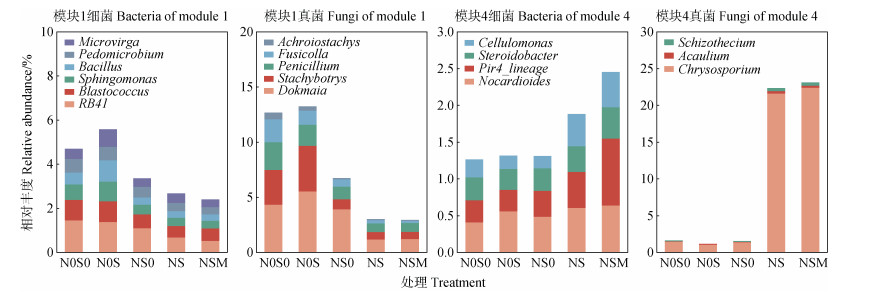
|
图 7 不同施肥处理模块优势属 Fig. 7 Dominant genus of each module relative to treatments |
方差分析结果表明,模块1优势细菌中,NS和NSM处理的RB41、芽球菌属(Blastococcus)、鞘氨醇单胞菌属(Sphingomonas)和芽孢杆菌属(Bacillus)相对丰度显著低于N0S0和NS0处理。模块1优势真菌中,NS和NSM处理的Dokmaia、葡萄穗霉属(Stachybotrys)和无色穗孢属(Achroiostachys)相对丰度显著低于N0S0和NS0处理,Fusicolla相对丰度显著低于N0S0处理。模块4优势细菌中,NS和NSM处理的类诺卡氏菌属(Nocardioides)相对丰度显著高于N0S0和NS0处理,纤维单胞菌属(Cellulomonas)相对丰度显著高于N0S0、N0S和NS0处理;NSM处理的类固醇杆菌属(Steroidobacter)相对丰度显著高于N0S处理,Pir4_lineage相对丰度显著高于其他4个处理。模块4优势真菌中,NS和NSM处理的真菌金孢子菌属(Chrysosporium)、无茎真菌属(Acaulium)和裂壳菌属(Schizothecium)相对丰度显著高于N0S0、N0S和NS0处理(图 7)。
2.5 模块差异优势属及土壤性质与产量的关系如图 8所示,聚焦于模块中相对丰度在各处理间存在差异的优势属,皮尔森相关性分析表明,模块1的差异优势属中,RB41、芽球菌属(Blastococcus)、鞘氨醇单胞菌属(Sphingomonas)、芽孢杆菌属(Bacillus)、土微菌属(Pedomicrobium)、微枝形杆菌属(Microvirga)、Dokmaia、葡萄穗霉属(Stachybotrys)、青霉属(Penicillium)、Fusicolla和无色穗孢属(Achroiostachys)与籽粒产量显著负相关。模块4的差异优势属中,类诺卡氏菌属(Nocardioides)、Pir4_lineage、纤维单胞菌属(Cellulomonas)、金孢子菌属(Chrysosporium)、无茎真菌属(Acaulium)和裂壳菌属(Schizothecium)与籽粒产量显著正相关。土壤性质中,EC、SOC、AHN、AP、AK、DON、MBN、DOC、MBC和ROC与籽粒产量显著正相关,pH与籽粒产量显著负相关。

|
注:蓝线表示显著正相关关系(P < 0.05),红线表示显著负相关关系。 Note: The blue line represents the positive correlation(P < 0.05), while the red line represents the negative correlation. 图 8 不同施肥处理模块差异优势属和土壤性质与小麦产量的相关性分析 Fig. 8 Correlation analysis among the relative abundance of bacterial and fungal dominant genera within modules, soil properties, and grain yield of wheat relative to treatments |
有机碳可分为活性有机碳和难降解有机碳,农田土壤活性有机碳包括DOC、MBC、POC和ROC等,可被作物吸收和利用,并且是土壤细菌和真菌生长的重要能量来源[3]。本研究中,NS和NSM处理的DOC、MBC和ROC含量相较N0S和NS0处理显著升高(表 1),这可能由于秸秆和鸡粪的施入提供了包含多种土壤碳组分的有机碳化合物,并增加了作物根系生物量及根系分泌物,使土壤中活性有机碳组分含量增加[7]。此外,秸秆和鸡粪分解过程中释放的大量营养物质,增加了微生物生长所需的养分供应,促进了微生物的活动,微生物将秸秆和粪肥中的碳转化为了不稳定形式的有机碳[7]。Liu等[3]研究发现化肥配施秸秆可加速有机碳矿化和有机质分解,并释放活性有机碳成分,相较单施化肥显著提高了DOC、MBC、POC和ROC含量,与本研究结果相似。
本研究结果表明,NSM处理的DOC、ROC、AHN和AP含量相较NS处理显著提升(表 1)。这可能由于鸡粪本身含有丰富的有机碳,使有机碳活性组分得到提升,且鸡粪与化肥配施可起到减缓化肥中养分的释放和损失以及提高养分利用效率的作用[5,16],使AHN和AP等速效养分增加,Jin等[10]还发现在小麦季化肥配施鸡粪通过提高土壤磷酸酶活性,促进了土壤磷循环,从而显著提高了AP含量。
3.2 不同施肥处理对土壤微生物群落组成的影响酸杆菌门主要分解顽固性碳[17],本研究中,N0S0处理的酸杆菌门相对丰度显著高于NS和NSM处理(图 2a),这可能由于酸杆菌适应生存于养分受限制的土壤环境[4],Liu等[4]研究发现不施肥处理的酸杆菌门相对丰度相较单施化肥处理和化肥+牛粪处理分别提高2.16%和2.34%,与本研究结果相似。放线菌门具有生成水解酶及降解纤维素的能力,在难降解化合物的分解方面发挥着重要作用[18],本研究中,NS、NSM和NS0处理的放线菌门相对丰度高于N0S0和N0S处理(图 2a),这可能与放线菌适应生存于养分含量较高的土壤环境中有关[5]。子囊菌门主要降解秸秆中的木质素和纤维素等难降解物质[6],N0S、NS0、NS和NSM处理的子囊菌门相对丰度相较N0S0处理显著增加(图 2b),这可能由于化肥、秸秆和鸡粪的施入为子囊菌门的生长提供了营养物质。
微生物群落的丰富度和多样性对土壤功能具有重要影响,Chao1指数和Shannon指数分别反映微生物群落的丰富度和多样性,数值越大,丰富度和多样性越高[19]。本研究结果表明,不同施肥处理间的细菌Chao1和Shannon指数以及真菌Chao1指数无显著性差异,而NS和NSM处理相较N0S0、N0S和NS0处理显著降低了真菌Shannon指数(表 2),这可能由于化肥配施秸秆和/或鸡粪刺激了某些特定真菌的增殖,抑制了其他真菌的生长,Chernov和Semenov[20]指出秸秆的施入不一定会导致土壤微生物总类别的增加,但通常会刺激某些类别微生物的发育,例如腐生真菌。此外,施用有机物质还可能使一些微生物通过拮抗作用抑制病原真菌的生长,如通过合成抗生素、溶解酶和挥发性有机物以及通过寄生或直接竞争生态位来抑制或消除土壤中病原真菌的活性[8]。以往研究中,不同施肥方式对土壤微生物α多样性指数影响的结论尚不一致,例如Liu等[21]发现化肥+秸秆处理和化肥+牛粪处理的真菌Shannon指数与单施化肥处理相比无显著差异,与本研究结果不一致,Ma等[5]研究发现,化肥配施粪肥处理的细菌Shannon指数和真菌Chao1指数与单施氮磷钾化肥处理相比无显著差异,与本研究结果相似。
微生物对环境变化非常敏感,不同施肥方式可能通过影响土壤性质而改变微生物的生存环境,从而对其群落组成产生影响。细菌和真菌生长需要充足的碳源和氮源,本研究中,土壤SOC、ROC和POC含量的变化(图 4)可能影响了细菌和真菌生命活动所需碳源的获取。Sabir等[22]指出施用有机肥所增加的有机碳输入,是土壤中异养微生物的重要能量来源。Zhang等[7]比较了不施肥、单施化肥、化肥+秸秆和施用有机肥4个施肥处理的微生物群落结构,发现ROC是影响细菌群落的关键因素,DOC是影响土壤真菌群落的主要因素。MBN是土壤氮库中最活跃的组分之一[23],本研究中,土壤中MBN含量的变化(图 4)可能影响了细菌和真菌所需氮源的获取。单施秸秆使不稳定碳含量提高,利于微生物早期的快速生长,但随着秸秆的进一步降解,会使土壤碳氮比值增加,高碳氮比值可能导致土壤微生物与作物之间争夺氮,从而抑制一些微生物的生长[6],而化肥中氮的输入可提高土壤MBN含量,调节、降低土壤碳氮比值,为微生物的生存创造有利条件[3,6]。Jin等[10]也指出,氮肥的施用可以通过缓解氮限制而改变微生物群落结构。本研究结果表明,AP是影响细菌和真菌群落结构的重要土壤性质(图 4),这可能由于AP是微生物生长的养分来源之一,且AP可以促进作物生根,根系生长状况影响了土壤微生物群落组成[18]。此外,小麦在不同生长阶段的根系分泌物和养分吸收状况不同[24],可能会对微生物群落组成产生一定影响,本研究仅分析了小麦收获期的土壤微生物群落组成,具有一定局限性。
3.3 关键微生物对小麦产量的影响本研究中,模块4是与小麦籽粒产量显著正相关的关键模块,模块1是与小麦籽粒产量显著负相关的关键模块(图 6),模块4和模块1中的关键优势细菌和真菌的相对丰度在各施肥处理间存在差异(图 7)。
模块4的关键优势细菌中,类诺卡氏菌属(Nocardioides)和纤维单胞菌属(Cellulomonas)为纤维素降解菌(图 7),可有效降解秸秆,利于提高土壤中的有机质含量。Liu等[19]研究表明长期施用由鸡粪和秸秆制成的生物堆肥提高了类诺卡氏菌属(Nocardioides)的相对丰度,其可分泌放线菌素,拮抗土壤病原菌的生长;Abdulla和El-Shatoury[25]研究发现,类诺卡氏菌属(Nocardioides)能够在极低的营养条件下有效降解水稻秸秆;Fang等[26]发现类诺卡氏菌属(Nocardioides)还具有降解土壤中除草剂的作用。类固醇杆菌属(Steroidobacter)为有益微生物,可参与难降解有机化物的分解和土壤中碳、氮和磷的转化,从而促进作物生长[27]。Liu等[4]研究发现,化肥+牛粪处理中类固醇杆菌属(Steroidobacter)的相对丰度高于单施化肥处理,与本研究结果相似。刘正洋[28]研究表明,Pir4_lineage相对丰度的增加与有机肥的施用有关,并与作物产量呈显著正相关关系。
模块4的关键优势真菌中,金孢子菌属(Chrysosporium)为木质素降解菌(图 7)。Khatami等[29]研究发现,金孢子菌属(Chrysosporium)通过降解木质素衍生的芳香族分子并产生新的脂肪族分子,促进了腐殖质化进程,有利于土壤有机质的积累和储存;Liu等[19]指出金孢子菌属(Chrysosporium)对植物病原微生物有抑制作用;Shang等[30]还发现,金孢子菌属(Chrysosporium)能促进土壤中杀虫剂的降解。无茎真菌属(Acaulium)和裂壳菌属(Schizothecium)为纤维素降解菌,它们可促进木质素和纤维素转化为腐殖物质。He等[31]研究了秸秆+牛粪和锯木屑+牛粪等农林生物废弃物堆肥中的关键微生物,发现无茎真菌属(Acaulium)为堆肥中的优势属之一,可高效促进易利用总糖和纤维素的降解。Zhang等[32]研究表明,化肥配施秸秆富集了可加速秸秆降解的裂壳菌属(Schizothecium),并抑制了病原菌的生长,Liu等[3]也发现裂壳菌属(Schizothecium)可高效降解秸秆,其丰度随着秸秆的长期施用而增加。
模块1的关键优势真菌以植物病原菌居多(图 7),Fusicolla和无色穗孢属(Achroiostachys)均为土壤致病真菌,对作物生长具有不利影响,并降低作物产量[33]。马垒等[34]研究发现与单施化肥处理相比,化肥配施秸秆处理显著降低了病原菌Fusicolla的相对丰度;Zhai等[35]研究表明,施用有机物和细菌组成的肥料与不施肥处理相比,显著降低了不利于小麦生长的无色穗孢属(Achroiostachys)的相对丰度。葡萄穗霉属(Stachybotrys)中有少部分真菌可产生有益的次生代谢物质,但大部分真菌为植物致病菌,在土壤中普遍存在,同时也是室内污染真菌,易引起人类疾病,Srour等[36]研究表明作物枯萎病与土壤中的葡萄穗霉属(Stachybotrys)有关;Liu等[19]研究发现与不施肥处理相比,长期施用鸡粪和秸秆等制成的生物堆肥可有效降低有害微生物葡萄穗霉属(Stachybotrys)的相对丰度;Chen等[37]发现,在小麦-水稻轮作系统中,与不施肥处理相比,化肥配施猪粪处理显著降低了葡萄穗霉属(Stachybotrys)的相对丰度。
4 结论长期不同施肥模式显著影响小麦籽粒产量,在本试验条件下,常规施化肥+秸秆还田+鸡粪替代20%氮肥和常规施化肥+秸秆还田处理对小麦产量提升最大。施肥模式显著改变土壤理化性质及土壤细菌和真菌群落组成,将重要性由高到低排序,AP、EC、MBN、SOC、ROC和POC是导致不同处理细菌群落结构变化的主要土壤理化性质,EC、MBN、ROC、POC、AP和SOC是导致不同处理真菌群落结构变化的主要土壤理化性质。基于细菌-真菌共现网络发现,NS和NSM处理富集了具有降解纤维素和木质素、促进养分转化和循环或抑制病原菌生长等功能的细菌(类诺卡氏菌属(Nocardioides)、纤维单胞菌属(Cellulomonas)和Pir4_lineage)和真菌(金孢子菌属(Chrysosporium)、无茎真菌属(Acaulium)和裂壳菌属(Schizothecium)),同时降低了潜在致病真菌(Fusicolla、无色穗孢属(Achroiostachys)和葡萄穗霉属(Stachybotrys))的丰度。化肥配施秸秆或化肥配施秸秆和鸡粪导致的产量变化与这些处理刺激的微生物群落组成变化存在潜在相关关系。
| [1] |
Tao Y, Liu T, Wu J Y, et al. Effect of combined application of chicken manure and inorganic nitrogen fertilizer on yield and quality of cherry tomato[J]. Agronomy, 2022, 12(7): 1574. DOI:10.3390/agronomy12071574
(  0) 0) |
| [2] |
Yin H J, Zhao W Q, Li T, et al. Balancing straw returning and chemical fertilizers in China: Role of straw nutrient resources[J]. Renewable and Sustainable Energy Reviews, 2018, 81: 2695-2702. DOI:10.1016/j.rser.2017.06.076
(  0) 0) |
| [3] |
Liu B, Xia H, Jiang C C, et al. 14 year applications of chemical fertilizers and crop straw effects on soil labile organic carbon fractions, enzyme activities and microbial community in rice-wheat rotation of middle China[J]. Science of the Total Environment, 2022, 841: 156608. DOI:10.1016/j.scitotenv.2022.156608
(  0) 0) |
| [4] |
Liu Z P, Xie W Y, Yang Z X, et al. Effects of manure and chemical fertilizer on bacterial community structure and soil enzyme activities in North China[J]. Agronomy, 2021, 11(5): 1017. DOI:10.3390/agronomy11051017
(  0) 0) |
| [5] |
Ma T F, He X H, Chen S G, et al. Long-term organic–inorganic fertilization regimes alter bacterial and fungal communities and rice yields in paddy soil[J]. Frontiers in Microbiology, 2022, 13: 890712. DOI:10.3389/fmicb.2022.890712
(  0) 0) |
| [6] |
Cong P, Wang J, Li Y Y, et al. Changes in soil organic carbon and microbial community under varying straw incorporation strategies[J]. Soil and Tillage Research, 2020, 204: 104735. DOI:10.1016/j.still.2020.104735
(  0) 0) |
| [7] |
Zhang Z M, Yan J, Han X Z, et al. Labile organic carbon fractions drive soil microbial communities after long-term fertilization[J]. Global Ecology and Conservation, 2021, 32: e01867. DOI:10.1016/j.gecco.2021.e01867
(  0) 0) |
| [8] |
Das P P, Singh K R, Nagpure G, et al. Plant-soil-microbes: A tripartite interaction for nutrient acquisition and better plant growth for sustainable agricultural practices[J]. Environmental Research, 2022, 214: 113821. DOI:10.1016/j.envres.2022.113821
(  0) 0) |
| [9] |
Fan K K, Delgado-Baquerizo M, Guo X S, et al. Biodiversity of key-stone phylotypes determines crop production in a 4-decade fertilization experiment[J]. The ISME Journal, 2021, 15(2): 550-561. DOI:10.1038/s41396-020-00796-8
(  0) 0) |
| [10] |
Jin H Y, Zhang D Q, Yan Y Q, et al. Short-term application of chicken manure under different nitrogen rates alters structure and co-occurrence pattern but not diversity of soil microbial community in wheat field[J]. Frontiers in Microbiology, 2022, 13: 975571. DOI:10.3389/fmicb.2022.975571
(  0) 0) |
| [11] |
Zhou T T, Li D D, Qiu L L, et al. Coupling effects of straw and woody peat on rapidly increasing soil organic matter and crop yield under different application ratios (In Chinese)[J]. Acta Pedologica Sinica, 2023. DOI:10.11766/trxb202112030656 [周谈坛, 李丹丹, 邱丽丽, 等. 不同配施比例下秸秆和木本泥炭对快速提升土壤有机质和作物产量的耦合影响[J]. 土壤学报, 2023.]
(  0) 0) |
| [12] |
Qiu L L, Li D D, Zhang J B, et al. Effects of key-stone microbe based on Co-occurrence networks on wheat yield in the soils with straw returning (In Chinese)[J]. Acta Pedologica Sinica, 2023, 60(2): 491-502. DOI:10.11766/trxb202107200372 [邱丽丽, 李丹丹, 张佳宝, 等. 基于共现网络的关键微生物对秸秆还田土壤小麦产量的影响[J]. 土壤学报, 2023, 60(2): 491-502.]
(  0) 0) |
| [13] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [14] |
Lefroy R D B, Blair G J, Strong W M. Changes in soil organic matter with cropping as measured by organic carbon fractions and 13C natural isotope abundance[J]. Plant and Soil, 1993, 155(1): 399-402.
(  0) 0) |
| [15] |
Cambardella C A, Elliott E T. Particulate soil organic-matter changes across a grassland cultivation sequence[J]. Soil Science Society of America Journal, 1992, 56(3): 777-783. DOI:10.2136/sssaj1992.03615995005600030017x
(  0) 0) |
| [16] |
Ren G D, Zhang M, Zhang W Y, et al. Effects of organic materials from different sources on growth and quality of vegetable broad beans and properties of rhizosphere soil (In Chinese)[J]. Soils, 2022, 54(4): 740-749. [任改弟, 张苗, 张文越, 等. 不同来源有机物料对菜用蚕豆生长和品质及根际土壤性状的影响[J]. 土壤, 2022, 54(4): 740-749.]
(  0) 0) |
| [17] |
Han Y L, Ma W, Zhou B Y, et al. Effects of straw-return method for the maize-rice rotation system on soil properties and crop yields[J]. Agronomy, 2020, 10(4): 461. DOI:10.3390/agronomy10040461
(  0) 0) |
| [18] |
Wang X Y, Duan Y, Zhang J, et al. Response of potato yield, soil chemical and microbial properties to different rotation sequences of green manure-potato cropping in North China[J]. Soil & Tillage Research, 2022, 217: 105273.
(  0) 0) |
| [19] |
Liu X Y, Shi Y, Kong L Y, et al. Long-term application of bio-compost increased soil microbial community diversity and altered its composition and network[J]. Microorganisms, 2022, 10(2): 462. DOI:10.3390/microorganisms10020462
(  0) 0) |
| [20] |
Chernov T I, Semenov M V. Management of soil microbial communities: Opportunities and prospects(a review)[J]. Eurasian Soil Science, 2021, 54(12): 1888-1902. DOI:10.1134/S1064229321120024
(  0) 0) |
| [21] |
Liu H Y, Xu W, Li J Y, et al. Short-term effect of manure and straw application on bacterial and fungal community compositions and abundances in an acidic paddy soil[J]. Journal of Soils and Sediments, 2021, 21(9): 3057-3071. DOI:10.1007/s11368-021-03005-x
(  0) 0) |
| [22] |
Sabir M S, Shahzadi F, Ali F, et al. Comparative effect of fertilization practices on soil microbial diversity and activity: An overview[J]. Current Microbiology, 2021, 78(10): 3644-3655. DOI:10.1007/s00284-021-02634-2
(  0) 0) |
| [23] |
Zhao Y, Zhou F, Luo J L, et al. Effects of rice straw returning combined with fertilizer application on yield and nitrogen utilization of wheat (In Chinese)[J]. Soils, 2021, 53(5): 937-944. [赵颖, 周枫, 罗佳琳, 等. 水稻秸秆还田配施肥料对小麦产量和氮素利用的影响[J]. 土壤, 2021, 53(5): 937-944.]
(  0) 0) |
| [24] |
Guo Z B, Wan S X, Hua K K, et al. Fertilization regime has a greater effect on soil microbial community structure than crop rotation and growth stage in an agroecosystem[J]. Applied Soil Ecology, 2020, 149: 103510. DOI:10.1016/j.apsoil.2020.103510
(  0) 0) |
| [25] |
Abdulla H M, El-Shatoury S A. Actinomycetes in rice straw decomposition[J]. Waste Management, 2007, 27(6): 850-853. DOI:10.1016/j.wasman.2006.06.006
(  0) 0) |
| [26] |
Fang H, Lian J J, Wang H F, et al. Exploring bacterial community structure and function associated with atrazine biodegradation in repeatedly treated soils[J]. Journal of Hazardous Materials, 2015, 286: 457-465. DOI:10.1016/j.jhazmat.2015.01.006
(  0) 0) |
| [27] |
Gu Y F, Wang Y Y, Lu S E, et al. Long-term fertilization structures bacterial and archaeal communities along soil depth gradient in a paddy soil[J]. Frontiers in microbiology, 2017, 8: 1516. DOI:10.3389/fmicb.2017.01516
(  0) 0) |
| [28] |
Liu Z Y. Effects of Trichoderma bio-organic fertilizer application on yield and soil microflora in Chinese-cabbage and wild-cabbage rotation system[D]. Nanjing: Nanjing Agricultural University, 2020.[刘正洋. 木霉生物有机肥对白菜-甘蓝轮作体系作物产量及土壤微生物区系的影响[D]. 南京: 南京农业大学, 2020.]
(  0) 0) |
| [29] |
Khatami S, Deng Y, Tien M, et al. Lignin contribution to aliphatic constituents of humic acids through fungal degradation[J]. Journal of Environmental Quality, 2019, 48(6): 1565-1570. DOI:10.2134/jeq2019.01.0034
(  0) 0) |
| [30] |
Shang C, Chen A W, Cao R Y, et al. Response of microbial community to the remediation of neonicotinoid insecticide imidacloprid contaminated wetland soil by Phanerochaete chrysosporium[J]. Chemosphere, 2023, 311: 136975. DOI:10.1016/j.chemosphere.2022.136975
(  0) 0) |
| [31] |
He Y, Liu D, He X H, et al. Characteristics of bacterial and fungal communities and their impact during cow manure and agroforestry biowaste co-composting[J]. Journal of Environmental Management, 2022, 324: 116377. DOI:10.1016/j.jenvman.2022.116377
(  0) 0) |
| [32] |
Zhang X M, Li J L, Liang B. Soil fungal community structure changes in response to different long-term fertilization treatments in a greenhouse tomato monocropping system[J]. Phyton-International Journal of Experimental Botany, 2021, 90(4): 1233-1246.
(  0) 0) |
| [33] |
Zhang J L, Liu Q W, Li K, et al. Peanut root exudates suppress Fusarium solani and modulate the microbial community structure of rhizosphere in grape replant soil[J]. Horticulturae, 2022, 8(10): 892. DOI:10.3390/horticulturae8100892
(  0) 0) |
| [34] |
Ma L, Li Y, Wei J L, et al. Effects of long-term straw returning on fungal community, enzyme activity and wheat yield in fluvo-aquic soil (In Chinese)[J]. Environmental Science, 2022, 43(10): 4755-4764. [马垒, 李燕, 魏建林, 等. 长期秸秆还田对潮土真菌群落、酶活性和小麦产量的影响[J]. 环境科学, 2022, 43(10): 4755-4764.]
(  0) 0) |
| [35] |
Zhai F H, Li T L, Qin X R, et al. Effect of fertilisation on fungal community in topsoil of winter wheat field[J]. Plant, Soil and Environment, 2022, 68(7): 317-327. DOI:10.17221/117/2022-PSE
(  0) 0) |
| [36] |
Srour A Y, Gibson D J, Leandro L F S, et al. Unraveling microbial and edaphic factors affecting the development of sudden death syndrome in soybean[J]. Phytobiomes Journal, 2017, 1(2): 91-101. DOI:10.1094/PBIOMES-02-17-0009-R
(  0) 0) |
| [37] |
Chen J, Guo Q K, Liu D H, et al. Composition, predicted functions, and co-occurrence networks of fungal and bacterial communities_ Links to soil organic carbon under long-term fertilization in a rice-wheat cropping system[J]. European Journal of Soil Biology, 2020, 100: 103226. DOI:10.1016/j.ejsobi.2020.103226
(  0) 0) |
 2024, Vol. 61
2024, Vol. 61


