2. 中国矿业大学环境与测绘学院, 江苏徐州 221116;
3. 南京大学地理与海洋科学学院, 南京 210023
2. School of Environment and Spatial Informatics, China University of Mining and Technology, Xuzhou, Jiangsu 221116, China;
3. School of Geography and Ocean Science, Nanjing University, Nanjing 210023, China
东部平原煤矿多采用长壁式井工开采,易产生地表塌陷,一般沉陷深度为2~3 m,最大深度可达20 m以上。不均匀沉陷不仅严重威胁建筑物、构筑物安全,还损害上覆农田质量和生态安全。东部平原地下潜水位高、地质环境复杂、降水相对丰富,沉陷区极易积水成塘[1]。采煤沉陷改变了区域水系及循环,导致工矿废水、生活污水和农业下泄废水直排入洼地,造成水体污染和富营养化[2]。同时,东部平原又多为我国重要的粮食主产区,煤粮叠合占比达40.0%。未来东部平原高潜水位煤矿仍持续开采,最终形成的沉陷区将达31 800 km2,积水面积超过19 100 km2[3]。如此大范围沉陷势必影响农田物质循环和水土平衡,威胁粮食安全和生态安全。因此,东部平原矿区控制采动损害、加大土地复垦力度已势在必行。
耕地保护乃重中之重,东部平原矿区复垦的主要任务为恢复耕作[4]。目前多采用表土剥离—固废充填—表土回填—上覆压实—重构土壤的复垦工艺[5]。少数采用挖深垫浅的非充填工艺或挖深垫浅与固废充填相结合的复垦工艺,故而矿区复垦土壤常呈现出保水差、结构散、质地砂和肥力低等特点,严重限制农田利用方式和作物产量[1]。为此,科学培肥复垦土壤、提升质量不可或缺。土壤微生物对促进养分循环、物质分解和植物生长等起着关键作用[6],并且能够敏锐地改变自身结构与组成去适应外界环境的变化[7-8]。因此,监测和评估复垦土壤微生物群落特征变化,对理解复垦土壤多功能性及其变化十分有益。
当前,土壤微生物多样性与土壤多功能性之间互作关系已成为研究热点[9-10]。先前研究表明微生物多样性能够显著提升土壤系统对多种生态功能的支持能力,一些原位调查研究和控制实验结果表明土壤微生物多样性与生态功能之间存在显著正相关关系[11],但亦有研究表明二者不相关,甚至负相关[12]。因此,围绕土壤微生物多样性与生态功能之间互作关系的争议不断,主要原因是初期研究多侧重于单一生态功能与微生物多样性中物种数目间的关系,忽视了微生物种群间复杂的相互关系对生态功能维持的重要作用[13-14]。土壤微生物通过协同、竞争及拮抗等一系列直接和间接作用相互关联形成复杂多样化的网络关系,并为能量流动、物质循环和信息传递等基本功能的实现奠定基础[15]。事实上,微生物群落间复杂的相互作用关系在土壤功能维持中的作用可能较微生物群落本身物种多样性更大[16-17]。先前对矿区复垦土壤的研究关注点多在土壤物理化学和生物指标以及微生物群落多样性和组成方面[2,18-19],而对不同复垦年限下土壤微生物共现网络模式或结构特征及与土壤多功能性之间的互作关系缺乏深入研究。
土壤养分循环、物质代谢、持水净水、固碳等多种功能对复垦土地生产力至关重要,复垦土壤微生物区系发育可直接影响上述功能的形成和恢复,故可以借助分子生态网络技术构建复垦土壤微生物的共现网络[20],刻画微生物物种多样性无法表达的生态联系和生态过程[21-22],揭示土壤微生物群落与土壤多功能性之间互作关系。为此,本文从山东省邹城市东滩矿区4个不同时间复垦区和1个对照样地采集了75个表层土样,测定了有机碳等18个土壤物理化学生物指标。本研究具体目标如下:(1)厘清不同复垦年限下土壤微生物多样性与土壤多功能性变化特征;(2)探究复垦土壤多功能性的驱动因子;(3)揭示土壤多功能性变化的微生物学机制,为科学评估矿区复垦土壤微生物区系发育和采矿扰动土壤功能恢复提供新见解。
1 材料与方法 1.1 研究区概况本研究选择山东省邹城市东滩矿采煤沉陷复垦区(35°25'52''N、116°52'39''E)为研究对象(图 1),该区属暖温带季风气候,年均气温14.1℃,年均降水752.9 mm。地势平坦,海拔为45.2±1.0 m,土壤类型为黄潮土,土壤容重为1.48 g·cm–3,砂粒、粉粒和黏粒质量百分含量分别为22.33%、65.87% 和11.80%。2001—2011年采用表土剥离+矸石充填(200~400 cm)+表土回填(60~80 cm)+二次机械压实工艺分4次对采煤沉陷区开展土地复垦,每一次复垦采用的工艺和客土来源完全相同,复垦方向为耕地,每个地块大小约为2.0 hm2,复垦后由矿业集团农业开发公司统一实施种植,小麦大豆轮作,一年两熟。小麦单季施用600.0 kg·hm–2常规复合肥作为底肥,拨节时追施氮肥150.0 kg·hm–2,收割留茬约高20 cm。大豆单季施用450.0 kg·hm–2常规复合肥作为底肥,收获时机械粉碎全还田。研究区除复垦年限不同外,成土母质、地形条件、气候水文、种植方式和施肥管理等基本一致。
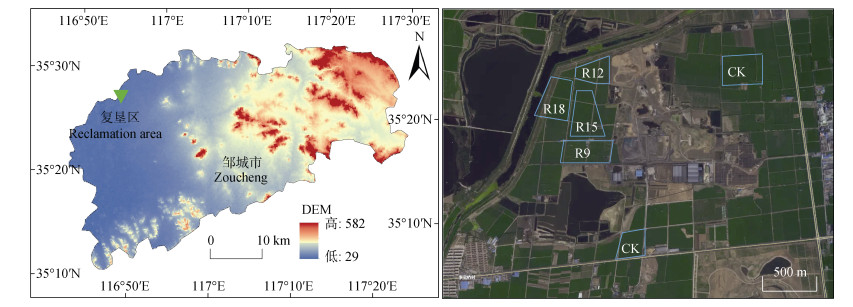
|
图 1 研究区及采样点分布示意图 Fig. 1 Location map of study area and sampling sites |
2020年8月21-22日,从同一地块中采用五点采样法,采集0~20 cm表层土样。复垦9年、12年、15年、18年4个复垦处理和一个对照分别记为R9、R12、R15、R18和CK,每个组设15个重复,总共75个土样。采集后剔除植物根系、残体和矸石等杂物,充分混合后分成两份。采用无菌聚乙烯袋密封包装,保存于车载冰箱迅速运回实验室处理。一份室内风干,研磨过2 mm筛,测定理化性质和部分酶活性;另一份新鲜土样直接提取微生物总DNA,用于高通量测序。
土壤pH采用电位法(水:土=2.5︰1)(DDS-307A,上海雷磁),土壤体积含水率(SWC)和电导率(EC)采用一体检测仪测定(TR-8D,北京顺科达),易氧化有机碳(EOC)含量采用高锰酸钾氧化法测定,全氮(TN)采用半微量凯氏定氮法测定,铵态氮(AN)采用氯化钾浸提—紫外分光光度法测定,硝态氮(NN)采用氯化钙浸提—比色法测定,有效磷(AP)采用碳酸氢钠浸提—钼锑抗比色法测定,土壤有机碳(SOC)采用重铬酸钾—比色法[23]测定。FDA水解酶、多酚氧化酶(PPO)、过氧化氢酶(CAT)、碱性磷酸酶(AKP)、脲酶(URE)、β-葡萄糖苷酶(BG)、脱氢酶(DHA)、蛋白酶(PRO)和亮氨酸氨基肽酶(LAP)采用活性试剂盒(索莱宝生物科技,北京)可见分光光度计测定[24]。
1.3 土壤微生物测定分析方法根据FastDNA™ SPIN Kit for Soil(MP Biomedicals公司,美国)试剂盒说明书分别提取75个新鲜土壤样品的DNA,使用NanoDrop one测量DNA浓度和纯度。然后对土壤细菌16S rRNA的V4、V5区进行PCR扩增,引物为515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和907R(CCGTCAATTCMTTTRAGTTT);使用ITS5F(5′-GGATGTAGGTCTTAATAAGG-3′)和ITS1R(GCTTCGTTGTTCACGACGC)对真菌进行PCR扩增。再用2%琼脂糖凝胶电泳对土壤样品进行PCR扩增产物检测,采用E.Z.N.A. Gel Extraction Kit(Omega,美国)凝胶回收试剂盒对目标片段进行切胶回收。按照以上电泳初步定量结果,选取Quant-iT PicoGreen dsDNA Assay Kit荧光试剂,Microplate reader(BioTek,FLx800,美国)定量仪器,将PCR扩增回收产物进行荧光定量,对各样本按等比混合。利用Illumina公司(Illumina,美国)开发的TruSeq Nano DNA LT Library Prep Kit制备测序文库。将构建好的文库经过Qubit和Q-PCR定量,文库合格后使用HiSeq2500 PE2500(Illumina,美国)进行测序(美格基因,深圳)。
利用Trimmomatic软件对双端的Raw Reads数据分别进行质量过滤;FLASH软件对每对PE reads进行拼接,将成对的reads拼成一条序列;根据序列首尾两端的barcode和引物信息等,利用Mothur软件将序列分配到对应的样品中,得到有效拼接片段。利用usearch V10软件对所有样品的全部Clean Tags进行聚类,默认以97%的一致性将序列聚类成为OTU。在聚类的同时,用usearch剔除嵌合体和singleton序列,然后进行代表性序列物种注释。为减少样本间不同测序深度的影响,将OTU丰度数据抽平至最小样本序列深度,得到21 394个细菌OTU,3 312个真菌OTU。
1.4 土壤生态系统多功能性的量化本研究测定了18个指标来表征与土壤系统养分固存和利用、生物地球化学循环、微生物生产力等多个功能[25]。利用三种方法计算单个样本多功能性指数:(a)单功能性指数(Single function index,SFI):对所有单个功能指标分别标准化,数值大小代表功能强弱[26]。(b)平均多功能性指数(Averaging multifunctionality index,AMI):标准化后的单功能性指数和的均值[27]。(c)主坐标多功能性指数(Principal coordinate multifunctionality index,PMI):该指数通过从所有单一功能的主坐标分析中提取多个主轴来表征多功能的不同维度[11]。
在进行计算单功能性指数和平均土壤多功能性指数前,先将上述18个指标分别进行Z-score标准化,再使用R程序包“multifunc”分别计算。主坐标多功能性指数使用R程序包“vegan”基于Bray- Curtis距离提取前5个主轴表征多功能的不同维度,可有效防止某一个单功能的过度代表[11]。Z-score标准化计算公式如下:
| $ Z{\text{ - score = }}\frac{{F{\text{ - Mean}}F}}{{{\text{SDF}}}} $ | (1) |
式中,F表示实际测定值,MeanF代表平均测定值,SDF代表标准差。
1.5 微生物多样性分析、共现网络构建及网络复杂性提取利用R软件中使用“metacoder”建系统发育树,“vegan”及“picante”程序包计算每个样品的物种丰富度(Richness)及谱系发育多样性指数(PD whole tree)。使用物种丰富度作为土壤微生物多样性的指标,这是最广泛、最简单的生物多样性度量标准[28]。并对细菌和真菌的丰富度值进行标准化处理(式(2)),将标准化分数平均,综合土壤生物多样性特征,得到多元多样性指数。标准化公式如下:
| $ {\bf{STD}} = \frac{{X - {X_{\min}}}}{{{X_{\max}} - {X_{\min}}}} $ | (2) |
式中,STD为标准化变量,X、Xmin和Xmax分别为所有样本的目标变量、最小值和最大值。
为避免稀有OTUs之间存在假阳性,使用同一复垦年限样品中物种出现频率大于50%的OTUs构建网络。通过R软件中“psych”包计算OTU两两间Spearman秩相关系数(r),保留|r| > 0.08且P < 0.01(FDR矫正)的节点和边,利用“ggClusterNet”软件包构建共现网络。用R包“igraph”计算了它们的拓扑特征,包括节点和边的数量、平均度、聚类系数、平均路径长度、网络密度和介数中心性,再分别提取单个样本子网络拓扑特征;随后,对子网络拓扑特征进行主坐标分析(PcoA),以获得反映网络复杂性的指标。
1.6 数据处理与统计分析使用单因素方差分析(one-way ANOVA)检验不同年限下土壤多功能性、土壤微生物多样性的差异,数据检验采用最小显著差异法(LSD),显著性水平设定为P=0.05。使用R软件包“rfPermute”进行随机森林模型(RF)分析,确定多功能性的主要驱动因素,并使用均方误差的百分比表示估算变量的重要性。利用皮尔逊相关性分析明确微生物多样性和网络拓扑性质与多功能性之间相关关系。利用偏相关分析判断特定变量是否影响土壤多功能性及这种影响如何依赖于其他变量,若零阶和控制之间偏相关系数差异越大,说明被控制因素的影响越大。利用R软件包构建结构方程模型(SEM),判断微生物多样性和网络参数对土壤多功能性的影响,采用极大似然法对SEM模型参数进行估计。SEM模型分析数据采用R软件包中scale函数进行标准化,并通过皮尔逊相关性分析保证所有变量之间均存在显著性线性关系(P < 0.05),且不存在多重共性(r < 0.8)。模型拟合度符合以下条件:0.97≤CFI≤1.00;0.95≤GFI≤1.00;0≤χ2/df≤2;0.95≤NFI≤1.00;0≤ RMSEA≤0.05;且0.10 < P≤1.00。
2 结果 2.1 不同复垦年限下微生物多样性和土壤多功能性变化从图 2a可知,随复垦年限增加细菌丰富度持续上升,单因素方差分析显示R15时细菌丰富度增长率趋于平缓(P < 0.05)。真菌丰富度在R15前并无显著性变化,但R18较其他复垦时间显著增加了约11.3%(P < 0.05)(图 2b)。土壤微生物谱系发育多样性指数随复垦年限增加呈显著性上升,与R9相比,R12、R15和R18环比增加39.8%、9.5%和11.4%(P < 0.05),增长速度减缓,但R18时谱系发育多样性指数已与CK无显著性差异(图 2c)。从图 2d可知,土壤平均多功能性指数随复垦年限增加稳步上升,且R18时土壤平均多功能性指数已与CK持平。与R9相比,R18土壤平均多功能性指数增加了17.1%(P < 0.05)。此外,主坐标多功能性指数(第一轴)亦显示土壤多功能性呈现显著上升趋势(P < 0.001)(图 2e)。
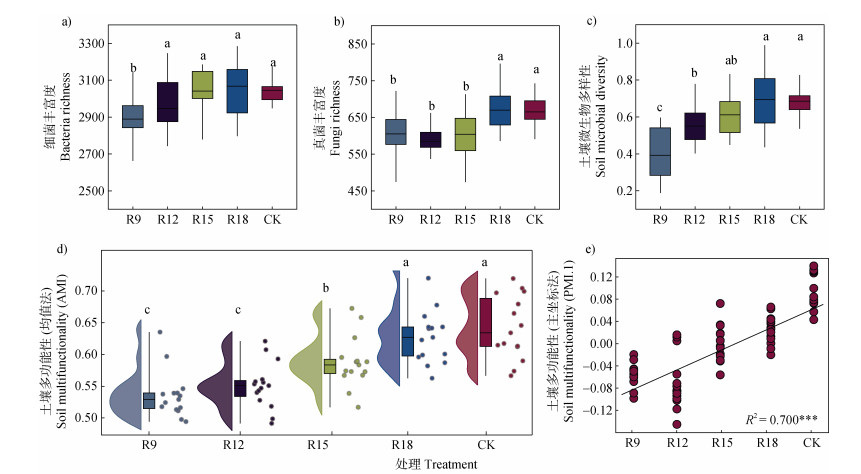
|
注:不同小写字母表示不同处理组间单因素方差分析检验存在显著性差异(P < 0.05)。下同。Note:Different capital letters indicate significant differences in one-way ANOVA tests between different treatment groups(P < 0.05). The same as below. 图 2 土壤微生物多样性和多功能性特征变化 Fig. 2 Characteristic changes in soil microbial diversity and soil multifunctionality |
对18个单功能性指数做主坐标分析,提取主坐标多功能性指数。将前两个轴所代表的指数(PMI.1和PMI.2)与土壤平均多功能性指数作普通最小二乘法线性回归分析(图 3a、图 3b),PMI.1和PMI.2主坐标多功能性指数与平均土壤多功能性指数高度正相关(R2=0.744,P < 0.001;R2=0.090,P < 0.01)。前5轴主坐标多功能性指数与单个功能性指数作皮尔森相关分析显示(图 3c),第一轴所代表的指数与单个功能指数之间几乎全部呈显著相关关系(P < 0.05),除了SWC和PPO。第二轴所代表的指数与单个功能指数之间有50%呈显著相关关系(P < 0.01),如TN和PPO等。因此,主坐标土壤多功能性指数完全可以表征土壤多功能性。
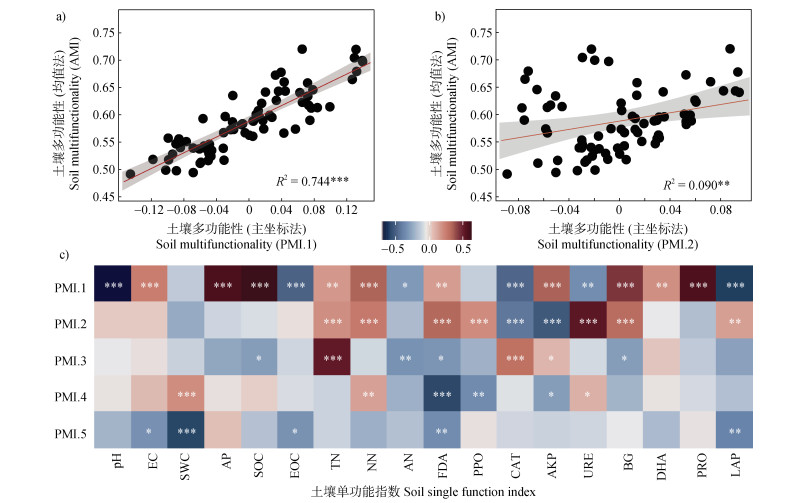
|
注:PMI.1~PMI.5分别表示主坐标法提取的前5个主轴数值,EC:电导率,SWC:土壤含水量,AP:有效磷,SOC:土壤有机碳,EOC:易氧化有机碳,TN:全氮,NN:硝态氮,AN:铵态氮,FDA;二乙酸酯水解酶,PPO;多酚氧化酶,CAT;过氧化氢酶,AKP;碱性磷酸酶,URE:脲酶,DHA:脱氢酶,PRO:蛋白酶,LAP:亮氨酸氨基肽酶。蓝色和红色分别表示两个变量间负相关和正相关关系。颜色越深,关系越紧密。*,**和*** 分别表示显著性水平为P < 0.05、P < 0.01和P < 0.001,下同。 Note: PCMI.1~PCMI.5 respectively represent the first 5 principal axis values extracted by the principal coordinate method; EC: electrical conductivity; SWC: soil water content; AP: available phosphorus; SOC: soil organic carbon; EOC: easily oxidized organic carbon; TN: total nitrogen; NN: nitrate nitrogen; AN: ammonium nitrogen; FDA: diacetate hydrolase. PPO: polyphenol oxidase; CAT: catalase; AKP: alkaline phosphatase; URE: urease; DHA: dehydrogenase; PRO: protease; LAP: leucine aminopeptidase. Blue and red indicate negative and positive correlations between the two variables, respectively. The deeper the color, the stronger the relationship. Significant results are indicated by * P < 0.05, ** P < 0.01, *** P < 0.001. The same as below. 图 3 多个土壤功能指标之间相关关系 Fig. 3 Correlation between multiple soil functional indicators |
线性回归和Spearman相关分析表明,细菌/真菌丰富度、谱系发育多样性指数与土壤平均多功能性指数和主坐标多功能性指数之间呈极显著正相关(P < 0.01),此外,谱系多样性与土壤主坐标多功能性指数之间也呈显著正相关(图 4a,图 4b)。细菌和真菌丰富度与土壤主坐标多功能性的线性回归分析,发现细菌和真菌多样性指数与土壤主坐标多功能性的回归方差系数(R2)较只考虑两者之一的回归方差系数更大,表明土壤微生物共同作用对土壤多功能性的功能效应更高(图 4a,图 4c)。
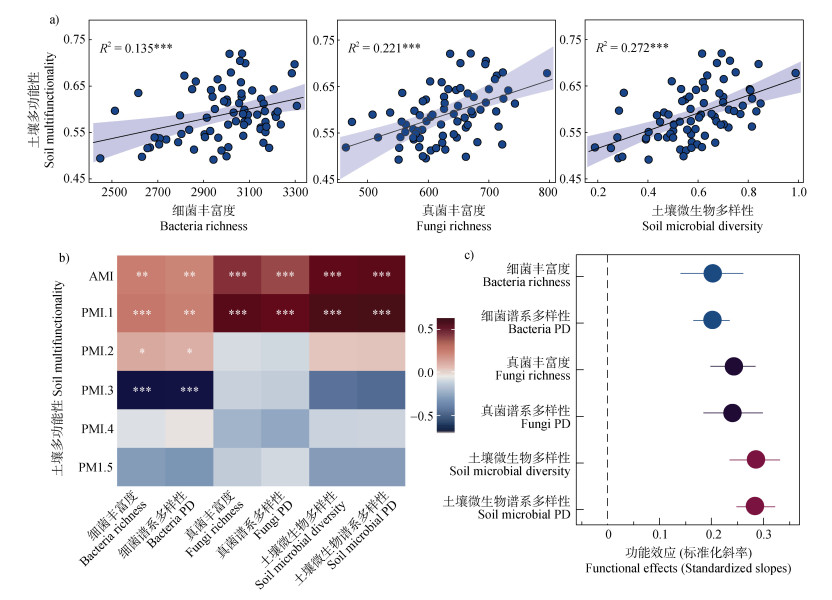
|
注:功能效应是微生物多样性与土壤多功能性的线性回归的标准化斜率。 Note: Functional effects are the standardized slope of linear regression between microbial diversity and soil multifunctionality. 图 4 微生物多样性与土壤多功能性的线性回归(a)、相关性热图(b)和微生物多样性对土壤多功能性的功能效应哑铃误差棒图(c) Fig. 4 Linear regression(a), correlation heat map(b), and Functional effects of microbial diversity on soil multifunctionality dumbbell error bar map(c) |
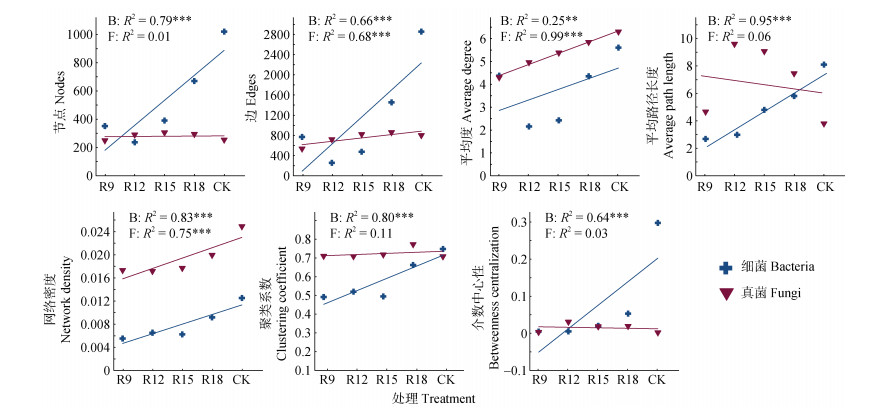
图 5显示,随着复垦年限增加,细菌群落共现网络中节点、边、平均度、平均路径长度、网络密度、聚类系数及介数中心性均呈显著性上升(P < 0.05)。随着复垦年限的增加,真菌群落共现网络中边、平均度、网络密度有明显上升,但节点、聚类系数和介数中心性无明显变化。
|
图 5 不同复垦年限下微生物共现网络拓扑属性 Fig. 5 Topological properties of microbial co-occurrence network under different reclamation years |
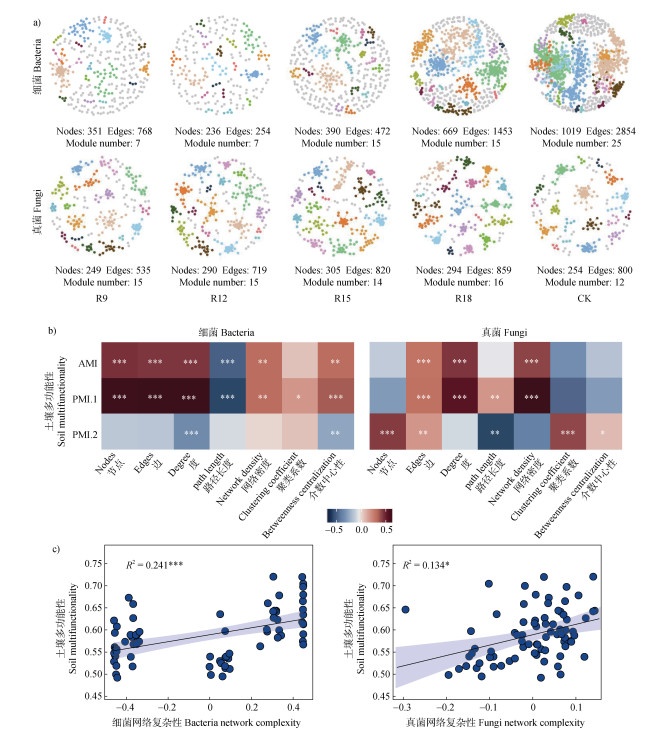
图 6a共现网络分析显示,细菌的CK网络结构远比复垦的更加复杂,模块数量亦是较多,复垦组R9、R12、R15和R18网络分别由351、236、390、669个OTU节点和768、254、472、1453条边构成,远低于CK(1019个节点和2854条边)。且细菌CK网络的模块数量为25,远高于所有复垦组的模块数量(7、7、15和15)。而真菌的CK网络结构没有复垦R15和R18的网络结构复杂,R15和R18网络分别由305、294个OTU节点和820、859条边构成,高于CK(254个节点和800条边)。此外,真菌CK模块数量为12,亦是低于复垦R9、R12、R15和R18的网络模块数量(15、15、14和16)。图 6b显示,Spearman分析中细菌子网络拓扑性质中节点、边、度、网络密度及介数中心性均与土壤平均、主坐标多功能性呈极显著正相关(P < 0.01),路径长度与土壤平均、主坐标多功能性呈极显著负相关(P < 0.001)。但真菌子网络拓扑性质中仅有边、度和网络密度与土壤均值和主坐标多功能性呈极显著正相关(P < 0. 01)。线性回归分析显示(图 6c),细菌网络复杂性与土壤多功能性呈极显著正相关(P < 0.001),真菌群落网络复杂性与土壤多功能性有显著相关性(P < 0.05)。
|
图 6 不同复垦时长下土壤微生物群落共现网络(a)、土壤多功能性与子网络拓扑性质的相关性热图(b)、土壤多功能性与微生物网络复杂性的线性回归(c) Fig. 6 Soil microbial community co-occurrence network(a), correlation heat map between soil multifunctionality and topological properties of subnetworks(b), linear regression between soil multifunctionality and microbial network complexity(c)under different reclamation duration |
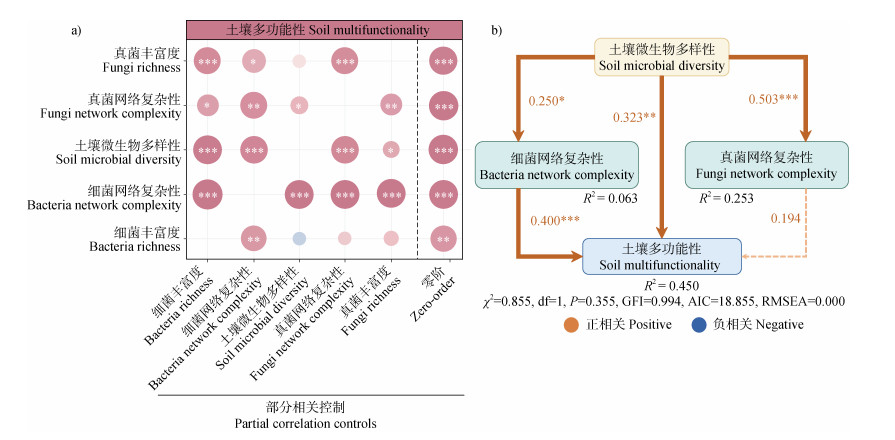
偏相关分析(图 7a)显示,细菌网络复杂性对土壤多功能性的影响显著且稳定,细菌网络复杂性与土壤多功能性之间相关关系几乎不受其他指标影响,但真菌网络复杂性与土壤多功能性之间相关关系受细菌丰富度、土壤微生物多样性和真菌丰富度影响,因素控制时相关系数分别下降18.27%、35.87%和29.15%。细菌丰富度对土壤多功能性的影响受其他指标的影响较大,控制条件下,与土壤微生物多样性、真菌网络复杂性和真菌丰富度相关系数下降148.28%、57.08%和46.35%。
|
注:(a)中,横轴表示被控制的因素和零阶(Zero-order,不控制任何因素),纵轴表示因素与土壤多功能性之间的相关性。圆圈的大小表示相关性的强度,圆圈的粉色和蓝色分别表示正相关和负相关。零阶因子和受控因子之间圆的大小和颜色的差异表明多功能性和被检查因子之间的相关性对受控变量的依赖程度(受控因子和零阶因子之间圆的大小和颜色没有变化=没有依赖;圆的大小和颜色强度的减少/增加=相关性的损失/增加)。(b)中,χ2表示卡方检验值,GFI代表拟合优度指数,AIC代表赤池信息量,RMSEA代表均方根误差逼近度,箭头上的数值代表标准通径系数,箭头粗细代表相关性高低,R2表示通径解释度。*、**、***分别表示显著性水平为P < 0.05、P < 0.01和P < 0.001。 Note: In Figure(a), the horizontal axis shows the factors controlled and the Zero-order(no factors controlled), and the vertical axis shows the correlation between the factors and soil multifunctionality. The size of the circle indicates the strength of the correlation, and the pink and blue of the circle indicate the positive and negative correlation, respectively. The difference in the size and color of the circle between the zero-order factor and the controlled factor indicates the degree to which the multifunctionality and correlation between the examined factors depend on the controlled variable(no change in the size and color of the circle between the controlled factor and the zero-order factor = no dependence; Decrease/increase in circle size and color intensity = loss/increase in correlation). In Figure(b), χ2 represents the Chi-square test value, GFI represents the goodness of fit index, AIC represents Akaike information volume, RMSEA represents the standard path coefficient on the root-mean-square error approximation arrow, arrow thickness represents the correlation level, and R2 presented above every response variable in the model denotes the proportion of variance explained. Significant results are indicated by * P < 0.05, ** P < 0.01, *** P < 0.001. 图 7 土壤多功能性和微生物因素之间的部分相关性(a)、土壤多功能性直接和间接影响的结构方程模型(b) Fig. 7 Partial correlations between soil multifunctionality and microbial factors(a), structural equation models of direct and indirect effects of soil multifunctionality(b) |
结构方程模型拟合(图 7b)显示,微生物多样性既可直接正向极显著调节土壤多功能性(通径系数为0.323,P < 0.01),也可显著正向影响细菌和真菌的网络复杂性(通径系数为0.250,P < 0.05;通径系数为0.503,P < 0.001),进而间接影响土壤多功能性,但仅细菌网络复杂性可极显著直接正向影响土壤多功能性(通径系数为0.400,P < 0.001)。
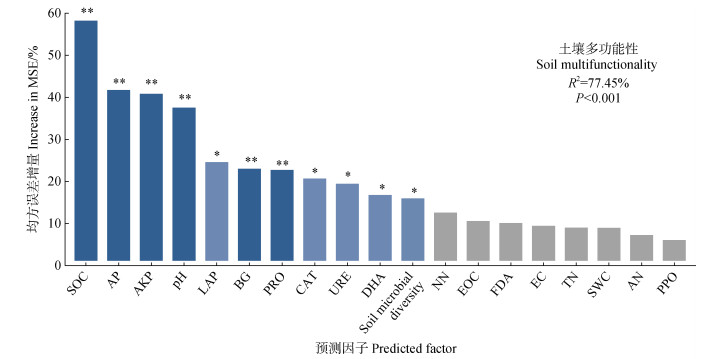
3 讨论 3.1 土壤微生物多样性及其多功能性对复垦年限的响应本研究结果表明,矿区土地复垦过程中土壤多功能性随复垦时长增加显著升高,复垦18年的土壤多功能性与对照无显著差异(图 2和图 3)。有研究表明,土壤多功能性受植被类型和微生物区系发育影响,植物根系分泌物与凋落物可作为底物在一定程度上缓解养分限制,随之分解产生代谢中间物或最终产物,同时根系的生长亦是可以发挥调节土壤孔隙的作用,为微生物生命活动,如生长和繁育提供更多营养和良好的环境条件,促进微生物多样性提高,进而提升土壤多功能性,这与本研究结果一致[29]。本文选择的研究区耕作制度完全一致,土壤多功能性变化主要归结于不同复垦年限差异导致的土壤微生物区系发育差异,随机森林的分析结果也验证了这一结论(图 8),除却SOC、pH和AP土壤理化参数,绝大多数生物因子,如土壤微生物多样性及AKP、LAP、BG和PRO等土壤酶活性是影响土壤多功能性的重要预测指标(P < 0.05)。
|
注:MSE代表均方误差增加的百分数,较高的MSE%值意味着更重要的预测因子。Note:MSE represents the percentage of increase of mean square error. A higher MSE% value implies a more important predictor. 图 8 基于随机森林模型预测环境因子对土壤平均多功能性的重要性 Fig. 8 Predicting the importance of environmental factors to soil average multifunctionality based on random forest models |
随着复垦年限的增加,植被凋落物、枯死根系及微生物等带来的残体碳不断输入,有效促进了SOC积累[30]。土壤pH主导着土壤微生物多样性和丰富度,影响土壤养分有效性[31]。本研究区地下潜水位按年周期变化,地下水可能会将下层充填煤矸石中金属阳离子带至表土,并与腐殖酸发生化学反应,从而影响复垦土壤多功能性。相关研究也证实SOC和pH是影响土壤多功能性的重要因素[16-17,32]。AP对土壤多功能性的影响可能与复垦区大豆种植有关,大豆对磷吸收是玉米、小麦的1.3倍~1.7倍[33],长期轮作显著增加对AP的需求。而且磷是微生物代谢所需的必要元素,一些土壤微生物可通过代谢产生酸性物质,然后溶解土壤中部分不溶性磷酸盐,作为自身代谢底物。随复垦年限增加,土壤胞外酶,如AKP、LAP、BG和PRO等,作为有机质降解、养分循环和外来生物分解的驱动力,会显著影响土壤养分有效性、积累和矿化。BG可在纤维素降解中催化末端反应参与土壤碳循环,LAP可从多肽N-端氨基酸水解亮氨酸和其他疏水氨基酸,PRO与URE等与土壤氮矿化和循环密切相关,AKP从磷酸糖和磷脂中水解磷酸,参与磷的代谢和转化,这些土壤酶全程参与土壤养分到能量的转变过程,故能深入影响土壤功能,是土壤多功能性的显著影响因子。
一般而言,农作物生长为微生物生存繁殖提供了理想场所,且凋落物和根系分泌物分解过程可有效提高土壤酶活性,促进微生物多样性恢复[34]。本研究表明,随着复垦年限增加,土壤养分提升,土壤生物多样性显著增加(图 2)。其中真菌丰富度恢复不如细菌,可能主要归结于真菌群落更稳定,对环境的适应性相对较差[35-36]。细菌和真菌对土壤生态系统功能的重要性主要取决于生态系统类型,如土壤细菌在调节农田和草地的土壤多功能性方面更为重要[37]。农作物作为禾本植物,对真菌和细菌群落恢复有着不同的调节作用,会优先给予细菌群落碳、氮、磷等营养元素的供应[38]。总体土壤微生物多样性随复垦时长增加显著上升,与先前研究的结果一致[39]。总之,矿区土地复垦活动改善了土壤部分理化性能,使其可耕作性增强,促进土壤微生物多样性和丰富度提高,土壤多功能性逐渐恢复,形成良性循环。
3.2 土壤微生物区系发育特征对土壤多功能性的影响近年来,生物多样性与生态系统功能之间的关系在地上和地下生态系统中得到了广泛的研究[40]。本研究表明,细菌和真菌丰富度与土壤平均和主坐标多功能性呈显著正相关(图 4)。在替换为谱系多样性或其他土壤多功能性指标时,两者之间也呈显著正相关,且同时考虑细菌和真菌的土壤生物多样性指标对土壤多功能性功能效应更高。随机森林分析表明土壤生物多样性是影响土壤多功能性的重要预测指标。上述结果表明,微生物多样性对于促进土壤多功能性具有重要作用。微生物多样性的控制试验结果表明多样性与生态功能间呈正相关关系,较高的多样性可为各种时空环境条件下功能的维持提供更大的保障[41-42]。Delgado-Baquerizo等[43]在对农田、草地和森林生态系统的研究中,发现土壤微生物多样性对土壤多功能性有正效应,但也有研究发现,土壤微生物系统多样性与土壤多功能性呈负相关,而诸如土壤温度等环境因素是造成结果差异的可能原因[44]。土壤生态系统具有环境异质性,故环境因子可能会影响土壤微生物群落和土壤生态系统功能,进而影响土壤微生物多样性与土壤生态功能间的关系。例如,某一环境因子可同时正向或负向影响微生物多样性和土壤生态功能,会导致两者出现正向关系,若对两者产生一个正向一个负向的影响则可能会导致两者出现负向关系,这取决于对微生物多样性和土壤生态功能哪一个影响更甚[45]。故不同环境因子对微生物多样性和土壤多功能的影响十分复杂,可能相互抵消或协同,从而掩盖了微生物多样性与土壤多功能性之间的真实关系。
微生物群落及其互作在土壤生态系统功能与服务的形成、维持等方面有重要的作用,不同微生物物种间的相互作用,协同驱动了土壤生态系统功能过程,因此微生物类群及网络结构对土壤生态系统会产生积极影响,利于土壤多功能性形成[46]。网络拓扑性质分析表明,细菌网络的节点、边、平均度、网络密度和介数中心性均与土壤平均和主坐标多功能性显著正相关,细菌网络的边、平均度和网络密度土壤平均和主坐标多功能性显著正相关(图 5和图 6)。细菌群落的网络复杂度亦是随复垦时间增加而提高,意味着细菌群落彼此间功能联系的增加,能够提高土壤生态系统能量流动及物质循环效率,进而对土壤多功能性产生正向影响。复杂的土壤微生物网络亦是常被认为利于生态系统功能维持,例如土壤养分循环和对环境干扰的耐受力。这可能是由于更复杂的网络协作在资源利用和信息传递方面提供了更多优势,以支持多种生态功能。在荒漠、草地生态系统及青藏高原的研究均揭示了微生物群落内部的相互作用对提高生态系统多功能性的重要性[10],如果土壤微生物群落组成简单化和复杂性降低,生态系统功能就会受到损害,且抑制作用会随时间的推移会越来越强[47]。
偏相关分析显示网络复杂性对土壤多功能性的显著而稳健的影响,细菌网络复杂性与土壤多功能性之间的相关性几乎不受其他土壤微生物指标的影响,而真菌网络复杂性与土壤多功能性之间的相关性受到真菌丰富度及土壤生物多样性等因素影响(图 7a)。结构方程模型进一步表明,土壤微生物多样性可通过网络结构正向影响土壤多功能性,也可直接正向影响土壤多功能性。微生物多样性增加可以提高微生物网络的复杂度,使得微生物间的生态联系更紧密,从而促进土壤多功能性提高。本研究结果亦显示,部分因素控制下,细菌网络复杂性对多功能性的影响要强于细菌丰富度、真菌丰富度和土壤微生物多样性(图 7a),这说明细菌网络复杂性可能较微生物多样性更好地预测和正向影响土壤多功能性。而微生物多样性可直接或间接通过促进网络复杂性维持土壤生态系统功能(图 7b),二者对土壤多功能性的影响效应较为复杂。与本文结果类似,有研究证实,土壤微生物共现网络复杂性在增强土壤多功能性方面较微生物多样性和群落组成发挥的作用更大[48]。细菌和真菌对土壤多功能性影响的差异性可能是因为二者的生理结构不同。相比于真菌群落,土壤细菌群落主要参与易降解底物的周转,易获得碳源等营养元素促进自身群落发育,虽其抗逆性可能较差,但恢复能力很强[49];而真菌倾向于分解难降解碳化合物(如纤维素和木质素),且多数菌根真菌选择树木根系作为其宿主。本研究区属于农田生态系统,限制了上述菌根真菌的生长发育,加上真菌孢子本身的传播扩散距离有限,从而影响真菌的群落结构,进而决定了其网络复杂性弱于细菌群落。例如,马静等[19]的研究表明当地土壤细菌的群落构建过程均以确定性过程中的同质性选择为主导,主要归结于东部平原地区高潜水特征和长期耕作管理实践及形成的特定农田土壤环境。因此,在这种特定环境下,真菌群落有着不同的生存效应。
4 结论鉴于微生物群落间的关联是生态系统物质循环、能量流动和信息传递等生态功能的基础,土壤养分有效性、营养元素循环等诸多生态过程亦是土壤微生物间相互作用和协同驱动的结果,微生物类群及网络结构对土壤生态系统产生积极影响,对土壤多功能性恢复有重要意义。本文构建了复垦土壤微生物网络结构,辅以统计学分析手段,考察微生物群落多样性、网络结构与土壤多功能性的互作关系。结果表明矿区采煤塌陷地复垦过程中,麦豆轮作促进了土壤多功能性显著增加,在复垦18年土壤多功能性可恢复至未扰动水平。随复垦年限增加,土壤微生物多样性显著上升。细菌和真菌丰富度均表现出上升趋势,且分别在复垦15年和18年达到正常耕地水平。微生物共现网络分析结果显示细菌群落共现网络中节点、边、平均度、平均路径长度、网络密度、聚类系数及介数中心性均随复垦时长增加而显著提高,且细菌和真菌子网络拓扑性质中边、度和网络密度均与土壤多功能性极显著正相关。细菌和真菌群落网络复杂性均与土壤多功能性显著相关,但细菌网络复杂性对土壤多功能性之间相关关系不受其他指标影响,真菌网络复杂性与土壤多功能性之间相关关系受细菌丰富度、土壤微生物多样性和真菌丰富度影响。微生物多样性可直接正向调节土壤多功能性,也可通过正向影响细菌和真菌的网络复杂性,进而间接操控土壤多功能性。
| [1] |
Chen F, Zhu Y F, Ma J, et al. Cooperative remediation mechanism and key technologies for pollution reduction and carbon sequestration in coal mining subsidence areas of the eastern plain (In Chinese)[J]. Journal of China Coal Society, 2023, 48(7): 2836-2849. [陈浮, 朱燕峰, 马静, 等. 东部平原采煤沉陷区降污固碳协同修复机制与关键技术[J]. 煤炭学报, 2023, 48(7): 2836-2849.]
(  0) 0) |
| [2] |
Dong W X, Ma J, He H, et al. Effects of land reclamation on soil microbial community structure and function in the Huang-Huai plain mining area (In Chinese)[J]. Coal Science and Technology, 2023, 51(11): 223-233. [董文雪, 马静, 何环, 等. 黄淮平原矿区土地复垦对微生物群落结构和功能的影响[J]. 煤炭科学技术, 2023, 51(11): 223-233.]
(  0) 0) |
| [3] |
Xiao W, Chen J L, Hu Z Q, et al. Feasibility analysis and practice of constructing plain reservoirs in high underground water mining subsidence area (In Chinese)[J]. Coal Science and Technology, 2017, 45(7): 184-189. [肖武, 陈佳乐, 胡振琪, 等. 高潜水位采煤沉陷地构建平原水库可行性分析与实践[J]. 煤炭科学技术, 2017, 45(7): 184-189.]
(  0) 0) |
| [4] |
Bian Z F, Lei S G, Jin D, et al. Several basic scientific issues related to mined land remediation (In Chinese)[J]. Journal of China Coal Society, 2018, 43(1): 190-197. [卞正富, 雷少刚, 金丹, 等. 矿区土地修复的几个基本问题[J]. 煤炭学报, 2018, 43(1): 190-197.]
(  0) 0) |
| [5] |
Bai Z K, Zhou W, Wang J M, et al. Rethink on ecosystem restoration and rehabilitation of mining areas (In Chinese)[J]. China Land Science, 2018, 32(11): 1-9. [白中科, 周伟, 王金满, 等. 再论矿区生态系统恢复重建[J]. 中国土地科学, 2018, 32(11): 1-9.]
(  0) 0) |
| [6] |
Coban O, De Deyn G B, van der Ploeg M. Soil microbiota as game-changers in restoration of degraded lands[J]. Science, 2022, 375(6584): abe0725. DOI:10.1126/science.abe0725
(  0) 0) |
| [7] |
Jiao S, Qi J J, Liu J A, et al. Soil microbiome and soil health assessment in arid regions (In Chinese)[J]. Acta Pedologica Sinica, 2023, 60(5): 1350-1362. [焦硕, 戚杰军, 刘纪爱, 等. 旱区土壤微生物组与土壤健康评价[J]. 土壤学报, 2023, 60(5): 1350-1362.]
(  0) 0) |
| [8] |
Yang Y, Guo Z Y, Pan K, et al. Farmland soil health assessment based on ecosystem multi-functionality (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(2): 461-475. [杨颖, 郭志英, 潘恺, 等. 基于生态系统多功能性的农田土壤健康评价[J]. 土壤学报, 2022, 59(2): 461-475.]
(  0) 0) |
| [9] |
Hu W G, Ran J Z, Dong L W, et al. Aridity-driven shift in biodiversity-soil multifunctionality relationships[J]. Nature Communications, 2021, 12(1): 5350. DOI:10.1038/s41467-021-25641-0
(  0) 0) |
| [10] |
Zhai C C, Han L L, Xiong C, et al. Soil microbial diversity and network complexity drive the ecosystem multifunctionality of temperate grasslands under changing precipitation[J]. Science of the Total Environment, 2024, 906: 167217. DOI:10.1016/j.scitotenv.2023.167217
(  0) 0) |
| [11] |
Manning P, van der Plas F, Soliveres S, et al. Redefining ecosystem multifunctionality[J]. Nature Ecology & Evolution, 2018, 2(3): 427-436.
(  0) 0) |
| [12] |
Zhou Z H, Wang C K, Luo Y Q. Meta-analysis of the impacts of global change factors on soil microbial diversity and functionality[J]. Nature Communications, 2020, 11(1): 3072. DOI:10.1038/s41467-020-16881-7
(  0) 0) |
| [13] |
Xiao Y Y, Feng W, Qiao Y G, et al. Effects of soil microbial community characteristics on soil multifunctionality in sand-fixation shrublands (In Chinese)[J]. Biodiversity Science, 2023, 31(4): 128-141. [肖媛媛, 冯薇, 乔艳桂, 等. 固沙灌木林地土壤微生物群落特征对土壤多功能性的影响[J]. 生物多样性, 2023, 31(4): 128-141.]
(  0) 0) |
| [14] |
Gamfeldt L, Roger F. Revisiting the biodiversity-ecosystem multifunctionality relationship[J]. Nature Ecology & Evolution, 2017, 1(7): 168.
(  0) 0) |
| [15] |
Wagg C, Schlaeppi K, Banerjee S, et al. Fungal-bacterial diversity and microbiome complexity predict ecosystem functioning[J]. Nature Communications, 2019, 10: 4841. DOI:10.1038/s41467-019-12798-y
(  0) 0) |
| [16] |
Jiao S, Lu Y H, Wei G H. Soil multitrophic network complexity enhances the link between biodiversity and multifunctionality in agricultural systems[J]. Global Change Biology, 2022, 28(1): 140-153. DOI:10.1111/gcb.15917
(  0) 0) |
| [17] |
Wang X, Zhang Q, Zhang Z J, et al. Decreased soil multifunctionality is associated with altered microbial network properties under precipitation reduction in a semiarid grassland[J]. iMeta, 2023, 2(2): e106. DOI:10.1002/imt2.106
(  0) 0) |
| [18] |
Ma J, Lu Y Q, Zhang Q, et al. Effects of coal mining subsidence on soil microbial community in the Loess Plateau (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(5): 1278-1288. [马静, 卢永强, 张琦, 等. 黄土高原采煤沉陷对土壤微生物群落的影响[J]. 土壤学报, 2021, 58(5): 1278-1288.]
(  0) 0) |
| [19] |
Ma J, Dong W X, Zhu Y F, et al. Characteristics and assembly process of reclaimed soil microbial communities in eastern plain mining areas (In Chinese)[J]. Environmental Science, 2022, 43(7): 3844-3853. [马静, 董文雪, 朱燕峰, 等. 东部平原矿区复垦土壤微生物群落特征及其组装过程[J]. 环境科学, 2022, 43(7): 3844-3853.]
(  0) 0) |
| [20] |
Wang C Y, Lou J, Yan K, et al. Analysis of soil microbial community structure via integrated high-throughput absolute abundance quantification(i HAAQ)method (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(5): 1432-1446. [王昌毅, 楼骏, 严康, 等. 基于整合高通量绝对定量法的土壤微生物多样性分析[J]. 土壤学报, 2022, 59(5): 1432-1446.]
(  0) 0) |
| [21] |
Chen F, Zhao J, Ma J, et al. Effects of vegetation restoration on functional groups related to soil carbon, nitrogen and phosphorus cycles in open-pit mining area of the Loess Plateau (In Chinese)[J]. Acta Pedologica Sinica, 2023, 60(5): 1507-1519. [陈浮, 赵姣, 马静, 等. 植被恢复对黄土高原露天矿区土壤碳氮磷功能微生物类群的影响[J]. 土壤学报, 2023, 60(5): 1507-1519.]
(  0) 0) |
| [22] |
Ramirez K S, Geisen S, Morriën E, et al. Network analyses can advance above-belowground ecology[J]. Trends in Plant Science, 2018, 23(9): 759-768. DOI:10.1016/j.tplants.2018.06.009
(  0) 0) |
| [23] |
Bao S D. Soil and agricultural chemistry analysis (In Chinese). 3rd ed[M]. Beijing: China Agriculture Press, 2000. [鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000.]
(  0) 0) |
| [24] |
Guan S Y. Soil enzyme and its research method (In Chinese). Beijing: Agricultural Press, 1986. [关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986.]
(  0) 0) |
| [25] |
Li X Z, Luo Y M, Hou D Y. The indicators, framework and procedures for soil health: A critical review (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(3): 617-624. [李烜桢, 骆永明, 侯德义. 土壤健康评估指标、框架及程序研究进展[J]. 土壤学报, 2022, 59(3): 617-624.]
(  0) 0) |
| [26] |
Byrnes J E K, Gamfeldt L, Isbell F, et al. Investigating the relationship between biodiversity and ecosystem multifunctionality: Challenges and solutions[J]. Methods in Ecology and Evolution, 2014, 5(2): 111-124. DOI:10.1111/2041-210X.12143
(  0) 0) |
| [27] |
Delgado-Baquerizo M, Giaramida L, Reich P B, et al. Lack of functional redundancy in the relationship between microbial diversity and ecosystem functioning[J]. Journal of Ecology, 2016, 104(4): 936-946. DOI:10.1111/1365-2745.12585
(  0) 0) |
| [28] |
Oliverio A M, Geisen S, Delgado-Baquerizo M, et al. The global-scale distributions of soil protists and their contributions to belowground systems[J]. Science Advances, 2020, 6(4): eaax8787. DOI:10.1126/sciadv.aax8787
(  0) 0) |
| [29] |
Li Z, Liu X W, Zhang M H, et al. Plant diversity and fungal richness regulate the changes in soil multifunctionality in a semi-arid grassland[J]. Biology, 2022, 11(6): 870. DOI:10.3390/biology11060870
(  0) 0) |
| [30] |
Xiao K Q, Zhao Y, Liang C, et al. Introducing the soil mineral carbon pump[J]. Nature Reviews Earth & Environment, 2023, 4: 135-136.
(  0) 0) |
| [31] |
Malik A A, Puissant J, Buckeridge K M, et al. Land use driven change in soil pH affects microbial carbon cycling processes[J]. Nature Communications, 2018, 9(1): 3591. DOI:10.1038/s41467-018-05980-1
(  0) 0) |
| [32] |
Qin Q Q, Zhang Y J, Qiu C, et al. Can litterfall input mitigate the adverse effects of high-severity wildfires on soil functions in temperate forest ecosystems?[J]. Soil Biology and Biochemistry, 2023, 184: 109119. DOI:10.1016/j.soilbio.2023.109119
(  0) 0) |
| [33] |
Wang Q, Ning L H, Yu W Q, et al. Detection of candidate loci and genes related to phosphorus efficiency at maturity through a genome-wide association study in soybean[J]. Agronomy, 2022, 12(9): 2031. DOI:10.3390/agronomy12092031
(  0) 0) |
| [34] |
Ali S, Moon Y S, Hamayun M, et al. Pragmatic role of microbial plant biostimulants in abiotic stress relief in crop plants[J]. Journal of Plant Interactions, 2022, 17(1): 705-718. DOI:10.1080/17429145.2022.2091801
(  0) 0) |
| [35] |
de Vries F T, Griffiths R I, Bailey M, et al. Soil bacterial networks are less stable under drought than fungal networks[J]. Nature Communications, 2018, 9(1): 3033. DOI:10.1038/s41467-018-05516-7
(  0) 0) |
| [36] |
Wang Y T, Xie Y Z, Ma H B, et al. Responses of soil microbial communities and networks to precipitation change in a typical steppe ecosystem of the Loess Plateau[J]. Microorganisms, 2022, 10(4): 817. DOI:10.3390/microorganisms10040817
(  0) 0) |
| [37] |
Li M H, Guo J J, Ren T, et al. Crop rotation history constrains soil biodiversity and multifunctionality relationships[J]. Agriculture, Ecosystems & Environment, 2021, 319: 107550.
(  0) 0) |
| [38] |
Shaffique S, Khan M A, Imran M, et al. Research progress in the field of microbial mitigation of drought stress in plants[J]. Frontiers in Plant Science, 2022, 13: 870626. DOI:10.3389/fpls.2022.870626
(  0) 0) |
| [39] |
Chen G X, Wu C F, Ge T D, et al. Response of soil multifunctionality to reduced microbial diversity (In Chinese)[J]. Environmental Science, 2022, 43(11): 5274-5285. [陈桂鲜, 吴传发, 葛体达, 等. 土壤多功能性对微生物多样性降低的响应[J]. 环境科学, 2022, 43(11): 5274-5285.]
(  0) 0) |
| [40] |
Wei J Q, Zheng C, Cui M Y, et al. Analysis on the relationship between biodiversity and ecosystem function in Loess Hilly Region (In Chinese)[J]. Acta Agrestia Sinica, 2023, 31(5): 1490-1500. [魏嘉琪, 郑诚, 崔梦莹, 等. 黄土丘陵区生物多样性与生态系统功能响应关系的分析[J]. 草地学报, 2023, 31(5): 1490-1500.]
(  0) 0) |
| [41] |
Chen W Q, Wang J Y, Chen X, et al. Soil microbial network complexity predicts ecosystem function along elevation gradients on the Tibetan Plateau[J]. Soil Biology and Biochemistry, 2022, 172: 108766. DOI:10.1016/j.soilbio.2022.108766
(  0) 0) |
| [42] |
Hong P B, Schmid B, De Laender F, et al. Biodiversity promotes ecosystem functioning despite environmental change[J]. Ecology Letters, 2022, 25(2): 555-569. DOI:10.1111/ele.13936
(  0) 0) |
| [43] |
Delgado-Baquerizo M, Reich P B, Trivedi C, et al. Multiple elements of soil biodiversity drive ecosystem functions across biomes[J]. Nature Ecology & Evolution, 2020, 4(2): 210-220.
(  0) 0) |
| [44] |
Chen K L, Zhou H K, Lu B B, et al. Single-species artificial grasslands decrease soil multifunctionality in a temperate steppe on the Qinghai–Tibet Plateau[J]. Agronomy, 2021, 11(11): 2092. DOI:10.3390/agronomy11112092
(  0) 0) |
| [45] |
Hillebrand H, Matthiessen B. Biodiversity in a complex world: Consolidation and progress in functional biodiversity research[J]. Ecology Letters, 2009, 12(12): 1405-1419. DOI:10.1111/j.1461-0248.2009.01388.x
(  0) 0) |
| [46] |
Zhang J H, Wang J Y, Meng Z X, et al. Soil microbial richness predicts ecosystem multifunctionality through co-occurrence network complexity in alpine meadow (In Chinese)[J]. Acta Ecologica Sinica, 2022, 42(7): 2542-2558. [张君红, 王健宇, 孟泽昕, 等. 土壤微生物多样性通过共现网络复杂性表征高寒草甸生态系统多功能性[J]. 生态学报, 2022, 42(7): 2542-2558.]
(  0) 0) |
| [47] |
Yang Y, Chai Y B, Xie H J, et al. Responses of soil microbial diversity, network complexity and multifunctionality to three land-use changes[J]. Science of the Total Environment, 2023, 859: 160255. DOI:10.1016/j.scitotenv.2022.160255
(  0) 0) |
| [48] |
Ma B, Wang H Z, Dsouza M, et al. Geographic patterns of co-occurrence network topological features for soil microbiota at continental scale in Eastern China[J]. The ISME Journal, 2016, 10(8): 1891-1901. DOI:10.1038/ismej.2015.261
(  0) 0) |
| [49] |
Gao C, Xu L, Montoya L, et al. Co-occurrence networks reveal more complexity than community composition in resistance and resilience of microbial communities[J]. Nature Communications, 2022, 13(1): 3867. DOI:10.1038/s41467-022-31343-y
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


