2. 中国科学院大学,北京 100049;
3. 中国科学院生态与环境研究中心,北京 100085
水作和旱作是我国农业生产中重要的两种耕作方式,以其为代表的水稻与小麦是我国两种主要农作物类型,不仅直接影响我国粮食安全,而且关系着陆地生态系统的稳定及持续性。水、旱耕作方式下土壤肥力存在明显差异,水稻土作为一种人为土壤,长期处于淹水的厌氧条件下,通常稻田土壤有机碳累积量高于旱作小麦土壤[1]。对于农田生态系统而言,土壤有机碳主要来源于植物根际沉积碳。植物作为第一生产者,生长过程中根系将光合作用产物以小分子有机物和植物残体的形式释放至土壤中,为根际微生物提供碳源和能源[2],同时微生物通过代谢活动将土壤中有机营养物质分解为无机养分,供给根系吸收与利用,这种“植物-土壤-微生物”构成的互作体系对维系农田生态系统功能和生产力至关重要[3]。在根际微区,土壤活性组分如土壤溶解性有机质(DOM)是土壤各组分中性质最活跃的一部分,是土壤质量和环境变化的“指示器”,同时土壤活性组分在微生物的参与下进行迁移与转化,其分布情况对土壤微生物活性、群落多样性及演替格局变化起重要作用[4]。
植物根际积聚了大量易利用的有机物质,其微生物数量和活性均成倍增加,进而导致其养分状况、微生物活性及微生物群落结构与非根际土壤相比具有显著差异[5-6],Hiltner将这种现象定义为“根际效应”[7]。植物根际是根系与微生物之间相互作用下形成的微生态系统,是土壤圈物质循环的重要界面,具有一定的研究复杂性[8]。根际土壤作为一个特殊的生态环境,各个土壤因子在根际与非根际土壤之间的相对变异幅度可用来表征根际效应(rhizosphere effects)强弱[9],也可用来表征根际土壤对非根际土壤的影响程度,这为定量比较水稻土和旱作小麦土壤的根际效应差异提供了可行的方法。
对于大多数植物而言,根际微域范围狭窄,细根根毛和土壤很难分离。在一般条件下区分根土界面和采集土壤样品存在着技术上的困难。根箱技术不仅可以区分根际和非根际,而且通过改良后还可以直接观测根际生物学和化学过程的变化。Ye等[10]在研究菌根根际的作用范围时,设计了三室根箱培养系统。植物种植在中室中,根系不能穿过中室两侧的尼龙网膜,该方法能够有效地进行根际土壤的采集。土壤细菌群落分布是土壤活性养分分布的重要反映。近年来,随着第二代测序技术的发展,能够克服传统培养技术的缺点,获得通量较高的样品基因信息,进而高效、全面地认识土壤微生物,目前已被广泛应用于土壤微生物遗传多样性的研究[11-12]。目前单独开展小麦或者水稻根际与非根际理化性质、根际效应及微生物活性的研究较多:Ma等[13]研究了根毛和根半径对小麦和玉米根际土壤酶活性空间分布的影响,发现小麦的根半径更小而酶活性更高;Fan等[14]在大空间尺度下研究华北平原小麦根际固氮菌的群落组成和多样性,发现与非根际土壤相比,小麦根际土壤中固氮菌网络结构相对简单却更加稳定;江春玉等[15]通过比较水稻根际和非根际土壤团聚体数量及碳氮含量的变化发现,水稻根际土壤团聚体稳定性更高;Zhu等[16]发现施用氮肥能够减弱水稻根系与微生物之间的氮素竞争以及胞外酶活性,进而降低CO2和CH4的根际激发效应。然而,目前在相同的土壤基质下分别种植水稻和小麦后对土壤根际效应以及细菌群落特征会产生怎样的影响尚不明确。
本研究利用根箱体系,在同一种土壤上分别种植水稻和小麦,实现根际土壤和非根际土壤的分离采集,并借助高通量测序分析方法研究水稻、小麦种植体系下根际效应、微生物群落结构和多样性的差异及其规律,以期从土壤活性养分分布及微生物群落特征的角度揭示水稻土和旱作小麦根际效应差异的原因,为维持和提升土壤生产力及其可持续性利用提供理论依据。
1 材料与方法 1.1 供试材料供试土壤样品采自中国科学院常熟农业生态试验站(31°33′N,120°42′E),该区域为亚热带季风气候,年平均温度16.6℃,降雨量1 321 mm。供试土壤类型为乌栅土,长期稻麦轮作,种植年限大于10 a。采集0~20 cm土壤,去除植物残体,过2 mm尼龙筛。取少部分风干,用于基本理化性质的分析。经分析,供试土壤的有机碳含量为20.3 g·kg-1,pH 7.31,全氮1.95 g·kg-1,全磷0.71 g·kg-1,有效磷12.1 mg·kg-1,速效钾104.5 mg·kg-1。供试植物为小麦(Triticum aestivum L)和水稻(Oryza sativa L),品种分别为扬麦16号和南梗46号。
根箱用聚氯乙烯(PVC)板加工制成,箱体大小为18 cm×10 cm×15 cm,包括根系生长室(或中室,20 mm)及左、右非根际土壤室(或左、右根围,各80 mm)三区,并于紧贴根系生长室两边插入1张由300目尼龙网制成的插片,将植物根系限制于中室内生长。
1.2 盆栽试验设计盆栽实验在根箱中进行,每盆加入相当于2.6 kg干土的供试土壤,并施入0.21 g·kg-1(以N计)尿素、0.07 g·kg-1(以P计)过磷酸钙和0.12 g·kg-1(以K计)氯化钾,混合均匀。种植水稻时,使土壤保持2 cm的淹水层;种植小麦时,土壤保持60%的田间持水量。
水稻种子于2016年7月18日浸种,两天后播种、育苗,一周后选取生长一致的幼苗移入根际中室进行盆栽实验(三盆,每盆三株)。小麦种子于2016年11月6日浸种、催芽,两天后选取饱满、大小均匀一致的种子均匀撒播于根际中室(三盆,每盆三株)。水稻和小麦均在出苗后40~45 d进行土壤取样。分别采集水稻和小麦根际和非根际土壤:根箱中室内的土样去除植株根系后一分为二作为根际土壤,两侧根围室内土壤分别充分混合后作为非根际土壤,最终根际和非根际土壤各有6个重复。采集的新鲜土壤样品一部分过2 mm筛后于4℃保存,用于测定土壤活性组分,另一部分于-20℃保存,用于土壤DNA的提取。
1.3 土壤样品测定项目与方法土壤有机碳(SOC)采用重铬酸钾氧化法测定,土壤脱氢酶(DHA)活性采用氯化三苯基四氮唑(TTC)比色法测定[17]。土壤微生物生物量碳(MBC)含量采用氯仿熏蒸浸提法(浸提液:0.05 mol·L-1 K2SO4;土/水= 1/4;总碳/总氮分析仪(Multi N/C analyzer 3100,Analytik Jena,德国))测定[18]。通过熏蒸土壤和未熏蒸土壤可溶性碳含量之差除以相应的转化系数(0.45)来计算土壤微生物生物量碳含量;以未熏蒸土壤的碳、氮测定结果作为土壤可溶性有机碳(DOC)、氮(DON)含量。
1.4 土壤样品高通量测序 1.4.1 DNA的提取采用Soil DNA Kit试剂盒(OMEGA公司,美国)进行土壤DNA的提取,每个样品取0.5 g土样。利用Nanodrop ND-2000(Thermo Scientific,美国)测定DNA的浓度和纯度。提取完成后,于-20℃保存、备用。
1.4.2 PCR扩增利用通用引物519F-907R对细菌16S rRNA基因的V4-V5区进行扩增。在519F的3’加一段5 bp的前端barcode序列以区分各个样品。PCR反应体系为50 µL,反应条件为:首先94℃ 10 min,然后35个循环(94℃ 30 s,55℃ 30 s,72℃ 45 s),最后72℃ 10 min。然后用QIAquick PCR Purification kit(Qiagen)试剂盒对PCR产物进行纯化,并使用NanoDrop ND-2000(Thermo Scientific,美国)测定产物浓度。最后将PCR纯化产物等摩尔数混合,利用中国科学院南京土壤研究所分析测试中心Illumina Miseq测序仪(Illumina Inc., CA,美国)进行上机测序。
1.4.3 高通量数据分析利用Quantitative Insights Into Microbial Ecology(QIIME)1.7.0-dev pipeline [19](http://www.qiime.org)对细菌16S rRNA基因序列进行分析;使用默认参数,保留高质量的序列(序列质量大于20,长度大于300 bp),利用5 bp的barcode进行样品拆分。共获得1 170 356条基因序列,每个样品的序列数在30 103和76 245之间。进一步利用QIIME(http://www.arb-silva.de/download/archive/qiime/)进行分析,在97%的相似度下将每个样品中的16S rRNA基因序列进行分类,获得各个分类水平下的分类单元。以最少序列数对每个样品进行抽平,然后进行Alpha和Beta多样性的计算分析[20]。
1.5 数据处理和统计分析利用R软件中的spe包进行主坐标分析(PCoA)。利用Canoco软件进行典范对应分析(Canonical Correspondence Analysis, CCA)。采用Microsoft Excel 2010和SPSS 18.0进行数据处理和统计分析(P < 0.05)。利用单因素方差分析(One-way ANOVA)对不同处理间差异显著性进行检验,然后用杜凯氏诚实意义测试(Turkey-HSD)进行多重比较。图表中数据均为平均值±标准误。
本文中根际效应(RE, Rhizosphere effect)大小采用如下公式进行计算[21]:
| $ {\rm{RE}} = {\rm{abs}}({C_{{\rm{rs}}}} - {C_{{\rm{bs}}}})/{C_{{\rm{bs}}}} \times 100\% $ | (1) |
式中,Crs和Cbs分别表示特定土壤微生物与理化指标在植物根际与非根际土壤的数值大小。
2 结果 2.1 水稻和小麦土壤活性组分及脱氢酶活性试验结束后,水稻和小麦根际土壤pH分别为6.74和6.75,而非根际土壤pH分别为7.07和6.81。图 1结果表明,水稻和小麦根际土壤DOC、MBC含量和脱氢酶活性均高于非根际,并且MBC和脱氢酶活性在根际非根际间差异显著。水稻和小麦土壤DON含量均表现为根际显著低于非根际土壤。其中,水稻的根际土壤DOC、MBC含量和脱氢酶活性与非根际土壤相比分别提高了1.13 mg·kg-1、28.0 mg·kg-1和1.49 mg·kg-1·h-1(以TPF计,下同);而小麦的根际土壤DOC、MBC含量和脱氢酶活性与非根际土壤相比分别提高了3.23 mg·kg-1、72.5 mg·kg-1和2.44 mg·kg-1·h-1。水稻与小麦的根际土壤DON含量与非根际土壤相比分别降低了20.4 mg·kg-1和36.4 mg·kg-1。而且小麦根际土中各指标相对于非根际的变化量均高于水稻土中的变化量。结果进一步表明,水稻和小麦的根际效应均显著促进了根际土壤可溶性有机碳、微生物生物量碳和脱氢酶活性的增加,同时导致DON含量降低。此外,水稻土壤DOC含量显著高于小麦,而水稻根际MBC含量和脱氢酶活性均显著小于小麦。水稻非根际DON含量显著低于小麦非根际,但其在根际土壤中无差异。
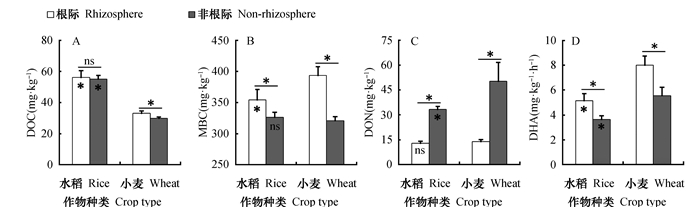
|
注:柱形图横线上方星号表示同一处理根际和非根际指标间的差异显著(P < 0.05),ns表示差异不显著;柱形图内星号表示相应指标在不同处理(根际或非根际)之间具有显著性差异(P < 0.05),ns表示差异不显著 Note: Asterisks on top of the columns denote significant difference between two treatments and those above the lines denote significant difference between rhizosphere and non-rhizosphere under the same treatment (*: P < 0.05; ns: not significant, t-test) 图 1 根际和非根际土壤可溶性有机碳(DOC, A)、微生物生物量碳(MBC, B)和可溶性有机氮(DON, C)含量和脱氢酶活性(DHA, D) Fig. 1 Contents of dissolved organic carbon (DOC) (A), microbial biomass carbon (MBC) (B), dissolved organic nitrogen (DON) (C) and dehydrogenase activity (DHA) (D) in the rhizosphere and non-rhizosphere soils relative to crop (rice and wheat) |
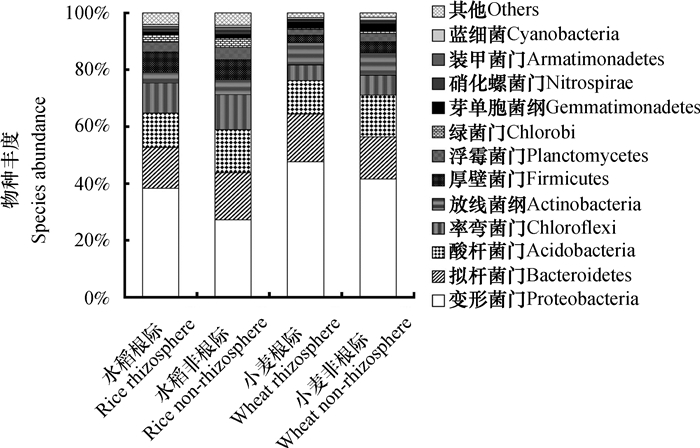
高通量测序结果表明,供试土壤微生物主要隶属于12个门,如图 2所示。其中,变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)这两类在土壤中占主导,二者在种植水稻的土壤中所占比例超过40%,在种植小麦的土壤中所占比例超过50%。门水平的微生物种群丰度在水稻、小麦根际和非根际间有明显不同。无论种植水稻还是小麦,根际土壤中变形菌门的相对丰度显著高于非根际土壤(P < 0.05),体现出根际的促生效应;拟杆菌门在两种作物之间的差异不显著,根际与非根际之间差异也不显著。
|
图 2 水稻、小麦根际和非根际土壤细菌群落的相对丰度(门水平) Fig. 2 Relative abundances of bacterial community in rhizosphere and non-rhizosphere soils relative to crop (rice and wheat) (at phyla level) |
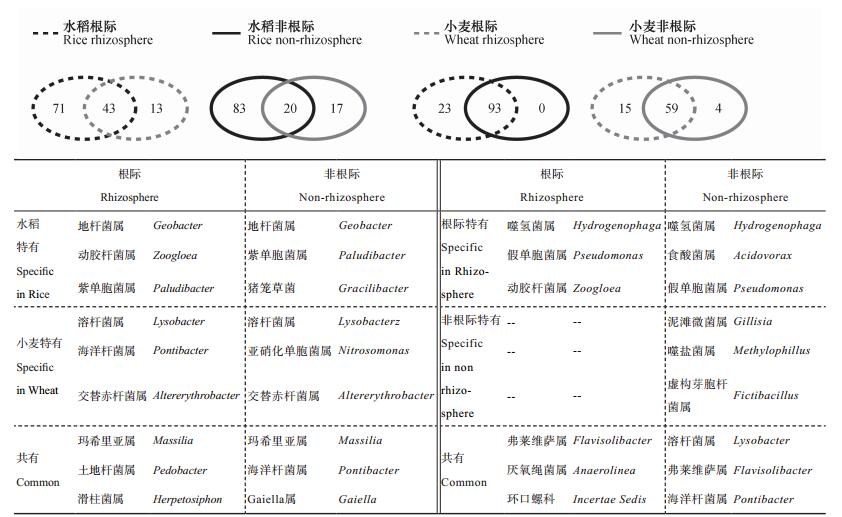
在属水平,对测序结果进行韦恩图分析(图 3),结果表明,水稻和小麦根际土壤共有的属有43个,丰度最高的三个属依次为:Massilia、Pedobacter和Herpetosiphon;水稻和小麦根际土壤中特有的属分别有71和13个。水稻和小麦非根际土壤共有的属有20个,丰度最高的前三个为:Massilia、Pontibacter和Gaiella;水稻和小麦非根际土壤特有的属分别有83和17个。比较作物的根际和非根际土壤,可以发现水稻根际和非根际共有的属有93个,根际有23个特有的属,丰度最高的前三个分别为:Hydrogenophage、Pseudomonas和Zoogloea;而水稻非根际无特有的属。小麦根际和非根际共有的属为59个,根际特有的属有15个,丰度最高的前三个分别为:Hydrogenophage、Acidovorax和Pseudomonas,非根际特有的属有4个。从上述结果不难看出,根际特有的微生物种群多于非根际土壤,而种植水稻的土壤中特有的微生物种类明显多于种植小麦的土壤。
|
注:圆圈相交部分表示共有微生物数目,非相交部分表示特有微生物数目 Note: The intersecting part of the circles represents the number of common microorganisms, and the non-intersecting part represents the number of specific microorganisms 图 3 基于16S rRNA基因的水稻、小麦根际及非根际土壤微生物群落韦恩图(属水平)及特有、共有微生物 Fig. 3 Venn diagram of microorganisms in rhizosphere and non-rhizosphere soils based on 16S rRNA gene (genus level) and specific and common microorganisms relative to crop (rice and wheat) |
选取Chao 1和香农(Shannon)指数来表征土壤细菌群落的Alpha多样性。结果显示,水稻、小麦根际土壤细菌群落的多样性均低于非根际土壤,小麦根际和非根际土壤多样性均显著低于水稻土(表 1)。
|
|
表 1 水稻、小麦根际和非根际土壤Alpha多样性 Table 1 Alpha diversity indices of rhizosphere and non-rhizosphere soils relative to crop (rice and wheat) |
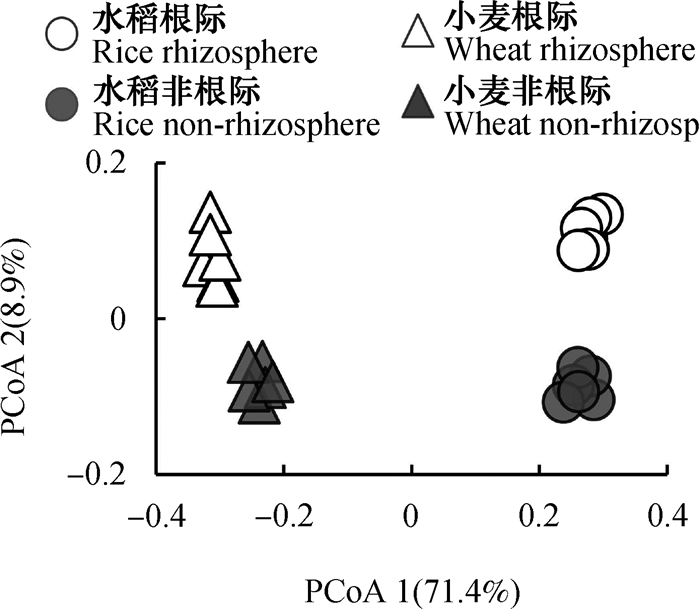
根据各土壤样品的细菌物种组成数据(OTUs)计算布雷柯蒂斯(bray_curtis)距离,基于bray_curtis距离矩阵进行了主坐标(PCOA)分析(图 4),对细菌群落的Beta多样性进行可视化。结果表明,主坐标1(PCoA1)解释了总方差的71.4%,主坐标2(PCoA2)解释了8.9%,二者总共解释了总变异的80.3%。四组土壤样品细菌群落分布于不同象限,彼此间差异显著(P < 0.0001,非参数的多元方差分析(Permanova)。其中,水稻与小麦土壤细菌群落主要在第一主坐标上分异,根际土壤与非根际土壤细菌群落在第二主坐标分异。两种作物体系下,根际和非根际细菌群落在主坐标2分布规律一致,说明根际对群落的影响在两种土壤类型中具有一致性。而在主坐标1上小麦根际与非根际之间的差异显著大于水稻((0.061 ± 0.013) > (0.015 ± 0.009)),说明小麦根际与非根际土壤间细菌群落的变异显著大于水稻。总体而言,土壤类型主导细菌群落结构变异,而根际和非根际对细菌群落的影响也同样是显著且不可忽视的。
|
图 4 水稻、小麦根际和非根际土壤细菌群落结构的主坐标分析 Fig. 4 Principal coordinates analysis (PCoA) of bacterial community compositional structure in rhizosphere and non-rhizosphere soils relative to crop (rice and wheat) |
Alpha多样性指标的规律和趋势一致(表 1),选取Chao 1指数作为细菌Alpha多样性的代表指数进行根际效应的计算,同时计算了土壤养分和酶活(图 5)的根际效应。结果表明,与水稻土壤DOC、MBC、DHA、DON和Chao 1指数对应的根际效应大小分别为2.07%、8.61%、41.11%、61.07%和7.62%,小麦的分别为3.37%、22.62%、44.48%、71.43%和16.59%(图 5)。总体而言,小麦以上5个指标的根际效应均大于水稻,其中,MBC、DON和Chao 1对应的根际效应在水稻和小麦间显著不同(图 4)。
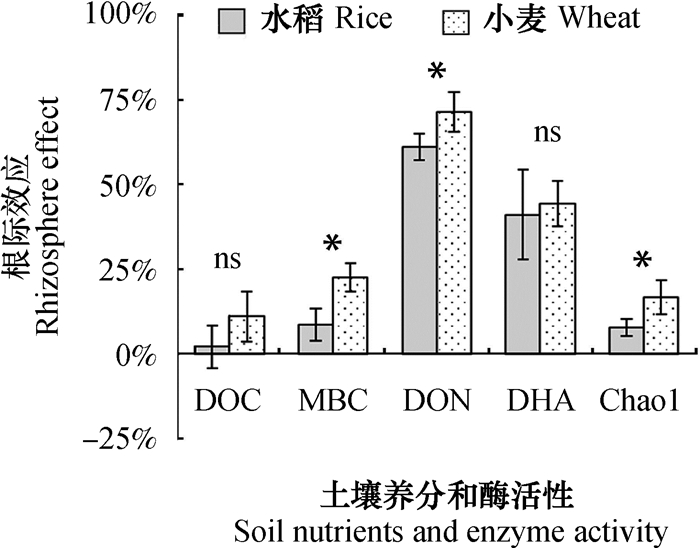
|
注:柱形图上方星号表示相应指标在水稻和小麦之间具有显著性差异(P < 0.05),ns表示差异不显著 Note: Asterisks on top of the columns indicate significant differences between rice and wheat in corresponding factor (*: P < 0.05; ns: not significant, t-test) 图 5 水稻和小麦各指标根际效应的比较 Fig. 5 Comparison between rice and wheat in rhizosphere effect |
将5个环境因子(DOC、DON、MBC、pH和DHA)与水稻、小麦根际和非根际土壤样品OTU数据进行CCA分析。如图 6所示,DOC对水稻和旱作小麦土壤细菌群落组成的影响最大,pH与DHA夹角接近180°,说明两者呈显著负相关;脱氢酶活性和MBC之间夹角呈锐角,两者之间具有较好的正相关关系。水稻根际细菌群落与DOC呈正相关关系,非根际细菌群落与pH呈正相关关系。小麦根际细菌群落与DHA和MBC呈正相关关系,而非根际细菌群落与DON呈正相关关系。
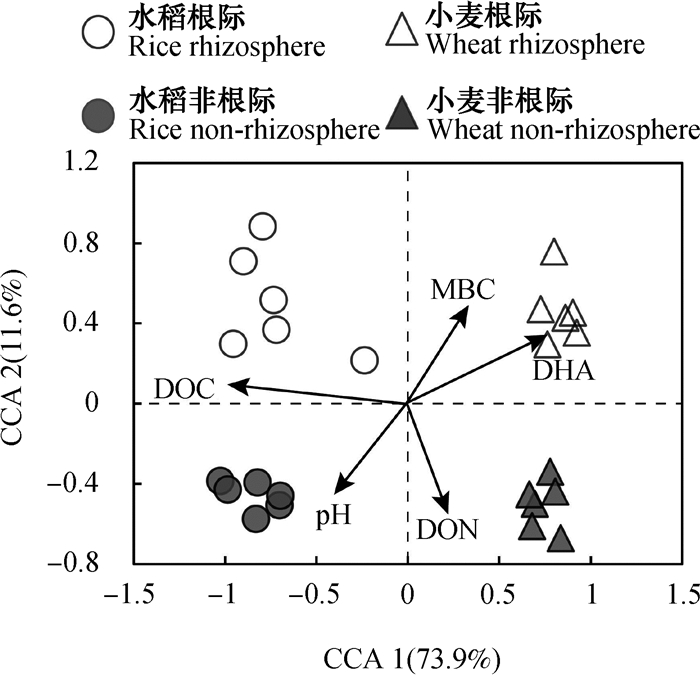
|
图 6 土壤细菌群落与土壤因子的典范对应分析(CCA) Fig. 6 Canonical correspondence analysis (CCA) of soil factors and soil bacterial community |
土壤可溶性养分是土壤微生物的直接营养来源,土壤微生物生物量是土壤有机质和土壤养分转化与循环的动力,是表征土壤活性碳库的重要指标。土壤微生物生物量碳和土壤酶活性在一定程度上可以表征土壤肥力,一般地,土壤酶活性是土壤生物与非生物活性的总和,不仅受土壤微生物的影响,还受环境中非生物因素的影响。本研究结果显示,水稻和小麦根际DOC、MBC和脱氢酶活性均高于非根际土壤,这与刘新志和李旭霞[22]的研究结果一致。主要原因是根际土壤受根际效应的影响,植物根系向根际土壤中分泌较多从简单的碳水化合物、氨基酸到较为复杂的生长物质的有机物质,为微生物提供充足的营养物质和能量,促进微生物的生长增殖,导致根际土壤微生物相对活跃[23]。根系分泌物中的低分子量有机酸可以活化根际养分和螯合重金属,植物可以通过改变体内有机酸代谢及根际有机酸的分泌来适应环境胁迫。水稻和小麦因为作物种类以及水分条件的不同,根系有机酸的分泌也存在差异。研究表明,水稻根系有机酸以酒石酸、酚酸、柠檬酸、草酸、苹果酸、琥珀酸和氨基酸为主[24];小麦根际土壤中有机酸种类主要由乳酸、乙酸、柠檬酸和富马酸组成,有机酸总量随着生育期的推移而呈上升趋势,在灌浆期达到峰值[25]。水稻和小麦根际有机酸种类和含量的差异较大,可能是造成根际效应差异的一部分原因,但是对水稻和小麦有机酸根际生态效应缺乏系统研究,尚需深入探讨。土壤有机氮(SON)是土壤微生物氮的源和库,土壤有机氮和微生物氮均为DON的重要来源[26]。水稻、小麦根际DON含量均低于非根际土壤,土壤中的DON可以直接或者经过间接转化后被作物和菌根吸收, 导致根际可溶性有机氮含量降低,这与Chu等[27]对根际可溶性氮素的研究结果一致。一方面,水稻、小麦根际微生物生物量和土壤脱氢酶活性显著高于非根际土壤,并且小麦根际和非根际土壤这两个指标均显著高于水稻(P < 0.05),这可能是因为旱地土壤的通气状况更好。另一方面,根际土壤具有较充分的营养源,有利于土壤微生物活性的产生和维持,因此,水稻、小麦根际微生物生物量和土壤脱氢酶活性显著高于非根际土壤(P < 0.05)。
在土壤微生物多样性方面,本研究通过对16S rRNA的V4~V5区进行高通量测序,分析了水稻、小麦根际和非根际土壤细菌的群落结构和多样性。水稻、小麦根际土壤细菌多样性均低于非根际土壤,这与王晓雯等[28]的结果相一致。水稻根际和非根际细菌Alpha多样性均显著高于小麦,可能是由于在淹水条件下氧气匮乏,微生物代谢的电子传递过程需要更多样的电子受体(如铁离子和乙酸等)来代替氧气,因此与旱地土壤相比,淹水土壤中的微生物群落需要较高的微生物多样性来维持正常代谢功能[29]。水稻土的优势细菌类群为变形菌门,其次为拟杆菌门、酸杆菌门、绿弯菌门等,从门的分类水平来看,变形菌门的丰度在根际和非根际之间有较大差异。种植水稻的土壤中微生物的多样性,尤其是厌氧微生物,如Desulfuromonadales、Rhodocyclales的丰度显著高于种植小麦的土壤,这与种植水稻时土壤淹水、缺氧有关,微生物需要利用更多类型的电子受体完成物质、能量代谢。水稻根际和非根际共有的微生物更多,并且其非根际特有物种为零,暗示了水稻根际和非根际土壤性质的趋同。表明由于土壤水分的作用,土壤物质交换和转运的作用更充分,导致水稻土的表观根际效应更弱,而水稻根际对非根际的影响和作用更大。此外,水稻、小麦根际和非根际微生物群落结构组成受土壤养分和微生物活性等多种环境因素(DOC、MBC、DON、pH和DHA)的影响,整体结构具有显著性差异。土壤中的活性碳组分更容易被微生物利用,因此,DOC对水稻和小麦的微生物群落影响最大,该结果与Darrah[30]的研究结果一致,该研究表明根际微生物的种群分布与沿根的可溶性碳分布有关。土壤pH的变化同样影响了微生物群落分布,因此,合理的水分管理措施是改善土壤微生物群落的必要条件。
同一土壤采用不同的土地利用方式后,受到植物根系、土壤水分等因素的影响,其土壤活性养分分配和土壤微生物活性存在很大差异,导致根际和非根际土壤理化性质及土壤微生物群落结构显著不同,最终形成不同强度的根际效应。通常,过去的研究倾向于用根际效应表征植物对土壤,尤其是根际土壤的影响,并认为根际效应的值越大,植物输入土壤的有机物质越多,微生物活性越强[31]。从这一认识出发,无论从土壤活性组分、脱氢酶活性还是微生物群落多样性的角度,小麦的根际效应均大于水稻。然而,本研究发现水稻根际和非根际之间各项指标的差异均小于旱作小麦土壤,这说明水稻根际对非根际的影响程度更大,根际的作用范围更大,因而减小了根际非根际之间的差异。这可能与水稻土壤中可溶性物质能更容易、更有效地在根际与非根际之间进行转运有密切关系。有研究表明,分蘖期的水稻和小麦的根际分泌物输入量并无太大的差异[32],与旱地土壤相比,水稻土处于持续淹水状态,土壤可溶性养分在根际非根际之间物质的转运更为容易,导致土壤理化性质在根际非根际之间产生的梯度被缩小,根际效应强度较弱,因此,造成小麦和水稻根际效应强度差异的原因更多的是来自于两种土壤中物质转运能力的不同。有研究[33]表明,旱地土壤的根际激发效应显著高于淹水土壤,根际有机碳的矿化作用更强,这可能与旱作小麦土壤的根际积累了更多的有机碳有关。一方面,旱地土壤通气状况好于淹水土壤,微生物呼吸作用较强,微生物生物量和活性均高于淹水土壤[34],根际较高的微生物活性和呼吸不利于小麦根际土壤有机碳的长期累积;另一方面,由于旱地土壤水分含量较低,可溶性物质的流动性较小,小麦根系分泌物大量滞留在根系附近的区域,促进了土壤微生物的增殖,产生了较高活性微生物生物量,进一步加强了根际效应,不利于土壤有机质的转运和累积。以上两点分析可能是水稻土有机质含量高于旱地土壤的一个原因。此外,小麦根际和非根际土壤之间DON浓度差显著高于水稻,说明旱作小麦土壤中非根际氮素无法及时转运至根际,对根际氮素亏缺的补偿效应低于水稻土,这可能会导致旱作土壤中肥料利用率降低。因此,不能简单地认为根际效应越大,土壤环境质量越好,在未来的研究中对根际效应的解读需要从多方面综合衡量。
4 结论“植物根系-土壤-微生物”三者之间的相互作用共同影响了土壤养分含量、微生物活性及微生物群落分布,进而影响土壤生态系统健康、稳态和功能。无论水稻还是小麦,其根际和非根际理化性质、微生物群落结构均存在显著差异,其中可溶性有机碳对水稻和旱作小麦土壤细菌群落组成的影响最大。水稻、小麦两种种植体系下,根际效应表现为小麦大于水稻。从根际和非根际土壤相互作用的角度,水稻根际土壤与非根际土壤的差异较小,体现出水稻的根际有更广的延伸,根际的作用范围较广。本研究从新的角度解释了根际土壤养分分布与根际效应之间的联系,这对于将来的研究中深入探讨淹水土壤和旱作土壤有机碳的累积差异,解释水田、旱地土壤肥力演变规律,以及实际生产中土壤生产力可持续性的维持方面具有重要意义。
| [1] |
Wang M C, Yang C H. Type of fertilizer applied to a paddy-upland rotation affects selected soil quality attributes . Geoderma, 2003, 114: 93-108. DOI:10.1016/S0016-7061(02)00356-7
(  0) 0) |
| [2] |
Lynch J M, Whipps J M. Substrate flow in the rhizosphere . Plant and Soil, 1990, 129: 1-10. DOI:10.1007/BF00011685
(  0) 0) |
| [3] |
Hernández M, Dumont M G, Yuan Q, et al. Different bacterial populations associated with the roots and rhizosphere of rice incorporate plant-derived carbon . Applied and Environmental Microbiology, 2015, 81(6): 2244-2253. DOI:10.1128/AEM.03209-14
(  0) 0) |
| [4] |
Kaibitz K, Solinger S, Park J H, et al. Controls on the dynamics of dissolved organic matter in soils:A review . Soil Science, 2000, 165(4): 277-304. DOI:10.1097/00010694-200004000-00001
(  0) 0) |
| [5] |
Kuzyakov Y, Blagodatskaya E. Microbial hotspots and hot moments in soil:Concept & review . Soil Biology & Biochemistry, 2015, 83: 184-199.
(  0) 0) |
| [6] |
Baudoin E, Benizri E, Guckert A. Impact of artificial root exudates on the bacterial community structure in bulk soil and maize rhizosphere . Soil Biology & Biochemistry, 2003, 35(9): 1183-1192.
(  0) 0) |
| [7] |
Hartmann A, Rothballer M, Schmid M. Lorenz Hiltner, a pioneer in rhizosphere microbial ecology and bacteriology research . Plant and Soil, 2008, 312(1): 7-14.
(  0) 0) |
| [8] |
Ryan P R, Delhaize E, Jones D L. Function and mechanism of organic anion exudation from plant roots . Annual Review of Plant Biology, 2001, 52: 527-560. DOI:10.1146/annurev.arplant.52.1.527
(  0) 0) |
| [9] |
Baraniya D, Puglisi E, Ceccherini M T, et al. Protease encoding microbial communities and protease activity of the rhizosphere and bulk soils of two maize lines with different N uptake efficiency . Soil Biology & Biochemistry, 2016, 96: 176-179.
(  0) 0) |
| [10] |
Ye S, Yang Y, Xin G, et al. Studies of the Italian ryegrass–rice rotation system in southern China:Arbuscular mycorrhizal symbiosis affects soil microorganisms and enzyme activities in the Lolium mutiflorum L. rhizosphere . Applied Soil Ecology, 2015, 90: 26-34. DOI:10.1016/j.apsoil.2015.01.017
(  0) 0) |
| [11] |
贺纪正, 李晶, 郑袁明. 土壤生态系统微生物多样性-稳定性关系的思考. 生物多样性, 2013, 21(4): 411-420. He J Z, Li J, Zheng Y M. Thoughts on the microbial diversity–stability relationship in soil ecosystems (In Chinese). Biodiversity Science, 2013, 21(4): 411-420. (  0) 0) |
| [12] |
安婷婷, 侯小畔, 周亚男, 等. 氮肥用量对小麦开花后根际土壤特性和产量的影响. 中国农业科学, 2017, 50(17): 3352-3364. An T T, Hou X P, Zhou Y N, et al. Effects of nitrogen fertilizer rates on rhizosphere soil characteristics and yield after anthesis of wheat (In Chinese). Scientia Agricultura Sinica, 2017, 50(17): 3352-3364. DOI:10.3864/j.issn.0578-1752.2017.17.010 (  0) 0) |
| [13] |
Ma X, Zarebanadkouki M, Kuzyakov Y, et al. Spatial patterns of enzyme activities in the rhizosphere:Effects of root hairs and root radius . Soil Biology & Biochemistry, 2018, 118: 69-78.
(  0) 0) |
| [14] |
Fan K, Weisenhorn P, Gilbert J, et al. Soil pH correlates with the co-occurrence and assemblage process of diazotrophic communities in rhizosphere and bulk soils of wheat fields . Soil Biology & Biochemistry, 2018, 121: 185-192.
(  0) 0) |
| [15] |
江春玉, 刘萍, 刘明, 等. 不同肥力红壤水稻土根际团聚体组成和碳氮分布动态. 土壤学报, 2017, 54(1): 139-149. Jiang C Y, Liu P, Liu M, et al. Dynamics of aggregates composition and C, N distribution in rhizosphere of rice plants in red paddy soils different in soil fertility (In Chinese). Acta Pedologica Sinica, 2017, 54(1): 139-149. (  0) 0) |
| [16] |
Zhu Z, Ge T, Liu S, et al. Rice rhizodeposits affect organic matter priming in paddy soil:The role of N fertilization and plant growth for enzyme activities, CO2 and CH4 emissions . Soil Biology & Biochemistry, 2018, 116: 369-377.
(  0) 0) |
| [17] |
鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科学技术出版社, 2000. Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. (  0) 0) |
| [18] |
吴金水, 林启美, 黄巧云, 等. 土壤微生物生物量测定方法及应用. 北京: 气象出版社, 2006. Wu J S, Lin Q M, Huang Q Y, et al. Soil microbial biomass-Methods and application (In Chinese). Beijing: China Meteorological Press, 2006. (  0) 0) |
| [19] |
Caporaso J G, Kuczynski J, Stombaugh J, et al. QIIME allows analysis of high-throughput community sequencing data . Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303
(  0) 0) |
| [20] |
Shaw A K, Halpern A L, Beeson K, et al. It's all relative:Ranking the diversity of aquatic bacterial communities . Environmental Microbiology, 2008, 10(9): 2200-2210. DOI:10.1111/emi.2008.10.issue-9
(  0) 0) |
| [21] |
Philips R P, Fahey T J. Tree species and mycorrhizal associations influence the magnitude of rhizosphere effects . Ecology, 2006, 87(5): 1302-1313. DOI:10.1890/0012-9658(2006)87[1302:TSAMAI]2.0.CO;2
(  0) 0) |
| [22] |
刘新志, 李旭霞. 太原市不同园林植物根际和非根际土壤养分和酶活性的差异. 山西科技, 2017, 32(5): 53-56. Liu X Z, Li X X. Differences of soil nutrients and enzyme activities in rhizosphere and non-rhizosphere soil of different landscape plants in Taiyuan (In Chinese). Shanxi Science and Technology, 2017, 32(5): 53-56. DOI:10.3969/j.issn.1004-6429.2017.05.015 (  0) 0) |
| [23] |
朱金山, 张慧, 马连杰, 等. 不同沼灌年限稻田土壤微生物群落分析. 环境科学, 2018, 39(5): 2401-2411. Zhu J S, Zhang H, Ma L J, et al. Diversity of the microbial community in rice paddy soil with biogas slurry irrigation analyzed by Illumina sequencing technology (In Chinese). Environmental Science, 2018, 39(5): 2401-2411. (  0) 0) |
| [24] |
徐国伟, 陆大克, 王贺正, 等. 施氮和干湿灌溉对水稻抽穗期根系分泌有机酸的影响. 中国生态农业学报, 2018, 26(4): 516-525. Xu G W, Lu D K, Wang H Z, et al. Coupling effect of alternate wetting and drying irrigation and nitrogen rate on organic acid in rice root secretion at heading stage (In Chinese). Chinese Journal of Eco-Agriculture, 2018, 26(4): 516-525. (  0) 0) |
| [25] |
肖靖秀, 郑毅, 汤利, 等. 间作小麦蚕豆不同生长根际有机酸和酚酸变化. 土壤学报, 2016, 53(3): 689-693. Xiao J X, Zheng Y, Tang L, et al. Changes in organic and phenolic acids in rhizosphere of interplanted wheat and faba bean with growth stage (In Chinese). Acta Pedologica Sinica, 2016, 53(3): 689-693. (  0) 0) |
| [26] |
Gonet S S, Debska B. Dissolved organic carbon and dissolved nitrogen in soil under different fertilization treatments . Plant, Soil and Environment, 2006, 52(2): 55-63.
(  0) 0) |
| [27] |
Chu Q, Sha Z, Nakamura T, et al. Differential responses of soybean and sorghum growth, nitrogen uptake, and microbial metabolism in the rhizosphere to cattle manure application:a rhizobox study . Journal of Agricultural and Food Chemistry, 2016, 64(43): 8084-8094. DOI:10.1021/acs.jafc.6b03046
(  0) 0) |
| [28] |
王晓雯, 洪振瀚, 刘安瑞, 等. 基于荧光定量PCR和高通量测序技术的葡萄园土壤细菌群落结构多样性分析. 酿酒科技, 2016(11): 28-36. Wang X W, Hong Z H, Liu A R, et al. Analysis of bacterial community structure in vineyard soil by RT-PCR and high throughput sequencing (In Chinese). Liquor-making Science & Technology, 2016(11): 28-36. (  0) 0) |
| [29] |
Lovley D R, Phillips E J P. Novel mode of microbial energy metabolism:Organic carbon oxidation coupled to dissimilatory reduction of iron or manganese . Applied and Environmental Microbiology, 1998, 54: 1472-1480.
(  0) 0) |
| [30] |
Darrah P R. Models of the rhizosphere . Plant and Soil, 1991, 138(2): 147-158. DOI:10.1007/BF00012241
(  0) 0) |
| [31] |
Sauer D, Kuzyakov Y, Stahr K. Spatial distribution of root exudates of five plant species as assessed by 14C labeling . Journal of Plant Nutrition and Soil Science, 2006, 169: 360-362. DOI:10.1002/(ISSN)1522-2624
(  0) 0) |
| [32] |
张传更, 高阳, 张立明, 等. 水分管理措施对施用有机肥麦田土壤酶活性和微生物群落的影响. 灌溉排水学报, 2018, 37(2): 92-101. Zhang C G, Gao Y, Zhang L M, et al. Effects of water management on soil enzyme activitiesand microbial community structure in wheat fields with organic fertilizer application (In Chinese). Journal of Irrigation and Drainage, 2018, 37(2): 92-101. (  0) 0) |
| [33] |
Qiu H, Zheng X D, Ge T, et al. Weaker priming and mineralisation of low molecular weight organic substances in paddy than in upland soil . European Journal of Soil Biology, 2017, 83: 9-17. DOI:10.1016/j.ejsobi.2017.09.008
(  0) 0) |
| [34] |
Bulgarelli D, Schlaeppi K, Spaepen S, et al. Stucture and functions of the bacterial microbiota of plants . Annual Review of Plant Biology, 2013, 64(1): 807-838. DOI:10.1146/annurev-arplant-050312-120106
(  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. State Key Laboratory of Urban and Regional Ecology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China
 2019, Vol. 56
2019, Vol. 56


