2. 中国农业科学院麻类研究所, 长沙 410205;
3. 江苏省地理信息资源开发与利用协同创新中心, 南京 210023
2. Institute of Bast Fiber Crops, Chinese Academy of Agricultural Sciences, Changsha 410205, China;
3. Jiangsu Center for Collaborative Innovation in Geographical Information Resource Development and Application, Nanjing 210023, China
龙牙百合(Lilium brownii var. viridulum)为百合科百合属多年生草本植物,其鳞茎含有丰富的糖类、蛋白质、矿物质、生物碱和甾体皂苷等有效成分,具有养阴润肺、清心安神等功效,是一种“药食同源”的天然保健品 [1-2]。湖南省邵阳市隆回县是龙牙百合的道地产区和主产区,具有悠久的种植历史,形成了年栽培面积3万亩(1公顷为15亩)、年产值7亿元的产业规模,素有“中国龙牙百合之乡”的美誉[3-4][冯游滔, 2017 #15]。但是,龙牙百合忌地性极强,需要经过3~7年的换茬歇地才能再植,且随着种植历史的延长,适宜栽种龙牙百合的土壤资源日益枯竭,严重威胁当地百合产业的稳定和发展[5]。因此,解决龙牙百合忌连作问题,缩短土壤资源再利用周期,对保证龙牙百合的可持续生产及其道地性,提高农民收入和发展地方经济具有重要的意义。
研究表明,土壤酸化、土传病原菌富集和化感物质累积是导致龙牙百合再植障碍的主导因素,而土传病害高发是其主要特征[3,5]。其中,鳞茎腐烂病,又称为根腐病、枯萎病,是龙牙百合再植过程中发生最普遍的土传病害,严重时可致绝收。尖孢镰刀菌(Fusarium oxysporum)、腐皮镰刀菌(Fusarium solani)和立枯丝核菌(Rhizoctonia solani)是龙牙百合根腐病的主要致病菌,在无寄主植物存在的条件下,其休眠孢子仍能在土壤中存活多年[6-7]。轮作是农业上防治土传病害的传统措施,但对于道地性较强的经济作物,短期的非寄主作物轮作抑菌和防病效果均不佳,而长期轮作又不符合集约化农业对土壤资源的需求[8-9]。化学灭菌是农业生产上使用最广泛的土壤灭菌措施,杀菌效果稳定[10-11]。但是,由于化学熏蒸剂对土壤微生物的作用没有选择性,在杀灭土传病原菌的同时,也杀灭了大量的土著有益微生物,而病原菌在再植寄主作物特异性根系分泌物的刺激和有利的酸性土壤条件下能迅速增殖至发病阈值[10];且氯化苦、克百威等化学熏蒸剂因其高毒、高残留性即将被全面禁用[11]。此外,龙牙百合栽种后出苗慢,地表裸露时间长,易滋生各类杂草,从而与百合竞争养分、水分、光照和生长空间,造成百合产量和品质下降[12]。目前农业上主要依靠化学药剂防除田间杂草,包括乙草胺等苗前土壤处理剂和草甘膦等苗后茎叶处理剂[12]。化学农药虽具有快速、高效等特点,但长期使用不仅会增加田间杂草的耐药性,还会带来土壤污染、食品安全等一系列问题,严重威胁着农业可持续发展和人体健康[13-14]。因此,寻找龙牙百合病害和草害的绿色综合防控措施对于减少农药使用量,实现龙牙百合产业绿色可持续发展具有重要的意义。
强还原土壤处理(Reductive soil disinfestation,RSD)是一种通过向土壤中添加大量易分解有机物料,灌溉至土壤饱和并覆膜隔绝空气,快速创造强烈还原环境的土壤处理方法,具有操作简单,生态环保的特点[11,15]。大量研究表明,RSD处理能够有效杀灭多种土传病原真菌、细菌和有害植食性线虫、缓解土壤酸化和次生盐渍化、降解化感物质和改善土壤结构,但对农田杂草种子库的影响以及对草害的防控效果仍不明确[9,11,16]。因此,本研究以龙牙百合栽培土壤为研究对象,通过不同有机物料RSD处理研究其对再植龙牙百合生长不利因子尤其是土传病原菌和杂草种子库的影响,旨在寻求一种有效消减再植作物生长不利因子的方法,为减少农药使用,实现农业绿色可持续发展提供一定的理论依据和技术支持。
1 材料与方法 1.1 研究区概况田间试验设置于中国农业科学院麻类研究所沅江试验站(112°11'E,28°51'N),位于湖南省益阳市沅江市马公铺村,海拔25 m,属亚热带湿润季风气候,四季分明,气候温和,降水集中。年均气温为16.9℃,年均降水量为1 322 mm,主要集中在4—6月份,全年无霜期为276 d。试验前该基地已种植龙牙百合一年,其耕作层土壤理化性质为pH 4.71,电导率81.18 μS·cm–1,有机碳和全氮的含量分别为12.03和1.34 g·kg–1。
1.2 试验设计与土壤样品采集田间试验共设置3个处理:1)CK,不做任何土壤处理的对照;2)MO,添加液体有机物料的RSD处理(6 t·hm–2,C/N:21);3)SB,添加固体有机物料的RSD处理(15 t·hm–2,C/N:94)。RSD处理的具体操作参照王宝英等[15],处理共维持35 d。各处理重复5次,即5垄,按随机排列分布。每垄面积50 m2(2 m × 25 m),各垄之间由30 cm深,30 cm宽的沟隔开。
待RSD处理结束后,揭开塑料薄膜,用直径为2.5 cm的土钻在各小区按“S”形采样路线随机采取8个0~20 cm的土芯,混合均匀后剔除植物残根和石砾等杂质,过2 mm筛。过筛后的土样一部分4℃保存,用于土壤基本理化性质和土壤微生物活性的测定;一部分–80℃保存,用于土壤基因组DNA的提取。
1.3 土壤理化性质和微生物活性的测定土壤pH采用S220K pH计(Mettler,Switzerland)按照水土比2.5︰1进行测定;土壤NH4+-N和NO3–-N用2 mol·L–1 KCl溶液按1︰5(m︰v)进行浸提,浸提液过滤后用流动分析仪(Skalar San++,Breda,The Netherlands)测定。
土壤微生物活性以FDA(荧光素二乙酸酯)水解酶活性表征,采用荧光素比色法测定[17]。具体步骤如下:称取过2 mm筛的鲜土2 g于50 mL离心管中,分别加入15 mL磷酸缓冲液(60 mmol·L–1,pH 7.6)和0.2 mL FDA基质溶液(1 mg·mL–1),密封后在30℃、100 r·min–1条件下振荡反应20 min,震荡结束后迅速加入15 mL氯仿/甲醇(2︰1)溶液终止反应,2 000 r·min–1离心3 min后取上清液过0.22 μm滤膜至10 mL离心管中,滤液用分光光度计在波长为490 nm处测定吸光值,并根据标准曲线计算FDA水解酶的活性(μg·g–1·h–1)。标准曲线参照王宝英等[15]的方法构建。
1.4 土壤DNA提取及荧光定量PCR分析准确称取0.5 g保存于–80℃冰箱中的土壤样品,使用FastDNA® SPIN Kit for Soil(MP Biomedicals,USA)按说明书步骤提取土壤总DNA,所有DNA样品经DS-11超微量分光光度计(DeNovix,USA)进行质量控制后保存于–20℃冰箱待用。实时荧光定量PCR扩增反应在QuanStudio 3 Real-Time PCR system(Applied Biosystems,USA)上进行,反应体系(20 μL)包括SYBR® Premix Ex TaqTM(2×,Takara,中国大连)10 μL,参比荧光染料ROX Ⅱ(50×)0.4 μL,正、反引物(10 μmol·L–1)各1 μL,DNA模板2 μL和dd H2O 5.6 μL。用于定量细菌16S rDNA(Eub338F/Eub518R)、真菌(ITS1F/ITS2R)、尖孢镰刀菌(ITS1F/AFP308R)、腐皮镰刀菌(ITS1F/AFP346R)、立枯丝核菌(ST-RS1F/ITS4R)ITS基因的引物及扩增条件如表 1所示。各基因的标准曲线参照Zhao等[18]的方法构建,均符合测定要求。采用杀菌率评估RSD处理对病原菌的抑制效果。
|
|
表 1 荧光定量PCR所用引物和扩增条件 Table 1 Primers and PCR conditions used in real-time PCR |
待RSD处理结束揭膜60 d后,在各小区随机选取1 m2(1 m × 1 m)的样方,采集样方中的全部杂草带回实验室,借鉴《中国杂草志》[24]和《中国农田杂草原色图谱》[25]对杂草进行分类鉴定,并统计其数量和生物量。采用密度、多度、频度对杂草个体数量及其出现频率进行评估,其中杂草密度是指每平方米内杂草的数量;杂草多度是指某种杂草数量占样方内杂草总数的比例;杂草频度是指某种杂草出现的样方数占全部样方数的比例。采用抑制率评估RSD处理对杂草数量、鲜质量和干质量的防除效果。同时,采用多种α多样性指数对田间杂草群落多样性进行评估[26],具体计算方法如下:
| $ {\rm{Shannon多样性指数}}H\prime = - \sum\limits_{i = 1}^S {\frac{{{n_i}}}{N}\ln \frac{{{n_i}}}{N}} $ | (1) |
| $ {\rm{Simpson优势度指数}}{\text{λ }} = 1 - {\sum\limits_{i = 1}^S {\left( {\frac{{{n_i}}}{N}} \right)} ^2} $ | (2) |
| $ {\rm{Pielou均匀度指数}}{\text{E}} = \frac{{H\prime }}{{\ln S}} $ | (3) |
| $ {\rm{Margalef丰富度指数}}({\text{D}}) = \frac{{S - 1}}{{\ln N}} $ | (4) |
式中,S为杂草群落物种数,N为杂草群落所有物种个体总数,ni为第i种杂草个体数。
1.6 统计分析本试验为单因素试验,采用IBM SPSS Statistics 22.0进行统计分析,单因素方差(One-way ANOVA)配合Tukey’s HSD检验多处理间均值差异的显著性;并用T检验对病原菌杀菌率和杂草抑制率进行差异显著性检验。基于各杂草种类多度的Bray-Curtis相似性矩阵,采用R软件(v3.1.2)对杂草群落结构进行主成分分析(Principal component analysis,PCA),并用置换多因素方法进行差异显著性检验。
2 结果 2.1 土壤理化性质和微生物活性如表 2所示,与CK处理相比,强还原土壤处理(MO,SB)均能显著(P < 0.05)提升土壤pH,且MO处理后的土壤pH显著(P < 0.05)高于SB处理。同时,MO和SB处理较CK处理均能显著(P < 0.05)降低土壤NO3–-N含量,增加土壤NH4+-N含量,其中MO处理后土壤的NO3–-N(2.96 mg·kg–1)和NH4+-N(56.81 mg·kg–1)含量分别显著(P < 0.05)低于和高于SB处理(NO3–-N:10.36 mg·kg–1;NH4+-N:25.94 mg·kg–1)。此外,不同有机物料RSD处理对土壤微生物活性的影响不同,其中SB处理后土壤微生物活性达到276.1 μg·g–1·h–1,显著(P < 0.05)高于CK处理的118.0 μg·g–1·h–1;而MO处理后土壤微生物活性略微下降,但与CK处理相比差异不显著。
|
|
表 2 不同有机物料RSD处理对土壤理化性质和微生物活性的影响 Table 2 Effects of reductive soil disinfestation on physicochemical properties and microbial activity of the soil relative to type of the material incorporated |
由图 1A可知,与CK处理相比,强还原土壤处理(MO、SB)均能显著(P < 0.05)增加土壤中细菌的数量,其中MO处理的增加效应更明显,但与SB处理相比差异不显著。如图 1B所示,MO处理后土壤真菌数量有所降低,而SB处理后土壤真菌略微增加,但较CK处理均不显著;而SB处理后土壤真菌数量显著(P < 0.05)高于MO处理。此外,与CK处理相比,MO处理能够显著(P < 0.05)提高土壤细菌/真菌比,而SB处理对其影响不显著(图 1C),这可能与RSD处理所用的有机物料性质,尤其是碳氮比对细菌和真菌生长的影响不同有关。
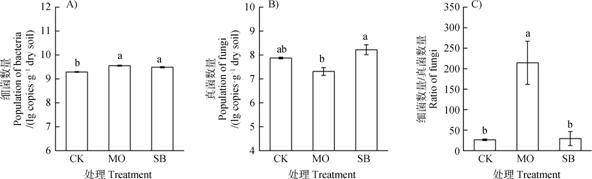
|
注:误差线表示标准误(n = 5),柱上方不同字母表示处理间差异显著(P < 0.05)。下同。 Note:Error bars indicate the standard error of the means of replicates. Different letters above the bars mean significant difference between treatments at 0.05 level. The same below. 图 1 不同有机物料RSD处理对土壤细菌、真菌数量及细菌/真菌比例的影响 Fig. 1 Effects of reductive soil disinfestation on population of the bacteria(A), fungi(B), and the bacteria/fungi ratio(C)relative to type of the material incorporated |
由图 2A—图 2C可知,与CK处理相比,MO和SB处理均能显著(P < 0.05)降低土壤中尖孢镰刀菌、腐皮镰刀菌和立枯丝核菌的数量,且MO和SB处理间无显著差异。其中,MO和SB处理对三种病原菌的杀菌率分别为99.10%~99.94%和98.84%~99.98%。此外,MO和SB处理均显著(P < 0.05)降低了尖孢镰刀菌/真菌和腐皮镰刀菌/真菌的比值,其中尖孢镰刀菌/真菌的比值由CK处理的112.02‰降低至RSD处理的0.02‰~0.27‰,腐皮镰刀菌/真菌的比值由CK处理的30.02‰降低至RSD处理的0.23‰~1.08‰(图 2D—图 2E);而MO和SB处理虽在一定程度上也降低了立枯丝核菌/真菌的比值,但较CK处理差异不显著(图 2F)。表明RSD处理能有效杀灭多种土传病原真菌,并降低其在真菌类群中的占比。
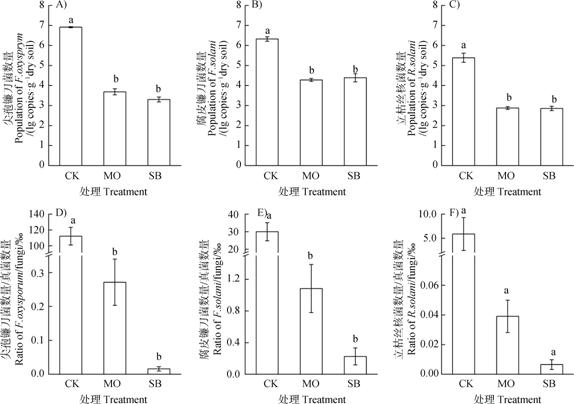
|
图 2 不同有机物料RSD处理对土壤病原菌数量及病原菌/真菌比例的影响 Fig. 2 Effects of reductive soil disinfestation on population of Fusarium oxysporum(A), Fusarium solani(B)and Rhizoctonia solani(C), and the Fusarium oxysporum/fungi(D), Fusarium solani/fungi(E)and Rhizoctonia solani/fungi ratio(F)relative to type of the material incorporated |
如表 3所示,与CK处理的398.6 株·m–2相比,RSD处理能将田间杂草总数显著(P < 0.05)降低至15.8~23.6 株·m–2,其抑制率高达94.1%~96.0%,表明RSD处理能够有效抑制土壤杂草种子库中大部分杂草的萌发。同时,RSD处理均能显著(P < 0.05)降低田间杂草的生物量,其中RSD处理后杂草鲜质量从CK处理的95.7 g·m–2下降至3.2~14.6 g·m–2,抑制率为84.7%~96.6%;干质量从CK处理的11.6 g·m–2下降至0.6~3.4 g·m–2,抑制率为71.0%~94.7%。此外,MO处理后田间杂草的鲜质量和干质量均显著(P < 0.05)低于SB处理,且其对杂草鲜质量和干质量的抑制率均显著(P < 0.05)高于SB处理。这表明RSD能显著降低田间草害的发生,且MO处理的效果优于SB处理。
|
|
表 3 不同有机物料RSD处理对杂草总数、鲜质量、干质量及其抑制效果的影响 Table 3 Effects of reductive soil disinfestation on weed total number, fresh weight, dry weight, and their inhibition rate relative to type of the material incorporated |
不同处理田间共鉴定出13种杂草,隶属于9个科,其中CK处理包含全部13种杂草,MO和SB处理仅包含其中的9种,且有差异。如表 4所示,早熟禾、马唐和卷耳是CK处理杂草群落中的优势杂草,其密度分别为175.8、100.0和58.4 株·m–2,多度分别为43.4%,22.4%和16.4%,而频度均为100%。RSD处理均能显著降低早熟禾、马唐和卷耳等优势杂草的密度,其中MO处理后三种优势杂草的密度降至1.2~10 株·m–2,抑制率达到94.3%~98.8%;而SB处理后其密度和抑制率分别为0.2~4.6 株·m–2和95.4%~99.9%。除对优势杂草有较好的抑制效果外,RSD处理对一些非优势杂草如狗尾草、荠菜、繁缕、猪殃殃等也有较好的抑制效果。此外,RSD处理还对各杂草的多度和频度有一定的影响,其中MO处理后早熟禾、黄鹌菜和马唐的多度最高,分别占到53.6%,13.7%和10.5%,且大部分杂草的频度有所下降;而SB处理后田旋花、马唐和老鹳草的多度最高,分别为48.7%,17.9%和13.0%,有些杂草的频度有所下降,但下降程度低于MO处理。
|
|
表 4 不同有机物料RSD处理对杂草密度、多度及频度的影响 Table 4 Effects of reductive soil disinfestation on density, relative density, and frequency of the weed community relative to type of the material incorporated |
PCA分析结果(图 3A)表明:RSD处理能够显著(P < 0.001)改变土壤杂草群落结构,且不同有机物料的RSD处理对杂草群落结构的影响不同,其中SB处理的影响较MO处理更显著。如图 3B所示,RSD处理后田间杂草群落的Shannon多样性指数、Simpson优势度指数、Pielou均匀度指数、Margalef丰富度较CK处理差异均不显著,其中Shannon多样性指数和Simpson优势度指数均有所下降,而Pielou均匀度指数有所增加。表明RSD处理能够在一定程度上降低杂草群落的多样性和丰富度,并通过抑制杂草优势种来提高杂草群落的均匀度。
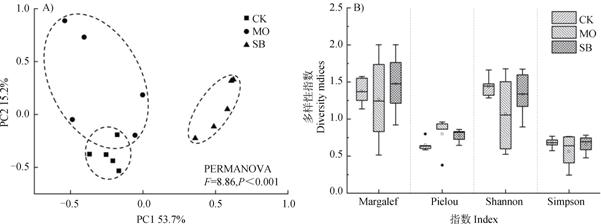
|
图 3 不同有机物料RSD处理对杂草群落结构(A)和α多样性指数(B)的影响 Fig. 3 Effects of reductive soil disinfestation on structure(A)and α-diversity indices(B)of the weed community relative to type of the material incorporated |
土传病原菌是引起再植作物生长不利的主要因子之一。研究表明,土传病原菌富集引起的土壤微生物区系失衡是导致再植龙牙百合病害高发、频发的主导因素[3,27]。因此,降低龙牙百合栽培土壤中病原菌的数量,改善土壤微生物群落结构与组成是减少再植龙牙百合病害发生的关键[5,28]。本研究发现,液体和固体有机物料RSD处理35 d后,土壤中根腐病致病菌尖孢镰刀菌、腐皮镰刀菌和立枯丝核菌的数量显著降低,其杀菌率高达98.8%,这与Zhao等[29]的研究结果一致,即不同有机物料的RSD处理均能有效抑制土传病原菌的数量。这也从侧面进一步证实了RSD处理杀菌作用的广谱性和高效性,其潜在的杀菌机理包括RSD处理过程中形成的强烈厌氧环境以及有机物料厌氧分解产生的小分子有机酸、还原性金属离子(Fe2+、Mn2+)、H2S、NH3等有毒有害物质[10,30-31]。研究发现酸性土壤条件更利于土传病原菌的生长和增殖,而对有益菌的生长起一定的抑制作用[32-33],因此RSD处理后土壤pH的提高对抑制病原菌也有一定的贡献。同时,本研究还发现,RSD处理后土壤中尖孢镰刀菌和腐皮镰刀菌在整个真菌群落中的占比显著下降,表明RSD处理能够在高效杀灭土传病原真菌的同时,还能维持或刺激土壤中其他真菌类群的存活与增殖,从而通过加剧其他真菌类群与病原菌在养分和生态位上的竞争,以增强RSD处理后土壤微生物的整体抑病能力[29]。此外,MO处理后,土壤中细菌/真菌比较CK处理显著提高,这在一定程度上表明该处理具有将土壤微生物区系由龙牙百合栽培后根腐病菌主导的“真菌型”向病原菌数量显著降低、细菌数量显著增加的“细菌型”重塑的能力,即RSD处理能够重建健康的土壤微生物区系[14,16]。
3.2 RSD能显著降低田间杂草萌发率及其生物量草害是影响龙牙百合产量和品质的障碍因子之一。田间杂草往往生长迅速,不但与作物争夺水、肥、光、热等资源,而且还是多种病虫害的中间寄主,如果防除不及时就会蔓延,从而造成作物减产和品质下降[34-35]。在本研究中,经过35 d的RSD处理,田间杂草的数量显著降低,其抑制率高达93.9%~95.2%,这表明大部分杂草种子在RSD过程中已经被杀死。有研究表明,小分子有机酸对杂草种子具有毒害作用,可使其失活,从而降低其萌发率[26]。Achmon等[36]研究发现,RSD处理过程中挥发性有机酸的产生是造成土壤中杂草种子死亡的主要原因之一,且其浓度与杂草种子的致死率显著相关。朱睿等[26]以RSD处理过程中产生的有机酸种类和浓度为依据,通过有机酸直接浸种和水琼脂培养基添加的种子萌发实验,发现乙酸和丁酸能够在较低的浓度下就能显著抑制杂草种子的萌发。因此,RSD处理过程中有机物料厌氧分解产生的小分子有机酸是导致杂草种子失活的关键原因之一。众所周知,土壤中杂草种子的存活需要不断地进行呼吸作用,朱睿等[26]研究发现,经过厌氧处理的杂草种子,其萌发受到一定的抑制,这说明RSD过程中形成的厌氧环境也是导致其死亡的原因之一。此外,经含还原性金属离子(Fe2+、Mn2+)存在的溶液处理之后,杂草种子的萌发率显著下降,表明其对杂草种子的抑制也具有一定的作用[26]。综上,RSD处理抑制杂草种子的萌发是一个综合作用,其抑制效果不仅与RSD处理选择的有机物料有关,也与杂草种类及其对不利环境的耐受程度密切相关[36]。除抑制杂草的数量以外,RSD处理还能显著降低杂草的生物量,改变杂草群落结构与多样性,因此我们认为RSD处理可以显著降低草害对龙牙百合生长的不利影响。
3.3 RSD能改善土壤理化性质,降解化感物质除土传病原菌和田间杂草以外,土壤理化性质退化也是造成再植龙牙百合生长不利的因子之一,其中因其根系分泌物积累引起的土壤酸化不仅会抑制龙牙百合对营养元素的吸收,还会刺激土传病原菌的生长繁殖,从而导致再植龙牙百合生长受阻或病害加重[3,5]。研究表明,龙牙百合生长的最适土壤pH为5.5~6.5,而连作会导致土壤pH显著下降,其中连续种植龙牙百合三年以后,其土壤pH降低至4.37[3]。本研究发现,RSD处理可以显著提高龙牙百合栽培土壤的pH,其中MO处理后土壤pH提高了0.76个单位,显著高于SB处理。这是因为液体有机物料的碳氮比较低,易分解有机碳含量较高,可以在短时间内通过刺激更多的土壤微生物生长,消耗氧气并形成更为剧烈的土壤还原环境,从而消耗了更多的H+[29]。此外,在酸性土壤条件下,MO处理过程中由于矿化引起的土壤铵态氮积累可能会引起再植百合生长受限,因此在RSD处理结束后需要充分翻耕土壤或短期种植绿肥,以降低铵态氮积累对作物生长不利的可能影响。有学者认为化感自毒作用是导致百合属植物产生连作障碍的重要原因之一[5]。研究表明,百合在生长过程中分泌的邻苯二甲酸二丁酯、邻苯二甲酸二异辛酯等苯甲酸酯类衍生物和2,4-二叔丁基苯酚、抗氧剂2246等酚酸类物质具有一定的化感自毒作用[5,37]。Li等[9]的研究表明,RSD处理能够有效降解三七栽培土壤中的皂苷类化感物质,其中对Rb1和Rh1降解率达到82%以上。因此,本研究中RSD对龙牙百合生长不利因子的消减作用可能还包括对百合某些化感物质的降解。
4 结论强还原土壤处理是一种快速有效的土壤修复方法,能够显著降低龙牙百合栽培土壤中根腐病菌尖孢镰刀菌、腐皮镰刀菌和立枯丝核菌的数量,改善土壤微生物群落结构,还能有效抑制杂草种子库中杂草的萌发,降低田间杂草的密度和生物量。因此,强还原土壤处理可以有效消减再植龙牙百合生长不利因子,为缩短土地资源再利用周期,保证龙牙百合的可持续生长及其道地性,提高当地农民收入和发展地方经济“保驾护航”,同时可为降低农药使用量,推动农业绿色可持续发展作出一定的贡献。
| [1] |
Zhao J, Zhao Z G, Tang F L, et al. Progress in Lilium brownii var. viridulum (In Chinese)[J]. Guizhou Agricultural Sciences, 2017, 45(7): 78-81. DOI:10.3969/j.issn.1001-3601.2017.07.018 [赵健, 赵志国, 唐凤鸾, 等. 龙牙百合的研究进展[J]. 贵州农业科学, 2017, 45(7): 78-81.]
(  0) 0) |
| [2] |
Tian X H, Liu X Y, Ren Y F. Research progress and prospect of edible lily (In Chinese)[J]. Northwest Horticulture, 2020(3): 24-26. [田雪慧, 刘秀云, 任艳芬. 食用百合研究进展及展望[J]. 西北园艺, 2020(3): 24-26.]
(  0) 0) |
| [3] |
冯游滔. 邵阳龙牙百合连作障碍机制及其治理措施研究[D]. 长沙: 湖南农业大学, 2016. Feng Y T. Studies on mechanism of Lilium brownii var. viridulum continuous cropping obstacle and control measurements in Shaoyang[D]. Changsha: Hunan Agricultural University, 2016. (  0) 0) |
| [4] |
Zhang Y H. Investigation and thinking on promoting industrialization poverty alleviation in Longhui County (In Chinese)[J]. Huxiang Forum on Agriculture, Rural areas and Farmers, 2009, 554-558. [张宇宏. 隆回县推进产业化扶贫工作的调查与思考[J]. 湖湘三农论坛, 2009, 554-558.]
(  0) 0) |
| [5] |
Chen J H, Wu J F, Fang J, et al. Research progress on formation mechanisms and control techniques of continuous cropping obstacles in Lilium spp (In Chinese)[J]. Journal of Changjiang Vegetables, 2019(20): 41-47. [陈军华, 吴剑锋, 方洁, 等. 百合连作障碍形成机制及防治技术研究进展[J]. 长江蔬菜, 2019(20): 41-47.]
(  0) 0) |
| [6] |
Misawa T, Kayamori M, Kurose D, et al. First report of Rhizoctonia disease of lily caused by Rhizoctonia solani AG-11 in Japan[J]. Journal of General Plant Pathology, 2017, 83(6): 406-409. DOI:10.1007/s10327-017-0735-6
(  0) 0) |
| [7] |
Zhu H Y, Xia H, Gao B D. Pathogen identification of edible lily(Lilium brownie var. viridulum) bulb rot during growth season in Hunan (In Chinese)[J]. Acta Phytopathologica Sinica, 2012, 42(5): 525-527. DOI:10.3969/j.issn.0412-0914.2012.05.010 [朱海燕, 夏花, 高必达. 湖南省食用百合生长期鳞茎腐烂病的病原鉴定[J]. 植物病理学报, 2012, 42(5): 525-527.]
(  0) 0) |
| [8] |
Wang L S. Study on overcoming continuous cropping obstacles of cut-flower lily by rotation technology (In Chinese)[J]. Agriculture and Technology, 2018, 38(19): 99-100, 119. [王立仕. 应用轮作技术克服切花百合连作障碍与研究[J]. 农业与技术, 2018, 38(19): 99-100, 119.]
(  0) 0) |
| [9] |
Li Y L, Wang B Y, Chang Y F, et al. Reductive soil disinfestation effectively alleviates the replant failure of Sanqi ginseng through allelochemical degradation and pathogen suppression[J]. Applied Microbiology and Biotechnology, 2019, 103(8): 3581-3595. DOI:10.1007/s00253-019-09676-4
(  0) 0) |
| [10] |
Zhao J, Mei Z, Zhang X, et al. Suppression of Fusarium wilt of cucumber by ammonia gas fumigation via reduction of Fusarium population in the field[J]. Scientific Reports, 2017, 7: 43103. DOI:10.1038/srep43103
(  0) 0) |
| [11] |
Cai Z C, Zhang J B, Huang X Q, et al. Application of reductive soil disinfestation to suppress soil-borne pathogens (In Chinese)[J]. Acta Pedologica Sinica, 2015, 52(3): 469-476. [蔡祖聪, 张金波, 黄新琦, 等. 强还原土壤灭菌防控作物土传病的应用研究[J]. 土壤学报, 2015, 52(3): 469-476.]
(  0) 0) |
| [12] |
Shi L, Zou L J, Shen D J, et al. Study on the occurrence characteristics and chemical control of weeds in lily (In Chinese)[J]. Pesticide Science and Administration, 2018, 39(9): 56-63. DOI:10.3969/j.issn.1002-5480.2018.09.014 [石磊, 邹利军, 沈旦军, 等. 百合田杂草发生特点及化除技术研究[J]. 农药科学与管理, 2018, 39(9): 56-63.]
(  0) 0) |
| [13] |
Zhou W G, Meng Y J, Chen F, et al. Current status and research progress of development and tankmix application of herbicides (In Chinese)[J]. Pratacultural Science, 2018, 35(1): 93-105. [周文冠, 孟永杰, 陈锋, 等. 除草剂研发及其复混使用的现状与展望[J]. 草业科学, 2018, 35(1): 93-105.]
(  0) 0) |
| [14] |
Yang L, Deng J J, Liao J, et al. Risk assessment of soil and lily in Jiangxi Province and Hunan Province (In Chinese)[J]. Biological Disaster Science, 2016, 39(4): 282-286. DOI:10.3969/j.issn.2095-3704.2016.04.063 [阳丽, 邓家军, 廖健, 等. 江西、湖南2省百合及其土壤风险性评估[J]. 生物灾害科学, 2016, 39(4): 282-286.]
(  0) 0) |
| [15] |
Wang B Y, Li J Z, Huang X Q, et al. Effects of reductive soil disinfestation on yield, population and activity of microorganisms in continuously cropped soils of Chinese kale (In Chinese)[J]. Soils, 2019, 52(2): 316-323. [王宝英, 李金泽, 黄新琦, 等. 土壤强还原处理对连作芥蓝产量、微生物数量及活性的影响[J]. 土壤, 2019, 52(2): 316-323.]
(  0) 0) |
| [16] |
Strauss S L, Greenhut R F, McClean A E, et al. Effect of anaerobic soil disinfestation on the bacterial community and key soilborne phytopathogenic agents under walnut tree-crop nursery conditions[J]. Plant and Soil, 2017, 415(1/2): 493-506. DOI:10.1007/s11104-016-3126-4
(  0) 0) |
| [17] |
Adam G, Duncan H. Development of a sensitive and rapid method for the measurement of total microbial activity using fluorescein diacetate(FDA) in a range of soils[J]. Soil Biology & Biochemistry, 2001, 33(7/8): 943-951.
(  0) 0) |
| [18] |
Zhao J, Ni T, Li J, et al. Effects of organic-inorganic compound fertilizer with reduced chemical fertilizer application on crop yields, soil biological activity and bacterial community structure in a rice-wheat cropping system[J]. Applied Soil Ecology, 2016, 99: 1-12. DOI:10.1016/j.apsoil.2015.11.006
(  0) 0) |
| [19] |
Dorsch M, Lane D, Stackebrandt E. Towards a phylogeny of the genus Vibrio based on 16S rRNA sequences[J]. International Journal of Systematic Bacteriology, 1992, 42(1): 58-63. DOI:10.1099/00207713-42-1-58
(  0) 0) |
| [20] |
Muyzer G, de Waal E C, Uitterlinden A G. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J]. Applied and Environmental Microbiology, 1993, 59(3): 695-700. DOI:10.1128/aem.59.3.695-700.1993
(  0) 0) |
| [21] |
Duran P, Thiergart T, Garrido-Oter R, et al. Microbial interkingdom interactions in roots promote Arabidopsis survival[J]. Cell, 2018, 175(4): 973-983. DOI:10.1016/j.cell.2018.10.020
(  0) 0) |
| [22] |
Lievens B, Brouwer M, Vanachter A C R C, et al. Real-time PCR for detection and quantification of fungal and oomycete tomato pathogens in plant and soil samples[J]. Plant Science, 2006, 171(1): 155-165. DOI:10.1016/j.plantsci.2006.03.009
(  0) 0) |
| [23] |
Lievens B, Brouwer M, Vanachter A C R C, et al. Quantitative assessment of phytopathogenic fungi in various substrates using a DNA macroarray[J]. Environmental Microbiology, 2005, 7(11): 1698-1710. DOI:10.1111/j.1462-2920.2005.00816.x
(  0) 0) |
| [24] |
Li Y H. Weeds in China (In Chinese). Beijing: China Agriculture Press, 1998. [李扬汉. 中国杂草志[M]. 北京: 中国农业出版社, 1998.]
(  0) 0) |
| [25] |
Editorial Committee of Farmlan weeds in China. Farmland weeds in China: A collection of coloured illustrative plates (In Chinese). Beijing: China Agriculture Press, 1990. [《中国农田杂草原色图谱》编委会. 中国农田杂草原色图谱[M]. 北京: 农业出版社, 1990.]
(  0) 0) |
| [26] |
朱睿. 强还原土壤处理方案选择及对杂草抑制效果的研究[D]. 南京: 南京师范大学. 2017. Zhu R. Optimizing reductive soil disinfestation and suppression effect on weed germination[D]. Nanjing: Nanjing Normal University, 2017. (  0) 0) |
| [27] |
Du G Y, Xu R P. Occurrence characteristics and integrated control technology of main diseases and insect pests of Lilium brownii var. viridulum (In Chinese)[J]. Anhui Agricultural Science Bulletin, 2014, 20(16): 65, 9. [杜贵勇, 胥任平. 龙牙百合主要病虫害的发生特点及综合防治技术[J]. 安徽农学通报, 2014, 20(16): 65, 9.]
(  0) 0) |
| [28] |
Zhou J M, Song R, Zhang T S, et al. Control effects of soil disinfectants on Lilium lancifolium Thunb disease (In Chinese)[J]. Journal of Mountain Agriculture and Biology, 2016, 35(6): 76-80. [周佳民, 宋荣, 张天术, 等. 不同土壤消毒剂对药用百合病害防治效果的研究[J]. 山地农业生物学报, 2016, 35(6): 76-80.]
(  0) 0) |
| [29] |
Zhao J, Zhou X, Jiang A Q, et al. Distinct impacts of reductive soil disinfestation and chemical soil disinfestation on soil fungal communities and memberships[J]. Applied Microbiology and Biotechnology, 2018, 102(17): 7623-7634. DOI:10.1007/s00253-018-9107-1
(  0) 0) |
| [30] |
Ueki A, Kaku N, Ueki K. Role of anaerobic bacteria in biological soil disinfestation for elimination of soil-borne plant pathogens in agriculture[J]. Applied Microbiology and Biotechnology, 2018, 102(15): 6309-6318. DOI:10.1007/s00253-018-9119-x
(  0) 0) |
| [31] |
Momma N, Yamamoto K, Simandi P, et al. Role of organic acids in the mechanisms of biological soil disinfestation(BSD)[J]. Journal of General Plant Pathology, 2006, 72(4): 247-252. DOI:10.1007/s10327-006-0274-z
(  0) 0) |
| [32] |
Yao Y L, Huang F L, Xue Z Y, et al. Effect of different soil environmental factors on the proliferation of the pathogen of cucumber Fusarium wilt (In Chinese)[J]. Soil and Fertilizer Sciences in China, 2015(1): 106-110. [姚燕来, 黄飞龙, 薛智勇, 等. 土壤环境因子对土壤中黄瓜枯萎病致病菌增殖的影响[J]. 中国土壤与肥料, 2015(1): 106-110.]
(  0) 0) |
| [33] |
Li S L, Liu Y Q, Wang J, et al. Soil acidification aggravates the occurrence of bacterial wilt in South China[J]. Frontiers in Microbiology, 2017, 8: 703. DOI:10.3389/fmicb.2017.00703
(  0) 0) |
| [34] |
Qu Y, Feng B L. Weed biological control technology: Research progress (In Chinese)[J]. Chinese Agricultural Science Bulletin, 2019, 35(4): 108-115. [屈洋, 冯佰利. 杂草生物控制技术研究进展[J]. 中国农学通报, 2019, 35(4): 108-115.]
(  0) 0) |
| [35] |
Abouziena H F, Haggag W M. Weed control in clean agriculture: A review[J]. Planta Daninha, 2016, 34(2): 377-392. DOI:10.1590/S0100-83582016340200019
(  0) 0) |
| [36] |
Achmon Y, Fernández-Bayo J D, Hernandez K, et al. Weed seed inactivation in soil mesocosms via biosolarization with mature compost and tomato processing waste amendments[J]. Pest Management Science, 2017, 73(5): 862-873. DOI:10.1002/ps.4354
(  0) 0) |
| [37] |
Huang Y F, Zhang E H, Zhang X H, et al. Autotoxicity of water extracts from continuous cropping soil of Lilium davidii var. unicolor salisb (In Chinese)[J]. Journal of Northwest A & F University: Natural Science Edition, 2020, 48(7): 84-93. [黄钰芳, 张恩和, 张新慧, 等. 兰州百合连作土壤水浸液自毒作用研究[J]. 西北农林科技大学学报: 自然科学版, 2020, 48(7): 84-93.]
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59


